NAD+ är ett koenzym som finns i alla levande celler och är nödvändigt för att kroppen ska fungera på ett grundläggande sätt. NAD+-nivåerna sjunker när vi åldras, vilket tros vara en bidragande orsak till åldrandeprocessen.
Nikotinamid adenin dinukleotid (NAD+/NADH)
NAD upptäcktes först under jästfermentering. Sedan upptäckten har det visat sig att NAD (nikotinamid-adenindinukleotid) är en viktig kofaktor som deltar i praktiskt taget alla cellulära reaktioner. Dessa inkluderar DNA-reparation, immunsystemets funktion, ATP-produktion och cirkadisk klockfunktion. NAD+ främjar energiproduktionen och gör det möjligt för cellerna att fungera korrekt. Dysreglering av NAD+-nivåerna har förknippats med metaboliska sjukdomar och åldersrelaterade sjukdomar, inklusive neurodegeneration, defekta immunsvar och cancer..
NAD har två former - NAD+ och NADH, som båda styr elektronöverföringsreaktioner:
- NAD+ är ett oxidationsmedel som plockar upp elektroner från andra molekyler och därmed blir reducerat
- NADH är ett reduktionsmedel som bildas från reducerat NAD+ och sedan används för att donera elektroner till andra molekyler, vilket gör att NAD+ blir NAD+ igen
- Elektronerna i NADH kan lagra energi som omvandlas till ATP i mitokondrierna under en process som kallas oxidativ fosforylering i mitokondrierna (se Biohacker's Handbook's Exercise kapitel för mer information)
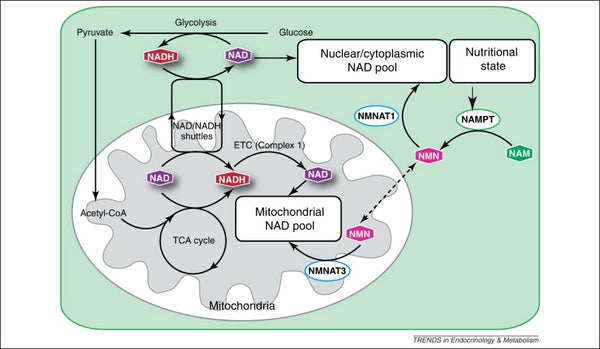
Bild: Underhåll av den mitokondriella NAD-poolen.
källa: Stein, L. & Imai, S. (2012). Den dynamiska regleringen av NAD-metabolism i mitokondrier. Trender inom endokrinologi och metabolism 23 (9): 420–428.
Introduktion till NAD+
Idealiskt sett befinner sig NAD+ i en homeostatisk status med biosyntes, konsumtion, återvinning och nedbrytning på både cellulär och systemisk nivå. Mänskliga celler kan syntetisera NAD+ de novo från tryptofan via kynureninvägen eller från nikotinsyra (NA) via Preiss-Handler-vägen. Det är dock inte möjligt, återvinns dock det mesta NAD+ från nikotinamid (NAM), NA, nikotinamidribosid (NR) och nikotinamidmononukleotid (NMN) i återvinningsvägen för att upprätthålla de cellulära NAD+ -nivåerna. NAD+ kan reduceras till NADH i olika metaboliska processer, bland annat glykolys, fettsyraoxidation och Krebs cykel.
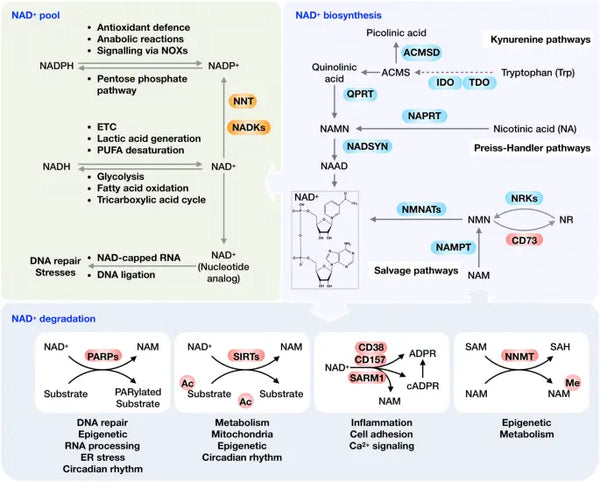
Bild: Översikt över NAD+-metabolismen och dess fysiologiska funktion.
Källa: NAD: Xie, N. et al (2020). NAD + -metabolism: patofysiologiska mekanismer och terapeutisk potential. Signaltransduktion och målinriktad terapi 5 (1): 1–37.
Som ett co-substrat som är viktigt för olika grundläggande makromolekyler kan NAD+ klyvas av NAD+-konsumerande enzymer. Dessa inkluderar PARP, sirtuins, CD38 och SARM1 för att generera NAM och ADP-ribose (se bild). Under normala homeostatiska förhållanden uttrycks CD38 i låga nivåer, medan ökande uttryck av CD38 med åldrandet spelar en viktig roll i åldersassocierad NAD+ -minskning. Denna uppfattning bekräftas av observationen att PARP1- och CD38-hämning effektivt ökar den totala NAD + -tillgängligheten, vilket leder till SIRT1-aktivering.
En minskning av NAD+-nivåerna, baserat på ny vetenskap, är förknippad med åldrande. Det är vanligt att NAD+-nivåerna sjunker till mindre än hälften efter 60 års ålder jämfört med nivåerna i tjugoårsåldern. Den stora frågan är varför NAD+-nivåerna över huvud taget sjunker. Det har funnits ett par teorier om detta, men den senaste och mest stödda teorin är att NAD+ -nivåerna sjunker med åldern eftersom det förstörs av överaktiviteten hos ett NAD-konsumerande enzym CD38. Låg NAD+-status är också känd för att hämma kroppens immunförsvar och naturliga försvarsmekanismer.
CD38, även känt som cykliskt ADP-riboshydrolas, är ett glykoprotein som finns på ytan av många immunceller (i synnerhet vita blodkroppar), inklusive B-lymfocyter, naturliga mördarceller, CD4⁺ och CD8. Vanligtvis resulterar mer inflammation i högre CD38-uttryck, vilket sedan tömmer NAD+. Därför är det viktigt att är kontroll av låggradig inflammation och inflammation i allmänhet det bästa sättet att minimera NAD+ -förlust på grund av åldrande.
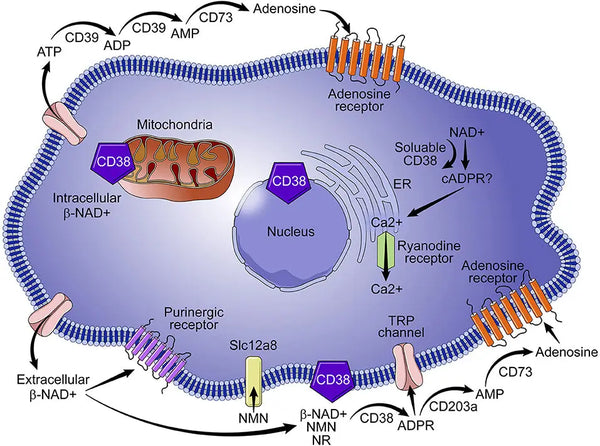
Bild: CD38:s roll i metabolismen av NAD+.
Källa: Hogan, K. & Chini, C. & Chini, E. (2019). Det mångfacetterade ecto-enzymet CD38: roller i immunmodulering, cancer, åldrande och metaboliska sjukdomar. Gränser inom immunologi 10: 1187.
NAD+ lindrar oxidativ skada orsakad av virus- och bakterieinfektioner
Virusinfektioner och infektioner i allmänhet orsakar oxidativ stress i värdceller (t.ex. mänskliga celler). Oxidativ stress anses därför vara en patogen faktor vid virusinfektioner. Den ökade mängden reaktiva syreföreningar i cellerna vid virusinfektioner orsakar t.ex. DNA-skador, genmutationer, celldöd, integration av viralt DNA och tumörbildning. För att reparera de DNA-skador som orsakas av oxidativ stress behövs en stor mängd NAD+, som förbrukas av förhöjda PARPs som svar på virusinfektionen.
Sirtuiner är en annan klass av NAD+ -konsumerande enzymer, som har breda antivirala egenskaper på olika virus (inklusive HIV-1, HCMB, H1N1 och HCV). CD38 är det tredje NAD+-konsumerande enzymet som överuttrycks som svar på flera virusinfektioner. Brist på CD38 resulterar i en ökad predisposition för flera patogener.
Bakterieinfektioner ger också upphov till snabb produktion av intracellulära reaktiva syreföreningar (ROS) antingen av NADPH-oxidas (NOX) eller mitokondrier, som är nödvändiga för att makrofager ska kunna rensa ut bakterier. NAD+/NADH utövar den bakteriedödande aktiviteten genom att främja ROS-generering, det proinflammatoriska svaret och den infektionshämmande autofagin. Denna fördelaktiga och naturliga metaboliska process behöver en välfungerande NAD+-metabolism och optimala nivåer av NAD+ för att fungera korrekt. Eliminering av ROS resulterar i defekt bakteriedödande (bakteriedödande) aktivitet, vilket gör att bakterier kan överleva och upprepade gånger kolonisera olika vävnadsplatser.
Detta är anledningen till att det inte är bra för immunförsvaret att använda för många antioxidanter hela tiden. Nyckeln till en optimal homeostas är att ha en balans mellan oxidativ stress och antioxidantkapacitet.
Nya bevis stöder hypotesen att den CD38 och produkter som kontrolleras av CD38 / NAD + -axeln kan spela betydande roller i patogenesen av SARS-CoV-2-infektion. Överuttryck av CD38 i COVID-19 orsakar celldöd främst genom utarmning av NAD+. Oral administrering av NAD+-prekursorer (NR, NAM och NMN) verkar vara den mest effektiva metoden för att fylla på NAD+-nivåerna (se senare). Av dessa NAD+-prekursorer har NR (som tillskott 1 gram per dag) antiinflammatoriska effekter vid olika sjukdomstillstånd. Nuvarande vetenskapliga bevis verkar bekräfta att viktiga händelser i biosyntesen och konsumtionen av NAD+ spelar viktiga roller i det antivirala immunsvaret. Öka NAD + -nivåerna genom att modulera de biosyntetiska vägarna eller genom att minska NAD + -förbrukningen kan hjälpa kontrollera det hyperimmuna svaret på SARS-CoV-2-infektion.
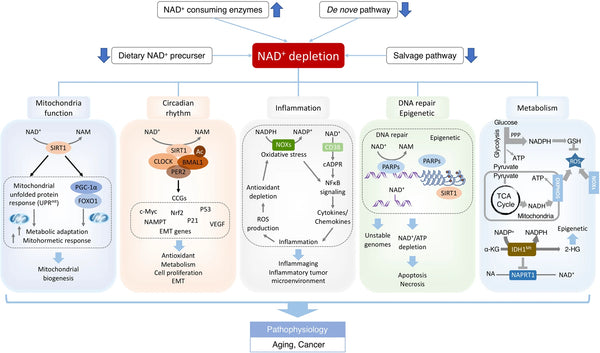
Bild: NAD+-underskott vid åldersassocierad dysfunktion och cancer.
Källa: NAD: Xie, N. et al (2020). NAD + -metabolism: patofysiologiska mekanismer och terapeutisk potential. Signaltransduktion och målinriktad terapi 5 (1): 1–37.
Livsstilsfaktorer som minskar NAD+-nivåerna:
- Dygnsrytm som inte stämmer överens
- Kronisk inflammation och oxidativ stress
- Konstant kaloriöverskott (äter för mycket hela tiden) - högre NADH, lägre NAD+
- Förhöjda blodsocker- och insulinnivåer
- Kronisk alkoholkonsumtion
Möjliga konsekvenser av NAD+ -brist:
- Nedsatt funktion av immunsystemet
- Påskyndat åldrande
- Dysfunktion i mitokondrierna
- Störda dygnsklockor (med åldrande)
- Ökad carcinogenes och risk för cancer
- Ökad risk för insulinresistens och utveckling av diabetes
- Ökad risk för fetma
- Ökad risk för alkoholfri fettleversjukdom
- Ökad risk för neurodegenerativa sjukdomar
- Ökad risk för hjärt- och njursvikt
Bästa sätten att öka NAD+-nivåerna i kroppen:
I allmänhet upprätthålls intracellulära NAD + -nivåer mellan 0,2 och 0,5 mM, beroende på celltyp eller vävnad. Koncentrationen och fördelningen av NAD+ kan dock fluktuera som svar på olika fysiologiska stimuli och cellulära påfrestningar.
- Tillämpa regelbunden (intermittent) fasta och kalorirestriktion (läs mer här)
- Aktivera ketogenesen i kroppen och ha regelbundna perioder med glukosrestriktion
- Träna regelbundet
- Öva värmeväxling (läs mer här)
- Bästa livsmedelskällor för NAD+-prekursorer inkluderar:
- Råa och fermenterade mejeriprodukter (hög halt av NR)
- Fet fisk som lax, sardiner, öring och makrill (högt innehåll av niacin)
- Ren-, nöt- och kycklinglever (högt innehåll av niacin)
- Fläsk och kalkon (högt innehåll av tryptofan och niacin)
- Nötkött (högt innehåll av niacin)
- Komplettera med NAD+-prekursorer
- Nikotinamidribosid (NR): optimal dos 300 mg per dag
- Nikotinamidmononukleotid (NMN): optimal dos 250-500 mg per dag
- Liposomal dos är ungefär 10 gånger mindre
- Använd med trimetylglycin (TMG) för optimal metyleringsprocess
- Niacinamid (NAM): optimal dos 250-500 mg per dag
- Nikotinsyra (NA): optimal dos 250-500 mg per dag
Det finns inga långsiktiga data om säkerheten vid kontinuerligt tillskott av NAD+-prekursorer, i synnerhet NR och NMN. För höga NAD+-nivåer kan också orsaka störningar i homeostasen mellan NAD+ och NADH. Dessa inkluderar missanpassningar av dygnsrytmen och baserat på studier på möss, störningar i sömncykeln samt förändrade hunger- och aptitmönster. Baserat på detta kan det vara idealiskt att ta NAD + -prekursorer på morgonen.
Rekommenderade kosttillskott:
Fysiologiska fördelar med att ha hög NAD+ i kroppen:
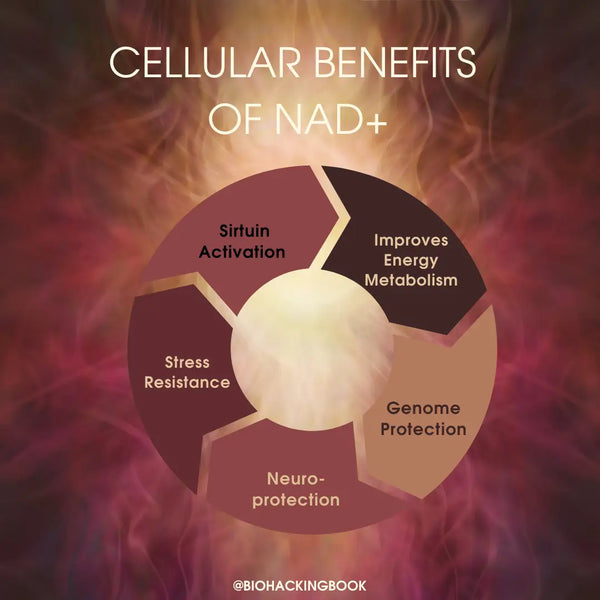
- Optimal mitokondriell funktion
- Avgörande biokemiskt element i energiproduktion och muskelfunktion
- Optimal hjärnfunktion och förebyggande av neurodegeneration
- Optimal sömn- och vakenhetscykel och upprätthållande av naturliga dygnsrytmer
- Skydd mot oxidativ stress och inflammation
- Cellulär överlevnad och syreproduktion
- Långsammare åldrande och längre livslängd och hälsospannvidd via mitofagi och DNA-reparation (baserat på studier på möss)
- Minskad risk för hjärtsjukdom via reversering av åldersrelaterad arteriell dysfunktion och förbättrad allmän hjärthälsa (baserat på studier på möss)
- Minskat åldrande av huden
///






