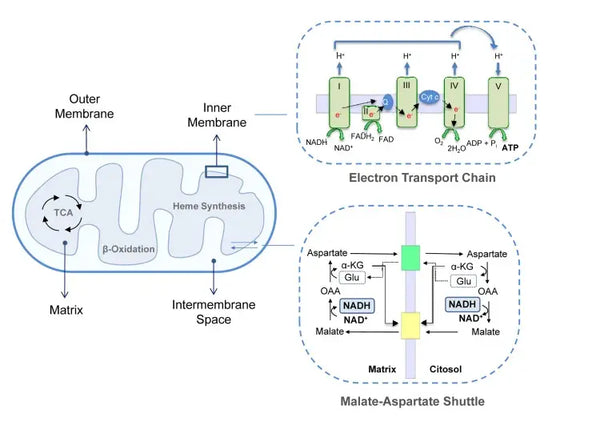
Mitokondrier är livsviktiga organeller som finns i cytoplasman i eukaryota celler. Med välfungerande mitokondrier fungerar alla processer i kroppen bättre, från rörelse och träning till matsmältning och återhämtning. De spelar en viktig roll i energiproduktionen och många andra cellulära processer. Mitokondrierna är platsen för den oxidativa fosforyleringen, som producerar ATP, cellens primära energikälla. Strukturellt kan mitokondrierna delas in i ett yttre membran och ett mycket veckat inre membran som bildar de utrymmen som är nödvändiga för deras metabolism. Vid sidan av energiproduktionen utför mitokondrierna andra aktiviteter som kalciumsignalering och reglering av cellulär metabolism samt apoptos (programmerad död), vilket gör dem viktiga för upprätthållandet av cellulär homeostas.
Grunderna i mitokondriell funktion
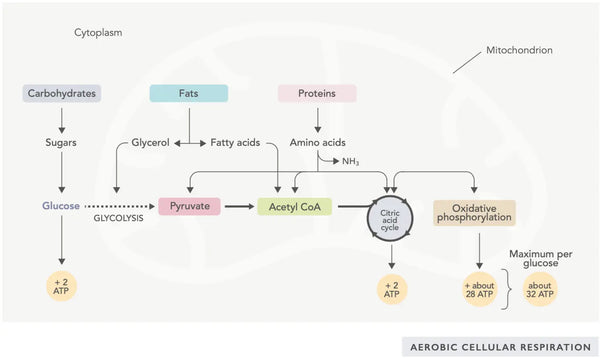
ATP-generering (den primära energimolekylen som används av celler) är den grundläggande funktionen i mitokondriell aktivitet. Denna process sker via två huvudsakliga biokemiska vägar: citronsyracykeln (TCA-cykeln eller Krebs cykel) och elektrontransportkedjan (ETC).
Citronsyracykeln
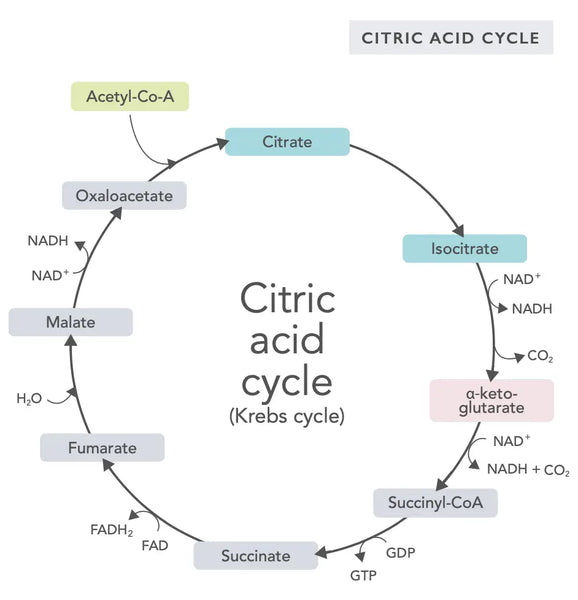
Citronsyracykeln, eller Krebscykeln (uppkallad efter nobelpristagaren Hans Adolf Krebs som upptäckte den), sker i cellens mitokondrier.(1)Den primära metaboliska föreningen i citronsyracykeln är ättiksyra (acetylkoenzym A) som produceras från fettsyror, kolhydrater och proteiner.(2)
De olika reaktionerna i citronsyracykeln (se bild) bildar vätejoner och elektroner som sedan överförs till mitokondriens inre membran för oxidativ fosforylering (bindning av energi till ATP-molekyler genom oxidation) och elektrontransportkedjan. Reaktionen frigör NADH och små mängder ATP och koldioxid.
Citronsyracykeln består av tio steg som vart och ett påverkas av B-vitaminer, vissa mineraler som magnesium och järn samt leverns viktigaste antioxidant, glutation. Reaktionerna hämmas av tungmetaller som kvicksilver, arsenik och aluminium.
De energirika NADH-molekylerna fångar upp den mesta energin som genereras under citronsyracykeln. För varje acetylcoenzym A-molekyl genereras tre NADH-molekyler som sedan används som energi i följande reaktion (oxidativ fosforylering).
Regleringen av citronsyracykeln bestäms av tillgången på olika aminosyror och återkopplingshämning (om t.ex. för mycket NADH produceras hämmas flera enzymer i citronsyracykeln, vilket bromsar reaktionerna).
Oxaloacetat är en förening som uppfyller ett plötsligt behov av att producera energi (till exempel i hjärnan eller musklerna). Att ta ett oxaloacetattillskott kan vara användbart, och det kan till och med öka regenereringen av mitokondrier i hjärnan, minska tyst inflammation i kroppen och öka antalet nervceller.(3)
Enkelt uttryckt innehåller kroppen geniala system som omvandlar konsumerad mat till elektroner, som används som energi för olika behov.
Oxidativ fosforylering
Oxidativ fosforylering består av elektrontransportkedjan och ATP-syntas. Oxidativ fosforylering producerar mest energi som genereras under aeroba förhållanden (ATP). Den är en fortsättning på citronsyracykeln.
I elektrontransportkedjan släpps vätejoner (H+) ut i mitokondriens intermembranutrymme. Vätejonerna som frigörs från det intermembrana utrymmet rör sig tillbaka in i mitokondrien genom ATP-syntas. Med hjälp av den energi som frigörs i processen omvandlar ATP-syntas ADP, som använts för energi, till ATP igen.
Ubikinon (coenzym Q10) bidrar till elektrontransportkedjan. Det har använts i årtionden som ett kosttillskott. Låga nivåer av ubikinon i cellerna kan vara en predisponerande faktor för olika sjukdomar på grund av otillräcklig aerob energiproduktion i cellerna. Dessutom är användningen av kolesterolmediciner (statiner) en bidragande faktor till ubiquinonbrist.(4)
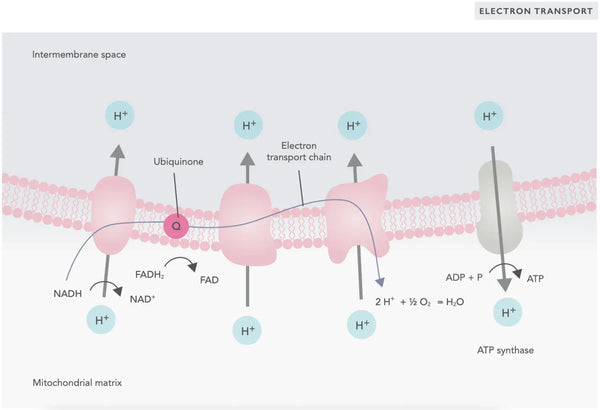
Denna samordnade uppsättning reaktioner genererar ATP och etablerar en protongradient över det inre mitokondriella membranet, en process som kallas kemiosmos. Den energi som lagras i denna gradient driver ATP-syntesen och kopplar elektronflödet genom ETC till genereringen av cellulär energi.(5)
Faktorer som påverkar mitokondriernas effektivitet
Mitokondriernas effektivitet, som uppenbarligen är avgörande för optimal cellulär funktion, påverkas av olika faktorer. Nedan beskrivs de viktigaste av dessa.
Genetisk sammansättning
Mitokondrierna har ett separat och individuellt DNA (mitokondriellt DNA, mtDNA) som skiljer sig från kärn-DNA. MtDNA kodar för viktiga komponenter i elektrontransportkedjan och mitokondriella proteiner. Mutationer i mtDNA kan leda till dysfunktionella proteiner, vilket stör elektrontransportkedjan och ATP-syntesen. Detta kan leda till minskad energiproduktion och ökad generering av reaktiva syreföreningar (ROS), vilket bidrar till mitokondriell och cellulär dysfunktion.(6)
Oxidativ stress
Mitokondrierna är en betydande källa till ROS, som är biprodukter från syremetabolismen. Medan låga nivåer av ROS fungerar i cellulär signalering, kan överdrivna ROS orsaka oxidativ skada på mitokondriella proteiner, lipider och DNA. Denna oxidativa stress äventyrar mitokondriernas integritet och funktion, vilket hämmar ATP-produktionen och leder till ytterligare ROS-produktion i en skadlig cykel. Antioxidantförsvar, inklusive superoxiddismutas och glutationperoxidas, spelar en avgörande roll för att mildra denna skada.(7-8)
Tillgänglighet av näringsämnen
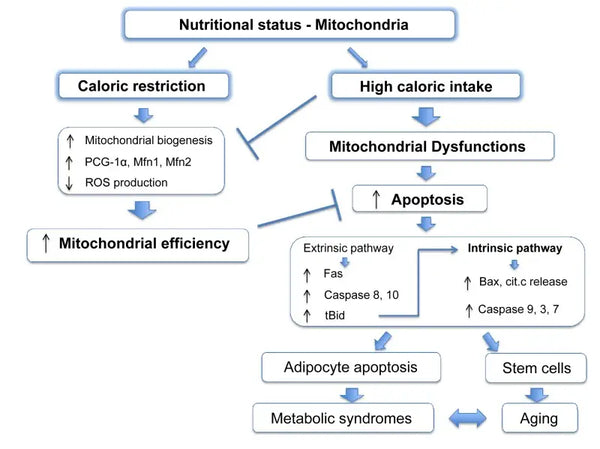
Mitokondrierna behöver specifika substrat för sin energiproduktion. Glukos och fettsyror är primära källor för ATP-generering via glykolys respektive β-oxidation. Tillgången på dessa substrat har en direkt inverkan på mitokondriernas funktion. Vid överskott av näringsämnen, till exempel hög glukostillgång, kan mitokondrierna producera stora mängder ATP och ROS, vilket kan leda till metaboliska störningar.(9-10)
Omvänt kan brist på näringsämnen begränsa mitokondriernas energiproduktion, vilket påverkar cellernas funktion och överlevnad. I motsats till vissa rapporter från djurstudier om fördelarna med kalorirestriktion för den mitokondriella biogenesen verkar det som om den inte ökar den mitokondriella biogenesen. Den bevarar dock mitokondriell funktion genom att skydda integriteten och funktionen hos befintliga cellulära komponenter.(11-12)
Livsstilsfaktorer
Motion och träning
Fysisk aktivitet påverkar mitokondriernas kvantitet och kvalitet. Träning stimulerar mitokondriell biogenes, vilket leder till en ökning av mitokondriell densitet och effektivitet i energiproduktionen.(13) Speciellt uthållighetsträning ökar mitokondriernas oxidativa kapacitet och förbättrar deras förmåga att använda syre för ATP-produktion (läs mer i detalj senare i artikeln).
Kost
Kostens komponenter påverkar mitokondriernas funktion avsevärt. Förhållandet mellan makronäringsämnen, kaloriintag och specifika näringsämnen (som antioxidanter, vitaminer och mineraler) påverkar mitokondriernas ämnesomsättning. En kost som är rik på näringsämnen som stöder mitokondriernas funktion kan öka energiproduktionen och minska den oxidativa stressen (se senare). Aktivering ketos kan också öka den mitokondriella biogenesen och förbättra den mitokondriella effektiviteten.(14-15)
Miljöfaktorer
Exponering för miljöstressorer, såsom toxiner, föroreningar, tungmetaller (t.ex. bly, kvicksilver, arsenik och kadmium) och strålning, kan påverka mitokondriernas funktion negativt. Dessa stressfaktorer kan orsaka oxidativ skada, störa aktiviteten i elektrontransportkedjan och försämra mitokondriernas dynamik, inklusive fusions- och fissionsprocesser.(16)
Teknologiska interventioner
Fotobiomodulering (eller terapi med rött ljus)
Fotobiomodulering är användningen av icke-joniserande fotonisk energi för att utlösa fotokemiska förändringar inom cellulära strukturer som är mottagliga för fotoner, särskilt i mitokondrier. Terapi med rött ljus och NIR-ljus antas huvudsakligen fungera genom fotoacceptorer. Vågor av rött ljus tränger igenom huden och når cellens mitokondrier, vilket ökar cellernas energiproduktion. Olika händelser leder till detta, till exempel accelerationen av den mitokondriella andningen via cytokrom c-oxidas.(17) Läs mer om hälsofördelarna med fotobiomodulering här.
Infraröd bastu
Infraröd bastu använder infraröd strålning, som värmer kroppsvävnader direkt istället för luft. Frekvensen för den strålning som avges av infraröda bastur är 3-12 μm, vilket faller under långt infrarött (FIR). Fjärran infrarött ljus har visat sig ha effekter på vävnadsnivå, särskilt på mitokondriernas andningskedja i cellernas energiproduktionsprocess och på vävnadernas blodförsörjning genom att vidga blodkärlen och förbättra cirkulationen.(18)
PEMF-terapi (pulsat elektromagnetiskt fält)
PEMF-terapi använder elektromagnetiska fält för att främja olika fysiologiska processer. Forskning tyder på att PEMF kan förbättra mitokondriernas funktion genom att öka syreförbrukningen i cellerna och förbättra produktionen av ATP. PEMF-terapi påverkar mitokondrierna direkt och återställer cellerna till ett hälsosammare energi- och elektriskt laddningstillstånd.(19-20) Läs den omfattande guiden om PEMF-terapi här.
Hyperbar syrgasbehandling (HBOT)
HBOT innebär att man andas rent syre i en trycksatt miljö. Hyperbar syrgasbehandling har kliniskt visat sig vitalisera mitokondrierna och öka ATP-bildningen genom att ge suprafysiologiska mängder syre som är nödvändiga för cellandning. En nyligen genomförd studie rapporterade att HBO ökade mitokondriernas biogenes och autofagi genom att delvis öka produktionen av reaktiva syreföreningar. Denna process producerade nya friska mitokondrier och gamla dysfunktionella mitokondrier förstördes. Studien visade också på ökad aktivering av mitokondriernas DNA-transkription och -replikation.(21-22) Läs mer om HBOT här.
Näringsmässigt och kompletterande stöd för mitokondriell funktion
Näringens roll för att upprätthålla mitokondriell hälsa är avgörande, med vissa näringsämnen som är särskilt avgörande för optimal mitokondriell funktion. Dessa inkluderar följande listade nedan.
- Coenzym Q10 (CoQ10): Ubikinon är fettlösligt och liknar ett vitamin. Ubikinon fungerar som en elektronbärare i elektronöverföringskedjan i mitokondrierna (se bilden till höger) och främjar utsöndringen av ATP. Ubikinonnivåerna minskar i olika vävnader med stigande ålder.(23)
- Magnesium: Involverat i ATP-syntesen och avgörande för att upprätthålla mitokondriernas integritet och funktion.(24)
- B-vitaminer: Inklusive B1 (tiamin), B2 (riboflavin), B3 (niacin), B5 (pantotensyra), B6, B7 (biotin) och B12. Dessa B-vitaminer är avgörande för olika aspekter av mitokondriell energimetabolism.(25)
- Alfa-liponsyra: ALA är en kraftfull antioxidant som också hjälper till att regenerera andra antioxidanter. Den har en roll i energimetabolismen och kan förbättra mitokondriernas funktion.(26)
- Karnitin (särskilt acetyl-L-karnitin): Transporterar fettsyror in i mitokondrierna för beta-oxidation, vilket är avgörande för energiproduktionen, särskilt i muskelceller.(27)
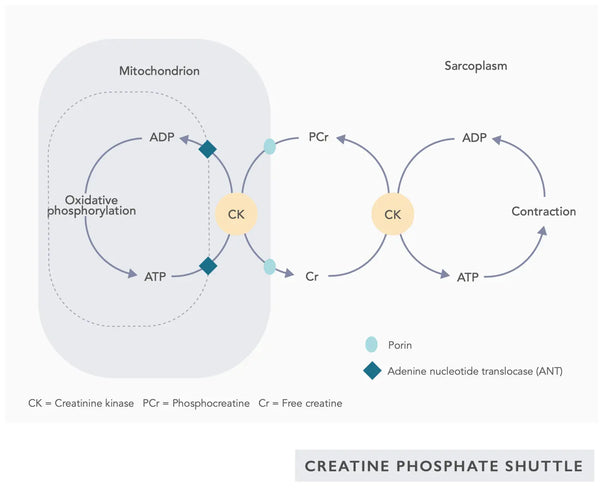
- Kreatin: Kreatin är en naturligt förekommande förening i kroppen som hjälper till att leverera energi till celler, särskilt muskelceller, genom att öka bildandet av adenosintrifosfat (ATP). Kreatintillskott kan förbättra mitokondriell effektivitet, särskilt vid högintensiv träning.(28)
- Pyrrolokinolinkinon (PQQ): PQQ är en antioxidant som ökar den mitokondriella biogenesen via PGC-1-proteininnehållet och stöder mitokondriell funktion.(29)
- Omega-3-fettsyror (EPA och DHA): Omega-3-fettsyror är viktiga för att upprätthålla mitokondriemembranets fluiditet och funktion. Dessa finns främst i fiskolja och fet fisk.(30)
- Nikotinamidribosid (NR) och Nikotinamidmononukleotid (NMN): Dessa NAD+-prekursorer är viktiga för mitokondriell funktion och energiproduktion. Komplettering med NR eller NMN kan bidra till att höja NAD + -nivåerna och därmed förbättra mitokondriell effektivitet.(31) Läs mer om optimering av NAD+ här.
- Kurkumin: Curcumin är den aktiva substansen i gurkmeja. Den har visat sig skydda mitokondrierna från oxidativ skada och förbättra deras funktion.(32)
- Selen: Selen: Ett essentiellt spårämne som spelar en roll för att skydda mitokondrierna från oxidativ stress. Selen uppreglerar också den mitokondriella biogenesen.(33)
Träning och mitokondriell biogenes
Regelbunden fysisk aktivitet är en viktig faktor för att främja den mitokondriella biogenesen, som leder till att nya mitokondrier bildas och därmed ökar antalet mitokondrier och deras funktionella kapacitet i cellerna. Olika former av träning har olika effekter på mitokondriernas dynamik. De två viktigaste träningsformerna är aerob träning och motståndsträning.
Aerob träning
Mitokondrietätheten i skelettmuskelcellerna ökar märkbart under aerob träning (t.ex. löpning, cykling och simning).
Den mitokondriella biogenesen regleras av PGC-1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha), ett essentiellt reglerprotein, vars uttryck aerob träning stimulerar. PGC-1α samaktiverar nukleära andningsfaktorer (NRF) och mitokondriell transkriptionsfaktor A (TFAM), vilka är nödvändiga för att transkribera mtDNA och replikera mitokondrier. Detta leder till ökad effektivitet i den oxidativa fosforyleringen, bättre uthållighet och större ATP-generering i muskelcellerna.(34)
Högintensiv intervallträning (HIIT) är särskilt effektiv för att öka antalet mitokondrier och den maximala syreupptagningsförmågan (VO2max).(35-36)
Motståndsträning
Mitokondriernas funktion och effektivitet är de primära målen för motståndsträning (t.ex. tyngdlyftning och kroppsviktsövningar). Den utlöser förändringar i den mitokondriella proteinsyntesen, vilket förbättrar den nuvarande mitokondriens kvalitet och effektivitet. Styrketräning ökar också produktionen av enzymer i elektrontransportkedjorna och Krebs cykel, vilket ytterligare förbättrar cellens kapacitet för ATP-syntes. Det kan också öka antalet och storleken på mitokondrierna i muskelcellerna, men inte i samma utsträckning som aerob träning.(37-38)
Den kombinerade effekten av dessa träningsformer på mitokondriernas biogenes och funktion understryker vikten av fysisk aktivitet för att bibehålla och förbättra mitokondriernas hälsa. Regelbunden aerobisk träning och styrketräning förbättrar cellernas mitokondriella densitet, effektivitet och energimetabolism på ett heltäckande sätt. Dessa anpassningar är avgörande för idrottsprestationer och är viktiga för att bibehålla hälsan, förebygga sjukdomar och hantera tillstånd som förknippas med mitokondriell dysfunktion.
Man bör dock notera att samtidig träning av både styrka och uthållighet leder till mindre anpassning, eftersom proteinkinaserna PKB och AMPK blockerar varandras nedströmssignalering, vilket hindrar den samtidiga träningseffekten.(39)
Mitofagi och cellulär hälsa
Mitofagi avser en selektiv typ av autofagi som spelar en viktig roll i cellulära förhållanden genom att endast kunna bryta ner de skadade eller icke-fungerande mitokondrierna. Denna mekanism är avgörande för mitokondriernas och cellens hälsa, eftersom den förhindrar att mRNA som kodar för defekt subenhetsmontering ansamlas och därmed förhindrar ytterligare kriser i cellfunktionerna och många sjukdomar.(40)
Eliminering av skadade mitokondrier genom mitofagi bidrar till att minska oxidativ stress, apoptos och inflammation (som är förknippade med olika sjukdomar). Försämrad mitofagi underlättar ackumuleringen av dysfunktionella mitokondrier i patogenesen för neurodegenerationssjukdomar som Parkinsons och Alzheimers sjukdom. Vid metaboliska sjukdomar leder förlust av mitofagi till förändringar i mitokondriernas ämnesomsättning, vilket leder till insulinresistens och typ 2-diabetes.(41-42)
Det har visat sig att kalorirestriktion främjar mitofagi. Detta beror delvis på aktiveringen av sirtuiner (SIRT1), AMP-aktiverat proteinkinas (AMPK) och transkriptionsfaktorn EB som stöder både cellulär energikrisrespons och initiering av mitofagi. Specifikt reglerar sirtuiner funktionen hos faktorer i mitofagimaskineriet och tystar ner skadade mitokondrier.(43)
De molekylära effekterna av kalorirestriktion efterliknas av föreningar som resveratrol (en polyfenol i rött vin och vissa bär) och många andra polyfenoler. Resveratrol främjar SIRT1 och AMPK-aktivering, vilket ökar mitofagi som ansvarar för förbättring av mitokondriernas funktion och återställande av cellhälsan.(44-45)
Mitofagi kan förbättras med intermittent fasta. Denna förbättring mildras förmodligen av den metaboliska växlingen från glukosbaserad till ketonbaserad energi under fasta och detta skifte utlöser mitofagi.46-47)
Mitokondriell dysfunktion som ett kännetecken för åldrande
Att förstå hur mitokondrierna bidrar till åldrandeprocessen är centralt inom gerontologisk och cellbiologisk forskning. När organismer åldras blir mitokondriell dysfunktion allt vanligare, vilket spelar en roll för den fysiologiska sidan av åldrandet.
De åldrande mitokondrierna uppvisar en minskad produktion av ATP, vilket påverkar de energidrivna processer som är nödvändiga för cellens välbefinnande. De strukturella förändringar i mitokondrierna som är förknippade med ålder påverkar dessutom denna minskning av energiproduktionen ännu mer, till exempel onormal sammansättning av mitokondriell membranpotential och integritet i den inre mitokondrieväggen.(48)
Positionen för mitokondriellt DNA (mtDNA) nära elektrontransportkedjan där reaktiva syreföreningar uppstår påverkar dess sårbarhet för mutationer. Mutationerna byggs dock upp med tiden, vilket leder till mitokondriell dysfunktion. Till skillnad från kärn-DNA, som är bundet till histoner för skydd och har en mängd olika reparationsmekanismer tillgängliga, saknar mtDNA skyddande hölje av histoner och har inte ett brett utbud av reparationsmetoder, så det kan lätt skadas.(49)
I cellerna producerar mitokondrierna reaktiva syreföreningar (ROS). Även om ROS är ett viktigt sätt för cellen att kommunicera med och anpassa sig till sin omgivning, begränsas produktionen av höga nivåer av dessa molekyler av en strikt kontroll. En överdriven produktion vid olika åldersrelaterade tillstånd leder till att cellerna drabbas av oxidativ stress. Den förstör olika cellulära komponenter, oavsett om det är proteiner, lipider eller DNA. Mitokondrierna är till och med den främsta mottagaren av oxidativ skada, vilket skapar en ond cirkel eftersom skadade mitokondrier bara genererar mer ROS och därmed ökar den cellulära cellulär senescens.(50-52)
Mitokondriell dynamik är avgörande för mitokondriernas funktion och bidrar till att upprätthålla fusions- och fissionsprocessen. Denna dynamik störs dock av åldrandet och mitokondrierna genomgår fragmentering istället för fusion. Dessa förändringar påverkar mitokondriernas funktion och deras position i cellerna.(53)
Förlusten av mitokondriell funktion är inte ett passivt åldersrelaterat fenomen utan en aktiv del i patogenesen för åldersberoende sjukdomar. Mitokondriell dysfunktion har förknippats med tillstånd som neurodegenerativa sjukdomar, hjärt-kärlsjukdomar och metaboliska störningar. Vid dessa sjukdomar är minskad eller felaktig energiproduktion, ökad oxidativ stress och oförmåga att rensa bort skadade mitokondrier avgörande för sjukdomens uppkomst och förlopp.(54)
Slutsats
Att optimera mitokondriernas hälsa och dess försämring med stigande ålder är en utmanande uppgift, men lyckligtvis finns det mycket vi kan göra åt det. De viktigaste åtgärderna är näringstillförsel av kritiska substrat för regenerering, inklusive coenzym Q10, magnesium och B-vitaminer, regelbundet deltagande i olika träningsformer för att öka den mitokondriella biogenesen och livsstilsförändringar som kalorirestriktion eller intermittent fasta för att påverka mitofagimekanismerna.
Eftersom mitokondriell dysfunktion är en av de faktorer som påverkar åldrandet är dessa strategier viktiga för att stödja cellhälsan och bekämpa åldersrelaterad nedbrytning. Integrativa metoder som utnyttjar kraften i vetenskapligt baserad kunskap i kombination med tillämpliga livsstilsförändringar kan skapa gynnsamma förutsättningar för att förebygga och bromsa mitokondriellt slitage, vilket sammantaget gynnar individens välbefinnande och livslängd.
Vetenskapliga referenser
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900-81), pionjär inom modern medicin, arkitekt för intermediär metabolism. Journal of Medical Biography 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biokemi. 5:e upplagan. Kapitel 17, Citronsyrans cykel. New York, New York: W. H. Freeman.
- Wilkins, H. et al (2014). Oxaloacetat aktiverar hjärnans mitokondriella biogenes, förbättrar insulinvägen, minskar inflammation och stimulerar neurogenes. Human molekylär genetik 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Primär och sekundär coenzym Q10-brist: rollen som terapeutiskt tillskott. Recensioner av näring 71 (3): 180–188. Granskning.
- Saraste, M. (1999). Oxidativ fosforylering vid fin de siecle. Vetenskap 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Mänskliga mitokondriella tRNA: biogenes, funktion, strukturella aspekter och sjukdomar. Årlig genomgång av genetik 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Är mitokondrierna den viktigaste bidragsgivaren till reaktiva syreföreningar i celler? Tidskrift för experimentell biologi 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Reaktiva syrearter i cellsignalering. American Journal of Physiology-Lung Cellular and Molecular Physiology 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Mekanismer för bioenergiproduktion i mitokondrier. Mitokondrierna och deras roll vid hjärt- och kärlsjukdomar 99–121.
- Bottje, W. (2019). Oxidativ metabolism och effektivitet: mitokondriernas delikata balansakt. Vetenskap om fjäderfä 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Tillgång till näringsämnen kopplar samman mitokondrier, apoptos och fetma. Åldrande (Albany NY) 4 (11): 734–741.
- Lanza, I. et al (2012). Kronisk kalorirestriktion bevarar mitokondriell funktion i senescens utan att öka mitokondriell biogenes. Cellmetabolism 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Molekylära mekanismer för mitokondriell anpassning till träning i skelettmuskulatur. FASEB-tidskriften 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Reglering av mitokondriell biogenes. Essäer i biokemi 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Ketonbaserad metabolisk terapi: är ökad NAD+ en primär mekanism? Gränser inom molekylär neurovetenskap 10: 377.
- Fowler, B. (1978). Allmänna subcellulära effekter av bly, kvicksilver, kadmium och arsenik. Perspektiv på miljö och hälsa 22:37-41.
- Hamblin, M. (2018). Mekanismer och mitokondriell redoxsignalering vid fotobiomodulering. Fotokemi och fotobiologi 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Fjärran infraröd strålning (FIR): dess biologiska effekter och medicinska tillämpningar. Fotonik och lasrar inom medicin 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). Elektromagnetisk stimulering ökar mitokondriefunktionen i osteogena celler och främjar reparation av benfrakturer. Vetenskapliga rapporter 11 (1): 19114.
- Tai, Y. et al (2020). Magnetiska fält modulerar metabolism och tarmmikrobiom i korrelation medPgc-1 alfa-uttryck: Uppföljning av en magnetisk mitohormetisk studie in vitro. FASEB-tidskriften 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). Effekten av hyperbariskt syre på mitokondriell och glykolytisk energimetabolism: kaloristaskonceptet. Cellstress och chaperoner 25 (4): 667-677.
- Chen, W. et al (2020). Hyperbariskt syre skyddar mot myokardiell ischemi-reperfusionsskada genom att hämma mitokondriens dysfunktion och autofagi. Rapporter om molekylär medicin 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). Komplexiteten i att tillverka ubiquinon. Trender inom endokrinologi och metabolism 30 (12): 929-943.
- Volpe, S. (2013). Magnesium i förebyggande av sjukdomar och allmän hälsa. Framsteg inom näringslära 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O'Brien, P. (2006). Mitokondriell funktion och toxicitet: B-vitaminfamiljens roll för mitokondriell energimetabolism. Kemisk-biologiska interaktioner 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Liposyrametabolism och mitokondriell redoxreglering. Journal of Biological Chemistry 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Karnitin i bioenergetik hos mänskliga muskler: kan karnitintillskott förbättra fysisk träning? molekyler 25 (1): 182.
- Wax, B. et al. (2021). Kreatin för träning och sportprestanda, med återhämtningsöverväganden för friska populationer. Näringsämnen 13 (6): 1915.
- Hwang, P. et al (2020). Effekter av tillskott av pyrrolokinolinkinon (PQQ) på aerob träningsprestanda och index för mitokondriell biogenes hos otränade män. Journal of the American College of Nutrition 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Påverkan av mitokondriell membransammansättning och bioenergetik genom omega-3-tillskott. Tidskriften för fysiologi 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). Nikotinamidribosid ökar den åldrade mänskliga skelettmuskeln NAD + metabolom och inducerar transkriptomiska och antiinflammatoriska signaturer. Cellrapporter 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Curcumin, mitokondriell biogenes och mitofagi: Utforska nya data och indikera framtida behov. Bioteknikens framsteg 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Selen, ett mikronäringsämne som modulerar kardiovaskulär hälsa via redoxenzymologi. Näringsämnen 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Reglering av PGC-1α, en nodal regulator för mitokondriell biogenes. Den amerikanska tidskriften för klinisk näring 93 (4): 884S-890S.
- Helgerud, J. et al (2007). Aeroba högintensiva intervaller förbättrar VO2max mer än måttlig träning. Medicin och vetenskap inom idrott och motion 39 (4): 665–671.
- Burgomaster, K. et al (2008). Liknande metaboliska anpassningar under träning efter sprintintervall med låg volym och traditionell uthållighetsträning hos människor. Tidskrift för fysiologi 586 (1): 151–160.
- Wilkinson, S. et al (2008). Differentiella effekter av motstånd och uthållighetsträning i matat tillstånd på signalmolekylfosforylering och proteinsyntes i mänskliga muskler. Tidskriften för fysiologi 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Motståndsträning förändrar mitokondriernas funktion i skelettmuskulaturen hos människor. Medicin och vetenskap inom idrott och motion 47 (9): 1922-1931.
- Baar, K. (2006). Träning för uthållighet och styrka: lärdomar från cellsignalering. Medicin och vetenskap inom idrott och motion 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Mitofagins vägar för kvalitetskontroll och rensning av mitokondrier. Celldöd och differentiering 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitokondrier och axeln autophagy-inflammation-celldöd i organismens åldrande. Vetenskap 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitofagi: Ett lovande terapeutiskt mål för neuroskydd under åldrande och åldersrelaterade sjukdomar. British Journal of Pharmacology 180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Kalorirestriktion: är AMPK en nyckelsensor och effektor? Fysiologi 26 (4): 214-224.
- Um, J. et al (2010). AMP-aktiverade proteinkinas-defekta möss är resistenta mot de metaboliska effekterna av resveratrol. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Antiaging-egenskaperna hos en druvbaserad antioxidant regleras av mitokondriell balans mellan fusion och fission, vilket leder till mitofagi som utlöses av ett signalnätverk bestående av Sirt1-Sirt3-Foxo3-PINK1-PARKIN. Oxidativ medicin och cellulär livslängd 2014: 345105.
- Longo, V. & Panda, S. (2016). Fasta, cirkadiska rytmer och tidsbegränsad utfodring i hälsosam livslängd. Cellmetabolism 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I & Sahebkar, A. (2020). Effekten av fasta eller kalorirestriktion på mitofagiinduktion: en litteraturöversikt. Journal of Cachexia, Sarcopenia och Muscle 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Oxidativ stress, mutation av mitokondriellt DNA och försämring av antioxidantenzymer vid åldrande. Experimentell biologi och medicine 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). mtDNA Mutations and Their Role in Aging, Diseases and Forensic Sciences. Åldrande och sjukdomar 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Mitokondriernas generering av reaktiva syreföreningar. Antioxidanter 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Reaktiva syreföreningar och mitokondrier: En nexus av cellulär homeostas. Redoxbiologi 6: 472-485.
- Correia-Melo, C. et al (2016). Mitokondrier krävs för åldrande funktioner i den senescenta fenotypen. EMBO-tidskriften 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Mitokondriella fusions- och fissionsproteiner som nya terapeutiska mål för behandling av hjärt-kärlsjukdomar. European Journal of Pharmacology 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitofagi: en ny roll i åldrandet och åldersrelaterade sjukdomar. Gränser inom cell- och utvecklingsbiologi 8: 200.