Allt du behöver veta om åldrande och anti-aging processer. Hur kan man vända åldrandet? Vilka är de 9 kännetecknen för åldrande? Läs mer för att ta reda på det!
År 2013 publicerade Carlos López-Otín och hans kollegor en banbrytande artikel där de försökte identifiera och kategorisera de cellulära och molekylära kännetecknen för åldrande. De föreslog nio kandidatkännetecken som allmänt anses bidra till åldrandeprocessen och som tillsammans bestämmer den åldrande fenotypen. López-Otín et al. definierade att ett kännetecken helst ska uppfylla följande tre kriterier: det ska visa sig under normalt åldrande, dess experimentella förvärring ska påskynda åldrandet och dess experimentella förbättring ska fördröja den normala åldringsprocessen och därmed öka den friska livslängden.
De ursprungliga nio kännetecknen på åldrande
Nyckeln till att bromsa eller till och med vända åldrandet är inte baserad på idén om att bara öka livslängden, utan hälsospännvidd (den period av livet som tillbringas vid god hälsa, fri från kroniska sjukdomar och funktionsnedsättningar som åldrandet medför). Sjukligheten har hittills inte minskat så mycket eftersom vi har minskat dödligheten mer än vi har förebyggt sjukligheten. Hälsospännvidden (att ha friska levnadsår) kommer att öka när sjukligheten (tillståndet att lida av en sjukdom eller ett medicinskt tillstånd) minskar, mest effektivt genom att höja debutåldern.
Framgångsrikt och hälsosamt åldrande kan definieras på följande sätt:
- Låg sannolikhet för sjukdom eller funktionsnedsättning
- Hög kognitiv och fysisk funktionsförmåga
- Aktivt engagemang i livet
De föreslagna nio kännetecknen för åldrande är grupperade i tre kategorier:
- 1. Primära kännetecken (orsaker till skada)
- De utlösande faktorerna vars skadliga konsekvenser successivt ackumuleras med tiden. Alla otvetydigt negativa.
- 2. Antagonistiska kännetecken (svar på skada)
- Motsatta effekter till de primära kännetecknen. Vid låga nivåer förmedlar de gynnsamma effekter, men vid höga nivåer blir de skadliga (t.ex. senescens).
- 3. Integrativa kännetecken (fenotypens skyldiga)
- Slutresultatet av de två föregående grupperna av kännetecken och ackumulerad skada som inte kan kompenseras av vävnadens homeostatiska mekanismer. Dessa är i slutändan ansvariga för den funktionella försämringen i samband med åldrandet.
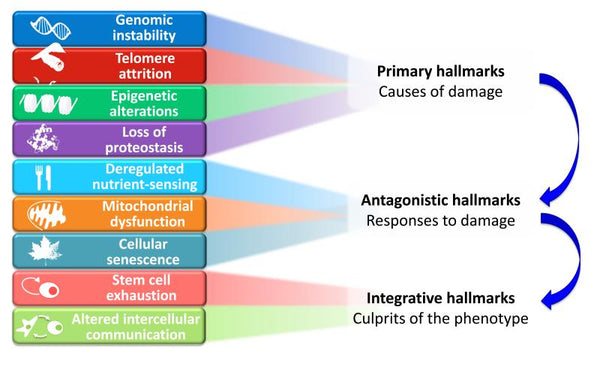
Bild: Funktionella kopplingar mellan åldrandets kännetecken.
källa: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Åldrandets kännetecken. Cell 153 (6): 1194–1217.
1. Genomisk instabilitet
DNA:s integritet och stabilitet utmanas kontinuerligt av externa fysikaliska, kemiska och biologiska ämnen, liksom av interna hot, som inkluderar DNA-replikationsfel, spontana hydrolytiska reaktioner och produktion av reaktiva syreföreningar. Dessa leder så småningom till till ackumulering av genetiska skador under hela livet.
Sätt att förbättra genomisk stabilitet (Hallmark #1):
- Antioxidativa mikronäringsämnen (selen, zink, vitamin C, vitamin E) -> begränsa DNA-skador
- Åtgärdar även små brister i folat, vitamin B12, niacin och zink ->. har en betydande inverkan på frekvensen av spontana kromosomskador
- Ganoderma lucidum (reishi) glukaner
- Polyfenoler -> rensar bort fria radikaler
- Måttlig och "självreglerad" träning
- Undvik följande:
- Strålning & kemisk exponering
- Exponering för tungmetaller
- Nickel, kadmium och arsenik, i synnerhet
- Cigarettrökning
- Sitter för länge
- Överdriven användning av alkohol, energidrycker och mjölk
2. Förlängning av telomerer
Telomerer är särskilt mottagliga för åldersrelaterad försämring. Förkortning av telomerer observeras under normalt åldrande både hos människor och hos möss. Telomererna är bundna av ett multiproteinkomplex som kallas shelterinsom hindrar DNA-reparationsproteiner från att komma åt telomererna (utan detta skulle telomererna "repareras" som DNA-frakturer, vilket skulle leda till kromosomfusioner). DNA-skador på telomerer är anmärkningsvärt konstanta och mycket effektiva när det gäller att inducera senescens.
Sätt att minska förkortning av telomerer (Kännetecken #2):
- Öka intaget av antioxidanter i kosten
- Högt intag av omega-3-fettsyror, i synnerhet
- Optimera vitamin D, vitamin B12 och folat nivåer i blodet
- Medelhavsdiet
- Undvik följande:
- Rökning
- fetma
- Exponering för gifter och föroreningar
- Balansera stressnivåer
- Balansera träningsrutiner och intensiva träningspass
- Meditation med kärleksfull vänlighet & mindfulness-meditation övning (och meditation i allmänhet)
- Hyperbarisk syrgasbehandling (HBOT)
- Örterna gynostemma, gotu kola och astragalus (möjligen effektiv)
- Vad som inte fungerar: långvarig kalorirestriktion
3. Epigenetiska förändringar
Många typer av epigenetiska förändringar påverkar alla celler och vävnader under hela livet (orsakas av t.ex. kost, kemikalier, läkemedel, solljus, värme/kyla, motion etc.). Epigenetiska förändringar förutsätter förändringar i DNA-metyleringsmönster, posttranslationell modifiering av histoner och ommodellering av kromatin.Medlemmar av sirtuin-familjen av NAD-beroende proteindeacetylaser och ADP-ribosyltransferaser har studerats ingående som potentiella anti-agingfaktorer - hos människor bidrar minst tre medlemmar av sirtuin-familjen, SIRT1, SIRT3 och SIRT6, till ett hälsosamt åldrande.
Sätt att hantera epigenetisk förändring (Hallmark #3):
- Optimera metyleringsvägar (folat, B12, B6, TMG)
- Aktivatorer för Sirtuin-vägar (SIRT1, SIRT3, SIRT6):
- Spermidin (hämmar histondeacetylaser)
- Intermittent kalorirestriktion och intermittent fasta
- Regelbunden (intensiv) träning
- Optimering av sömn (sömnförlust orsakar skadliga epigenetiska förändringar)
- Metformin (biverkningar är varningen); företrädesvis (dihydro)berberin
- Alfa-ketoglutarat (CaAKG)
- Få regelbundet hormetiska doser av värme, kyla, solljus etc. ("giftet ligger i dosen")
- Epigenetiska läkemedel under utveckling som riktar sig mot DNA-metyltransferas, histondeacetylas, histonmetyltransferas och kromatin
Rekommenderade kosttillskott:
Purovitalis liposomalt quercetin
Purovitalis Liposomal Resveratrol
4. Förlust av proteostas
Proteostas omfattar mekanismer för stabilisering av korrekt veckade proteiner (särskilt heat-shock-familjen av proteiner) och mekanismer för stabilisering av korrekt veckade proteiner (särskilt heat-shock-familjen av proteiner). nedbrytning av proteiner genom proteasomen eller lysosomen. Flera studier har visat att proteostasen förändras med åldrandet vilket leder till kroniska uttryck av oviktade, felveckade eller aggregerade proteiner. Dessa bidrar till utvecklingen av vissa åldersrelaterade degenerativa sjukdomar, såsom Alzheimers sjukdom.
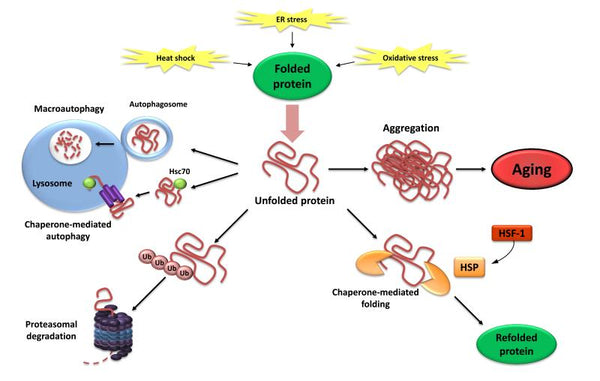
Bilden: Förlust av proteostas. Underlåtenhet att återvecka eller bryta ned oveckade proteiner kan leda till att de ackumuleras och aggregeras, vilket resulterar i proteotoxiska effekter.
Källa: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Åldrandets kännetecken. Cell 153 (6): 1194–1217.
Olika sätt att förbättra proteostasens stabilitet (kännetecken 4):
I allmänhet är det bästa sättet att skydda kroppen från förlust av proteostas genom att aktivera autofagi.
- Fasta, intermittent kalorirestriktion (långsiktig är inte användbar!), Ketos, motion (på ett fastat tillstånd det bästa), motståndsträning, förkylning & värmeexponering, djup sömn (och melatonin)
- Sulforafan, kaffe, curcumin, polyfenoler, EVOO, resveratrol, grönt te, spermidin
- Senolytiska näringsämnen och kosttillskott:
- Quercetin, fisetin, luteolin, curcumin, piperlongumine, molekylärt väte (H2) etc.
- AMPK-aktivatorer:
- Berberin (DHB ännu bättre), resveratrol (och pterostilben), hesperidin, ginsenosider, quercetin, curcumin, naringenin, gynostemma, crocin (i saffran), salvianolsyra B, alfa-liponsyra, etc.
- Metformin & rapamycin (Nb. possibla biverkningar)
- Hsp70 (heat-shock protein 70) inducerare:
- Bastu och exponering för värme
- Shikonin (från rötterna av shikoninväxten)
- Specifika senolytiska läkemedel (t.ex. dasatinib och navitoclax)
5. Avreglerad avkänning av näringsämnen
IGF-1- och insulinsignalering är känd som IIS-vägen, som är den mest bevarade åldrande-kontrollerande vägen i evolutionen. Förutom IIS-vägen som deltar i glukosavkänningen finns det ytterligare tre relaterade och sammankopplade system för näringsämnesavkänning: mTOR (känner av höga aminosyrakoncentrationer), AMPK (känner av lågenergitillstånd genom att upptäcka höga AMP-nivåer) och sirtuiner (känner av lågenergitillstånd genom att upptäcka höga NAD+-nivåer). Sammanfattningsvis finns det starka bevis för att anabolisk signalering (mTOR, hög insulinhalt) påskyndar åldrandet och att minskad näringssignalering (AMPK, låg insulinhalt) förlänger livslängden.
Sätt att hantera deregulerad näringssignalering (Hallmark #5):
I praktiken omfattas alla de tidigare sätten att hantera kännetecken 1-4 av att sensibilisera och omreglera näringsämnesavkänningen. Dessa inkluderar:
- kostrestriktioner
- AMPK-aktivering
- Sirtuin-aktivering
- hormesis
- minskning av oxidativ stress och inflammation
- öka autofagi
6. Mitokondriell dysfunktion
Det har visat sig att mitokondriell dysfunktion ökar åldrandet. När en organism åldras minskar effektiviteten i cellernas andningskedja, vilket leder till elektronläckage och minskad ATP-generering. Den minskade effektiviteten hos mitokondriell bioenergetik med åldrande kan bero på flera samverkande mekanismer, inklusive minskad biogenes av mitokondrier, ackumulering av mutationer och deletioner i mtDNA, oxidativ stress i mitokondriella proteiner, destabilisering av andningskedjan, förändringar i lipidsammansättningen i mitokondriella membran och förändringar i mitokondriell dynamik.
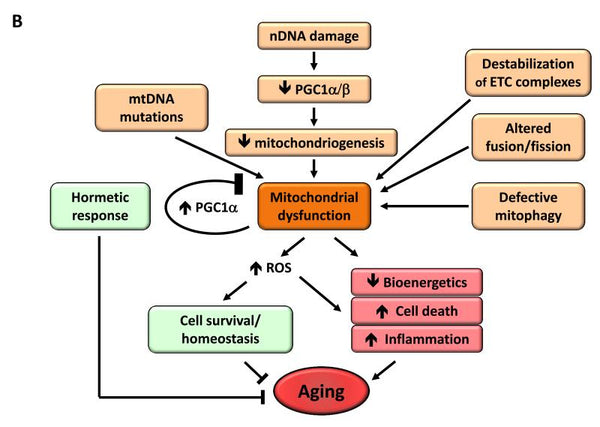
Bild: Mitokondriell dysfunktion och dess effekt på åldrandet.
Källan: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Kännetecken på åldrande. Cell 153 (6): 1194–1217.
Olika sätt att hantera mitokondriell dysfunktion (Kännetecken #6):
- Aktivera mitohormesis med:
- Intermittent kalorirestriktion
- Intermittent fasta
- Träning och motion
- Exponering för kyla
- Fytonäringsämnen (t.ex. flavonoider)
- Rikta in sig på Nrf2-vägen (homeostas & strukturell integritet) med:
- Exponering för värme och kyla
- Fysisk träning
- Intermittent fasta och ketos
- Sulforafan, polyfenoler, quercetin, curcumin m.m.
- Molekylärt väte (H2) -> Produktrekommendation
- Förbättra mitokondriell biogenes och reparation (aktivering av PGC-1α):
- Fysisk träning
- Ketos och ketonkroppar
- Acetyl-L-karnitin
- Polyfenoler, quercetin
- Rhodiola rosea (salidrosider)
- Koenzym Q10, pyrrolokinolinkinon (PQQ), nikotinamidmononukleotid (NMN), alfa-liponsyra (ALA)
7. Cellulär senescens
Eftersom antalet senescenta celler ökar med åldern har man antagit att senescens bidrar till åldrandet. Senescens behövs dock för att förhindra spridning och proliferation av skadade celler som utlöser en reaktion från immunförsvaret. Denna cellulära kontrollpunkt kräver ett effektivt cellutbytessystem som innefattar både rensning av senescenta celler och mobilisering av progenitorceller för att återställa ett optimalt cellantal. Senescenta celler uttrycker betydande förändringar i sin sekretom, som är särskilt berikad med proinflammatoriska cytokiner och matrixmetalloproteinaser. Den kallas därför "senescensassocierad sekretorisk fenotyp".
Sätt att bekämpa cellulär senescens (Hallmark #7):
Senescenta celler slutar så småningom att föröka sig, men dör inte när de borde, som vanliga celler gör. Istället stannar de kvar och fortsätter att frisätta kemikalier som kan utlösa inflammation och immunsvar.
Senolytiska föreningar som selektivt riktar sig mot senescenta celler inkluderar:
- Fisetin (även kallad "den ultimata senolytiska")
- Quercetin
- Theaflaviner
- Apigenin
- Tokotrienoler (form av vitamin E)
- Piperlongumine
- Molekylärt väte (H2)
8. Utmattning av stamceller
Vuxna stamceller kan förnya sig själva och differentieras till flera olika celltyper inom en vävnad. Även om fenotyper och mekanismer varierar mycket, minskar alla stamcellspopulationer i funktion med åldern. Stamcellsuttömning är den samlande konsekvensen av olika åldrandeassocierade skador och utgör sannolikt en av de yttersta orsakerna till cellulärt åldrande. Studier på åldrade möss har visat på en generell minskning av cellcykelaktiviteten hos hematopoietiska stamceller (HSC)vilket korrelerar med ackumulering av DNA-skador och överuttryck av cellcykelhämmande proteiner (t.ex. p16INK4a). Telomerförkortning har också visat sig vara en viktig orsak till att stamcellerna minskar i åldrandet.
Olika sätt att motverka stamcellsutmattning (Hallmark #8):
- Stamcellsbehandling (autolog vs allogen & olika celltyper)
- Stamcellsterapier är fortfarande ett "vilda västern" potentiella biverkningar och risker finns därsåsom tumörtillväxt och cancer.
- Fotobiomodulering ("terapi med rött ljus")
- PBM stimulerar olika typer av stamceller för att öka deras migration, proliferation och differentiering in vitro och in vivo.
- Återställa åldrade stamceller genom att rikta in sig på toxiska metaboliter:
- Aktivera sirtuiner - SIRT1 & SIRT 3 (se #3 & #4)
- N-acetylcystein (NAC)
- Förbättra proteostasens stabilitet (se #4
- Förbättra mitokondriell funktion (se #6)
- Använda senolytika (se #7)
- Återställa det epigenetiska minnet (se #3)
- Optimera D-vitaminnivåerna
- Spirulina (in vitro-studie)
9. Förändrad intercellulär kommunikation
Cellåldrandet sker också på nivån för intercellulär kommunikation. Dessa omfattar neurohormonell signalering (ökade inflammatoriska reaktioner), immunövervakning (patogener och premaligna celler) och förändringar i den extracellulära miljön. Åldrande på grund av inflammation kallas inflammaging. Det kan bero på flera orsaker, t.ex. ackumulering av proinflammatorisk vävnadsskada, ett dysfunktionellt immunförsvars misslyckande med att effektivt rensa bort patogener och dysfunktionella värdceller och förekomsten av ett bristfälligt autofagiskt svar. Förändringar i åldrandet i en vävnad kan leda till åldersspecifik försämring av den närliggande vävnaden: senescenta celler inducerar senescens i sina närliggande celler via gap-junction-medierade cell-cellkontakter och processer som involverar reaktiva syreföreningar. Detta fenomen kallas också för "sensecent cell bystander effect".
Sätt att förbättra intercellulär kommunikation (Hallmark #9):
- Lägre allmän inflammation i kroppen
- En övergripande antiinflammatorisk livsstil
- Använd molekylärt väte (H2)
- Flera anti-aging effekter i kroppen (inklusive minskning av inflammation)
- Lägre oxidativ stress i kroppen och minskning av reaktiva syreföreningar (ROS)
- Öka autofagi i kroppen (se tidigare)
- Behandla tarmdysbios och förbättra mångfalden och den allmänna hälsan hos tarmfloran
- Behandla eventuellt läckande tarmsyndrom
10. Styvhet i extracellulär matris (ECM)
Utöver dessa 2013 definierade nio kännetecken på åldrande finns det ett tionde kännetecken på gång. Två forskare, Alexander Fedintsev och Alexey Moskalev, har publicerat en artikel 2021 som tar en närmare titt på förstyvningen av den extracellulära matrisen (ECM): uppbyggnaden av tvärbindningar mellan långlivade molekyler som kollagen och elastin. De föreslår att ECM-förstyvningen orsakas av de icke-enzymatiska kemiska reaktionerna glykering, karbamylering och karbonylering och att den till och med kan vara den uppströms orsaken till flera accepterade kännetecken på åldrande, såsom cellulär senescens. Dessa förändringar leder till bildandet av addukter och tvärbindningar som i sin tur orsakar inflammation, fibros, försämrad dygnsrytm i vävnaderna, åldrande av stamceller och så vidare. Det har tidigare konstaterats att AGE (advanced glycation end products) har en patogen betydelse för olika vävnader och signalvägar i kroppen. Organismer med ovanligt lång livslängd (t.ex. grönlandsvalar) har en exceptionellt låg ackumulering av AGE.
Potentiella behandlingsmetoder för styvhet i extracellulär matris (ECM) (kännetecken nr 10):
I mänskliga skelettmuskler beror den åldersrelaterade funktionsnedsättningen på ökad styvhet i ECM, främst orsakad av kollagenackumulering.
- Manuell terapi och mekanistiskt tryck
- Osteopatisk terapi, akupunktur, myofascial release
- En kombination av syntetiska och naturliga AGE-hämmare arbetar synergistiskt i olika stadier av bildandet
- Naturliga produkter inkluderar karnosin, alfa-liponsyra, taurin, C-vitamin, benfotiamin och pyridoxamin ->. produktrekommendation
- Polyfenoler, terpenoider och polysackarider
- Minska också intaget av avancerade glykationsslutprodukter från livsmedel
- Stimulera elastogenesen (nya läkemedel?)
- RAGE-antagonister (receptor för avancerade glykeringsändprodukter) [olika peptider]
///








