Studiet av motståndskraft genom genetikens lins är ett växande intresseområde som ofta korsar disciplinerna psykologi, neurobiologi och genomik. Även om begreppet resiliens - förmågan att återhämta sig från eller anpassa sig till motgångar eller stress - är mångfacetterat och påverkas av ett komplext samspel mellan genetiska, miljömässiga och psykologiska faktorer, har specifika DNA-tester utvecklats för att belysa de genetiska komponenterna i denna egenskap.
Inledning
Gener är DNA-segment som innehåller de instruktioner som kroppen behöver för att tillverka vart och ett av de många tusen proteiner som krävs för liv. Varje gen består av tusentals kombinationer av "bokstäver" (som kallas baser) som utgör din genetiska kod. Koden ger instruktioner om hur man tillverkar de proteiner som krävs för korrekt utveckling och funktion.(1)
Genetiska variationer kan påverka uttrycket av en gen och därigenom påverka metaboliska processer som är viktiga för att upprätthålla cellulär hälsa och hur vi reagerar på miljöinterventioner som kost, livsstil, kosttillskott och medicinering.
Kunskap om dessa genetiska variationer ger en oöverträffad inblick i biologiska system, vilket gör det möjligt för hälso- och sjukvårdspersonal att rekommendera exakta åtgärder som syftar till att hjälpa en person att nå sina mål och uppnå optimal hälsa.
Förståelse av genetiska markörer för resiliens
Motståndskraft-förmågan att återhämta sig från eller enkelt anpassa sig till motgångar eller förändringar - ses allt oftare genom genetiken. Genom att undersöka genetiska markörer strävar forskare och läkare efter att avslöja de biologiska grunderna som kan förklara varför vissa individer återhämtar sig från stress och trauma mer effektivt än andra.(2) Detta spirande forskningsområde har fokuserat på resiliensrelaterade DNA-tester som undersöker genetiska markörer som kan vara ansvariga för skillnaderna i individuella stressreaktioner.
I centrum för denna forskning står de endokrina systemen och nervsystemen (i synnerhet det autonoma nervsystemet) som är centrala för kroppens reaktion på stress. Särskilt hypotalamus-hypofys-binjure-axeln (HPA-axeln) är ett centralt fokusområde eftersom den spelar en avgörande roll för att reglera kroppens stressresponsmekanism. Detta komplexa nätverk av interaktioner mellan hypotalamus, hypofysen och binjurarna styr produktionen och regleringen av viktiga stresshormoner, t.ex. kortisol.
Kortisol har långtgående effekter på många kroppsfunktioner och frisätts som svar på stress och låg blodglukoskoncentration. Under normala omständigheter hjälper kortisol till att återställa homeostasen efter stressande händelser. Genvariationer som påverkar HPA-axeln kan dock leda till skillnader i hur kortisol produceras, regleras och förs ut ur kroppen. Dessa genetiska variationer kan påverka en individs fysiologiska motståndskraft - förmågan att bibehålla eller snabbt återgå till psykisk och fysisk hälsa efter påfrestningar.(3)
DNA-test för resiliens undersöker genvarianter som är associerade med receptorerna för stresshormoner, proteiner som är involverade i stresshormonernas vägar och enzymer som metaboliserar dessa hormoner. Till exempel kan en variant av genen FKBP5, som är involverad i regleringen av känsligheten hos glukokortikoidreceptorn genom vilken kortisol utövar sina effekter, modifiera en individs stressrespons och potentiellt deras mottaglighet för stressrelaterade störningar. Generna som kodar för neurotransmittorer - hjärnans kemiska budbärare som bidrar till reglering av humör och kognition - är också i fokus. Det handlar bland annat om gener som COMT, som är avgörande för nedbrytningen av dopamin, en signalsubstans som är förknippad med njutning och belöningssystem.(4)
Dessutom, inflammation är en biologisk process som har ett nära samband med stress och humörstörningar. Kronisk inflammation, som kan påverkas av genetiska variationer, kan påverka hjärnans funktion och beteende.(5) Genetiska tester kan därför också syfta till att identifiera varianter i proinflammatoriska cytokingener, såsom IL-6 och TNF, som kan predisponera individer för långvariga inflammatoriska reaktioner och påverka deras mentala motståndskraft.
Förståelse för dessa genetiska markörer är hörnstenen för individanpassade interventioner. Genom att identifiera genetiska predispositioner kan individer vidta proaktiva åtgärder för att stärka sin motståndskraft genom livsstilsförändringar, psykologiska strategier och medicinska behandlingar som är skräddarsydda för deras unika genetiska sammansättning. Detta tillvägagångssätt exemplifierar skiftet mot precisionsmedicin, där modellen med en storlek som passar alla får ge vika för mer individualiserad vård.
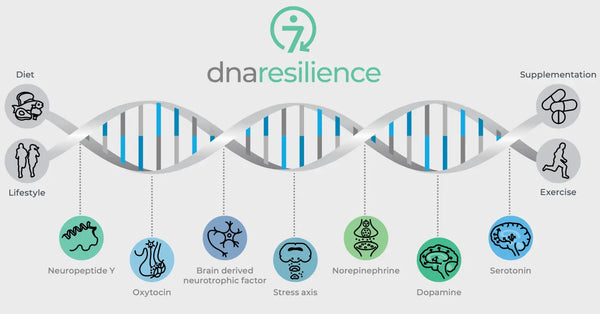
Bild: De sju molekylära vägarna för motståndskraft.
Olika typer av DNA-test för motståndskraft
1) Gener för stressrespons
Stressresponsgener är kritiska komponenter i kroppens system för att hantera och reagera på stressfaktorer. De kodar för proteiner som reglerar olika fysiologiska processer, inklusive frisättning och verkan av kortisol, ett hormon som är centralt i stressresponsen.
CRHR1 (Receptor 1 för kortikotropinfrisättande hormon)
CRHR1 kodar för en receptor för kortikotropinfrisättande hormon (CRH), ett centralt hormon som initierar stressreaktionen. När CRH binder till CRHR1 stimulerar det produktionen och frisättningen av adrenokortikotropt hormon (ACTH), vilket får binjurarna att producera kortisol. Varianter i CRHR1-genen kan påverka hur känslig denna receptor är för CRH, vilket kan förändra den totala stressreaktionen. Vissa polymorfismer kan till exempel leda till en ökad stressreaktion, vilket kan bidra till ångest eller depression. Andra kan däremot dämpa responsen och påverka förmågan att hantera akut stress.(6-7)
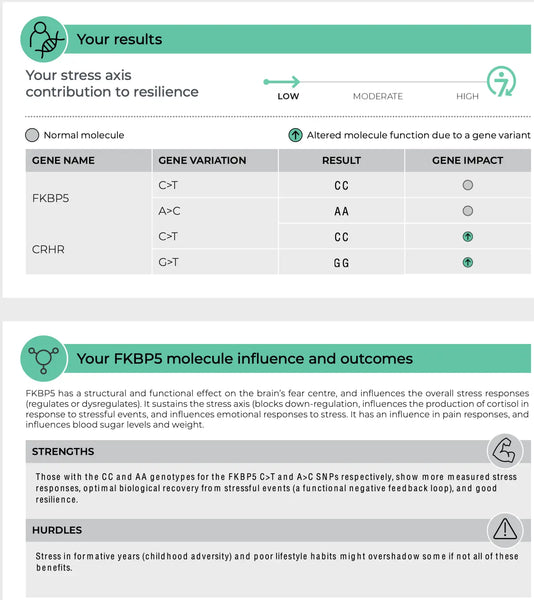
FKBP5 (FK506-bindande protein 5)
Genen FKBP5 spelar en roll i regleringen av känsligheten hos glukokortikoidreceptorn, som är den receptor genom vilken kortisol utövar sina effekter. Specifika polymorfismer i FKBP5 har kopplats till förändrad feedback-hämning av HPA-axeln och olika svar på glukokortikoider. Vissa varianter av FKBP5 kan t.ex. minska glukokortikoidreceptorns affinitet för kortisol, vilket kan leda till ett försämrat stressvar och en ökad risk för stressrelaterade psykiska störningar som PTSD eller egentlig depression.(8-9)
Bild: En exempelsida från DNA Resilience-test.
NR3C1 (Underfamilj 3 av kärnreceptorer, grupp C, medlem 1)
NR3C1 kodar för själva glukokortikoidreceptorn. Variationer i denna gen kan påverka hur kroppen reagerar på kortisol. Specifika polymorfismer i NR3C1 kan påverka känsligheten eller tätheten hos glukokortikoidreceptorer, vilket påverkar hur effektivt kortisol kan utföra sina funktioner. Detta kan leda till en rad olika reaktioner, från en dämpad stressrespons som kan hindra en individ från att reagera adekvat på stressfaktorer till en överdriven respons som kan leda till kroniska stressymtom och till och med depression.(10-12)
Resultaten från ett gentest för stressrespons kan ge insikter om en individs benägenhet för stressrelaterade hälsoproblem. Ett exempel:
-
Förhöjd stressrespons: Individer med specifika varianter kan vara mer reaktiva mot stress och uppleva högre kortisolnivåer under stressiga händelser.
-
Minskad stressreaktion: Omvänt kan vissa individer ha en avtrubbad stressreaktion, vilket kan vara skyddande i akuta stressituationer men också hindra aktiveringen av nödvändiga fysiologiska mekanismer som svar på utmaningar.
2) Test av neurotransmittorers funktion förklaras
Test av neurotransmittorfunktion är utformade för att undersöka de genetiska faktorer som påverkar hur neurotransmittorer syntetiseras, frisätts och bryts ned i hjärnan. Eftersom signalsubstanser är kemiska budbärare som reglerar humör, kognition och stressreaktioner, kan variationer i gener relaterade till dessa substanser ha betydande konsekvenser för en individs psykologiska motståndskraft och övergripande psykiska hälsa.
Att utforska neurotransmittorers funktion i samband med motståndskraft och stressrespons sträcker sig längre än bara till katekolaminer som dopamin. Det inkluderar ett bredare spektrum av neurotransmittorsystem som är involverade i humörreglering, vakenhet och kognitiv funktion. Flera gener är inblandade i syntes, signalering och nedbrytning av dessa signalsubstanser, bland annat dopamin-betahydroxylas (DBH), dopaminreceptorer (DRD2, DRD4) och olika serotoninrelaterade gener.(13)
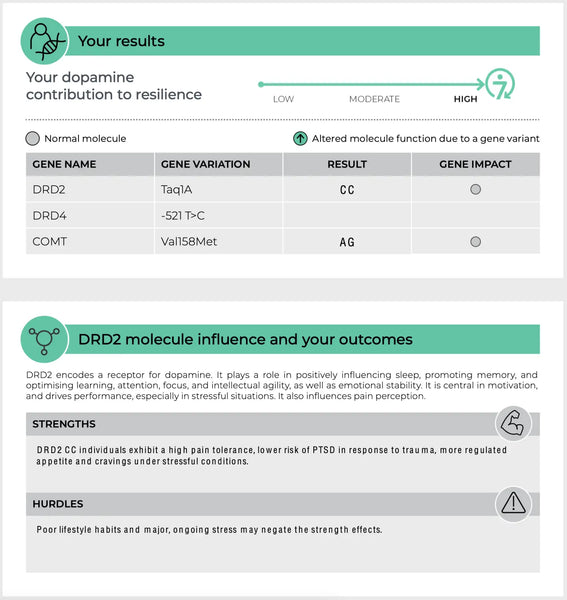
COMT (Katekol-O-metyltransferas)
COMT-genen är en av de gener som studerats mest ingående när det gäller neurotransmittorernas funktion. Den kodar för ett enzym som bryter ned katekolaminer - t.ex. dopamin, adrenalin och noradrenalin - signalsubstanser som är viktiga för stressreaktioner, kognition och känsloreglering.
Det finns välkända polymorfismer i COMT-genen, t.ex. varianten Val158Met. Denna variant kan påverka enzymets aktivitetsnivå på olika sätt:(14-15)
- Högaktiv form (Val-variant): Denna form av enzymet bryter ner dopamin i snabbare takt, vilket kan leda till lägre nivåer av dopamin i prefrontala cortex, en hjärnregion som är involverad i verkställande funktion och beslutsfattande. Personer med denna variant kan prestera bättre i uppgifter under stabila förhållanden men kan vara mer mottagliga för kognitiv försämring under stress på grund av lägre tillgänglighet av dopamin.
- Lågaktivitetsform (Met-variant): Omvänt metaboliserar denna form av COMT-enzymet dopamin långsammare, vilket resulterar i högre dopaminnivåer i hjärnan. Detta kan förbättra den kognitiva funktionen under stress, men kan också öka risken för stressrelaterade psykopatologier, t.ex. ångestsyndrom, eftersom hjärnan potentiellt överstimuleras av överskott av dopamin.
Dopamin beta-hydroxylas (DBH)
DBH är ett enzym som omvandlar dopamin till noradrenalin, en neurotransmittor som är involverad i kamp- eller flyktreaktionen. Genetiska variationer i DBH-genen kan påverka enzymaktiviteten och därmed påverka dopamin- och noradrenalinnivåerna i hjärnan och det perifera nervsystemet.(16-18)
- Låg aktivitet: Varianter som förknippas med lägre DBH-aktivitet kan leda till högre nivåer av dopamin och lägre nivåer av noradrenalin, vilket kan påverka kognitiva funktioner som uppmärksamhet och beslutsfattande och påverka hur en individ reagerar på stress.
- Hög aktivitet: Omvänt kan varianter som resulterar i högre DBH-aktivitet sänka dopaminnivåerna samtidigt som de ökar noradrenalin, vilket kan påverka stressreaktivitet och ångest.
Dopaminreceptorer (DRD2 och DRD4)
DRD2 och DRD4 är gener som kodar för dopaminreceptorerna D2 respektive D4. Dessa receptorer är en del av dopaminsystemet som reglerar många funktioner, bland annat humör, belöning och motorisk kontroll.(19-20)
- DRD2: Varianter i DRD2-genen kan påverka D2-receptorernas densitet och bindningsaffinitet. Detta kan påverka sårbarheten för stress och effektiviteten hos belöningsrelaterade signaler, med potentiella konsekvenser för tillstånd som missbruk och depression.
- DRD4: DRD4-genen är känd för ett varierande antal tandemrepetitioner (VNTR) i den kodande regionen. Specifika upprepningar är förknippade med egenskaper som nyhetssökande och risken för uppmärksamhetsstörningar. Denna polymorfism kan påverka effektiviteten i synaptisk dopaminsignalering och har studerats i samband med beteendemässig och psykologisk motståndskraft.
Bild: Ett exempel på en sida i DNA Resilience-test.
Variationer i serotonin-genen
Serotonin är en annan viktig signalsubstans för reglering av humör, aptit och sömn, som alla kan påverkas av stress. Flera gener som är involverade i serotoninsignalering är av intresse:
- 5-HTT (SLC6A4): Denna gen kodar för serotonintransportören, som ansvarar för återupptaget av serotonin från den synaptiska klyftan. Polymorfismen 5-HTTLPR i promotorregionen för denna gen har studerats för dess samband med stresskänslighet och humörstörningar.(21)
- MAOA: Monoaminoxidas A-genen är ansvarig för nedbrytningen av serotonin. Variationer i denna gen kan påverka serotoninnivåerna och har associerats med beteendemässiga egenskaper och stresskänslighet.(22)
- TPH2: Tryptofanhydroxylas-2 är ett enzym som är kritiskt för att syntetisera serotonin i hjärnan. Genetiska variationer i TPH2 kan påverka serotoninproduktionen, vilket potentiellt kan påverka känslomässig reglering och reaktion på stress.(23)
Tolkningen av resultaten från dessa tester kan vara komplex. En variant som är förknippad med en högre risk för stressrelaterade tillstånd behöver t.ex. inte betyda att en individ kommer att utveckla sådana tillstånd, men det kan tyda på en ökad sårbarhet. På samma sätt innebär inte innehav av en "resilience"-variant att man har en oantastlig motståndskraft mot stress, eftersom miljöfaktorer och livsstilsval spelar en viktig roll.
3) Inflammation och dess inverkan på hjärnan
Kronisk inflammation kan vara skadlig för hjärnans hälsa. Den tros bidra till utvecklingen och förloppet av neurodegenerativa sjukdomar och kan påverka hjärnans stressrespons, som är nära kopplad till motståndskraft. Proinflammatoriska cytokiner, som interleukin-6 (IL-6) och tumörnekrosfaktor (TNF), kan passera blod-hjärnbarriären och interagera med de signalvägar som reglerar humör, motivation och vakenhet.(24)
Genvarianter associerade med inflammation
IL-6 (interleukin-6)
IL-6 är en cytokin som spelar en roll i det inflammatoriska svaret och är involverad i olika biologiska funktioner, inklusive immunsvar, hematopoiesis och benmetabolism. I samband med stress och motståndskraft är IL-6 relaterat till följande:(25-26)
- Förhöjda IL-6-nivåer har förknippats med en större risk för att utveckla depression och andra humörstörningar.
- Specifika genetiska varianter av IL-6-genen kan leda till ökat uttryck av IL-6, vilket potentiellt kan förvärra det inflammatoriska svaret och förändra hjärnans förmåga att hantera stress.
TNF (tumörnekrosfaktor)
TNF är en annan cytokin som är involverad i systemisk inflammation. Den har olika roller, bland annat reglering av immunceller och induktion av feber, apoptos och inflammation.(27)
- Överuttryck av TNF har kopplats till olika kroniska sjukdomar, bland annat reumatoid artrit, inflammatorisk tarmsjukdom och psoriasis, samt till psykologisk stress och depression.
- Varianter i TNF-genen kan påverka nivån av TNF-produktion, vilket kan ha direkta konsekvenser för inflammatoriska processer i hela kroppen och i hjärnan.
4) Neurobiologiska regulatorer och motståndskraftsfaktorer
Genetiska variationer i viktiga neurobiologiska regulatorer styr också motståndskraften mot stress. Dessa inkluderar oxytocin, Brain-Derived Neurotrophic Factor (BDNF) och Neuropeptid Y (NPY). Oxytocin spelar en roll i regleringen av sociala beteenden och stressreaktioner. BDNF är avgörande för att upprätthålla neuroplasticitet och kognitiv funktion under stress och NPY modulerar ångest och det fysiologiska stressvaret. Dessa molekyler påverkar tillsammans våra neurala kretsar och vår psykologiska motståndskraft, vilket ger insikter om individuella skillnader i stresstålighet och potentiella vägar för personliga biohacking-strategier.
Oxytocin
Oxytocin kallas ofta för "kärlekshormonet" på grund av dess roll i sociala band, moderliga beteenden och intimitet. Det har också ångestdämpande effekter och påverkar social kognition och beteende.
- Genetiskt inflytande: Variationer i oxytocinreceptorgenen (OXTR) har associerats med känslomässig reglering, socialt beteende och stresskänslighet. Specifika polymorfismer i OXTR kan påverka bindningseffektiviteten och uttrycksnivåerna för oxytocinreceptorer, vilket kan påverka en individs förmåga att hantera stress och skapa sociala relationer.(28)
- Konsekvenser: I samband med resilienstestning kan bedömning av OXTR-varianter ge insikter om en individs benägenhet för social ångest, empatinivåer och potentiella motståndskraft mot stress, särskilt den som involverar social dynamik.(29)
Neurotrofisk faktor som härrör från hjärnan (BDNF)
BDNF är ett viktigt protein som är involverat i neuroplasticitet, hjärnans förmåga att omorganisera och bilda nya nervförbindelser under hela livet. Det är avgörande för inlärning, minne och regenerering av nervceller.(30)
- Genetiska variationer: BDNF-genvarianten Val66Met är en av de mest studerade polymorfismerna. Met-allelen har förknippats med minskad aktivitetsberoende utsöndring av BDNF, vilket kan påverka den kognitiva funktionen och motståndskraften mot neurologiska och psykiatriska störningar.(31)
- Konsekvenser: Testning av BDNF-genvarianter kan bidra till att förutsäga en individs förmåga till neuroplasticitet som svar på stress och kan ha betydelse för återhämtning efter neurologiska skador eller trauma.(32)
Bild: En exempelsida från DNA Resilience testanalys.
Neuropeptid Y (NPY)
NPY är en av de mest förekommande peptiderna i hjärnan och är involverad i reglering av stressreaktioner, ångest och matintag. Den anses vara ett endogent ångestdämpande medel.
- Genetiska associationer: Polymorfismer i NPY-genen kan leda till skillnader i NPY-uttryck och -utsöndring, vilket kan påverka en individs stresstålighet. Högre nivåer av NPY är i allmänhet skyddande mot effekterna av stress.
- Konsekvenser Genetisk testning för NPY-varianter kan potentiellt indikera en individs grundläggande stresstålighet och kan förutsäga deras psykologiska respons på kronisk stress och trauma.(33)
Epigenetikens roll i moduleringen av stresstålighet
Området för epigenetik fördjupar sig i ett lager av komplexitet bortom den statiska DNA-sekvensen. Epigenetiska modifieringar består av kemiska förändringar av DNA-strukturen, t.ex. metylering och histonmodifieringar, som kan påverka hur gener uttrycks utan att den underliggande genetiska koden ändras. Dessa förändringar är dynamiska och reagerar på miljöstimuli, inklusive kronisk stress. Exponering för långvarig stress kan leda till epigenetiska förändringar som påverkar funktionen hos gener som är involverade i stressresponsen, vilket potentiellt kan göra det svårare för individer att hantera nya stressfaktorer på ett effektivt sätt.(34-35)
Företag som ligger i framkant när det gäller individanpassad medicin satsar nu på epigenetik för att försöka ta reda på hur dessa förändringar kan bidra till en individs förmåga att stå emot och återhämta sig från stress. Genom att analysera epigenetiska markörer kan forskare få insikter om det aktuella tillståndet för genuttrycksprofiler, som är resultatet av både genetisk predisposition och miljöpåverkan. Sådana tester kan identifiera epigenetiska förändringar som svar på kronisk stress, vilket ger en ögonblicksbild av de molekylära mekanismer som bidrar till en individs stressrespons eller brist på sådan.
Förståelsen för dessa epigenetiska förändringar öppnar dessutom dörren för individanpassade interventioner. Specifika livsstilsförändringar, kostjusteringar och terapeutiska strategier kan rekommenderas för att vända negativa epigenetiska förändringar. Denna individanpassade strategi förbättrar inte bara individens motståndskraft utan bidrar också till en bredare förståelse för hur stress påverkar våra biologiska system på epigenetisk nivå, vilket kan leda till nya behandlingar och förebyggande strategier för stressrelaterade sjukdomar. Genom att kartlägga det epigenetiska landskapet i stressresponsen kan vi börja måla upp en mer heltäckande bild av de faktorer som bidrar till vår unika förmåga att hantera livets utmaningar.
Fördelar och begränsningar med DNA-test för resiliens
Dessa tester kan ge individer en bättre förståelse för deras medfödda motståndskraft och stressrespons. Sådan kunskap kan ligga till grund för individanpassade strategier för att hantera stress och förbättra den psykiska hälsan. Det är dock viktigt att vara försiktig när man använder dessa tester:
- Komplexa egenskaper: Motståndskraft bestäms inte av en enda gen utan är en komplex egenskap som påverkas av många gener och miljöfaktorer.
- Påverkan från miljön: Genetik fungerar inte isolerat. Livserfarenheter, stödsystem och livsstilsval har stor betydelse för motståndskraften.
- Prediktiv kraft: Även om dessa tester kan ge insikter är de inte definitiva förutsägelser av en individs förmåga att hantera livets utmaningar.
Slutsats
DNA-tester relaterade till motståndskraft representerar en spännande gräns för att förstå hur vår genetiska sammansättning kan påverka förmågan att hantera stress och återhämta sig från motgångar. Även om de kan ge värdefulla insikter bör de ses som en bit i det gigantiska pussel som utgör en individs motståndskraft. Alla som är intresserade av dessa tester rekommenderas att rådgöra med en vårdgivare eller en genetisk rådgivare för att tolka resultaten mot bakgrund av sin hälsa och livsstil i ett bredare sammanhang.
- Få ditt Integral DNA-test här!
- Boka en konsultation för att tolka dina labb- och gentester med Dr. Sovijärvi här.
Vetenskapliga referenser:
- Bobrow, M., & Grimbaldeston, A. H. (2000). Medicinsk genetik, det humana genomprojektet och folkhälsa: Presenterades vid University of Liverpool den 9 december 1996 och godkändes för publicering den 17 februari 2000. Journal of Epidemiology & Community Health, 54(9), 645-649.
- Cicchetti, D. (2010). Motståndskraft under förhållanden med extrem stress: ett perspektiv på flera nivåer. World psychiatry, 9(3), 145.
- Luecken, L. J., & Gallo, L. C. (Eds.). (2008). Handbok i fysiologiska forskningsmetoder inom hälsopsykologi. Sage.
- Southwick, S. M., Vythilingam, M., & Charney, D. S. (2005). Depressionens psykobiologi och motståndskraft mot stress: konsekvenser för förebyggande och behandling. Annu. Rev. Clin. Psychol. 1, 255-291.
- Michaud, M., Balardy, L., Moulis, G., Gaudin, C., Peyrot, C., Vellas, B., ... & Nourhashemi, F. (2013). Proinflammatoriska cytokiner, åldrande och åldersrelaterade sjukdomar. Journal of the American Medical Directors Association, 14(12), 877-882.
- Aguilera, G., Nikodemova, M., Wynn, P. C., & Catt, K. J. (2004). Kortikotropinfrisättande hormonreceptorer: två decennier senare. Peptides, 25(3), 319-329.
- Subbannayya, T., Balakrishnan, L., Sudarshan, G., Advani, J., Kumar, S., Mahmood, R., ... & Prasad, T. K. (2013). En integrerad karta över signalvägen för kortikotropinfrisättande hormon. Journal of cell communication and signaling, 7, 295-300.
- Binder, E. B. (2009). Rollen för FKBP5, en co-kaparon av glukokortikoidreceptorn i patogenesen och terapin av affektiva och ångeststörningar. Psykoneuroendokrinologi, 34, S186-S195.
- Ising, M., Depping, A. M., Siebertz, A., Lucae, S., Unschuld, P. G., Kloiber, S., ... & Holsboer, F. (2008). Polymorfismer i FKBP5-genregionen modulerar återhämtning från psykosocial stress hos friska kontroller. European Journal of Neuroscience, 28(2), 389-398.
- Vitellius, G., Trabado, S., Bouligand, J., Delemer, B., & Lombès, M. (2018, juni). Patofysiologi för glukokortikoidsignalering. I Annales d'endocrinologie (Vol. 79, nr 3, s. 98-106). Elsevier Masson.
- Van West, D., Van Den Eede, F., Del-Favero, J., Souery, D., Norrback, K. F., Van Duijn, C., ... & Claes, S. (2006). Glukokortikoidreceptorgenbaserad SNP-analys hos patienter med återkommande allvarlig depression. Neuropsychopharmacology, 31(3), 620-627.
- Schneider, K. K., Frings, C., Meyer, J. och Schote, A. B. (2016). Glukokortikoidreceptorgenens (NR3C1) roll för bearbetning av aversiva stimuli. Neurovetenskaplig forskning, 107, 8-13.
- Azadmarzabadi, E., Haghighatfard, A., & Mohammadi, A. (2018). Låg motståndskraft mot stress är förknippad med förändringar i kandidatgenuttryck i den dopaminerga signalvägen. Psychogeriatrics, 18(3), 190-201.
- Heinz, A., & Smolka, M. N. (2006). Effekterna av catechol O-metyltransferasgenotyp på hjärnaktivering framkallad av affektiva stimuli och kognitiva uppgifter. Recensioner inom neurovetenskap, 17(3), 359-368.
- Mier, D., Kirsch, P., & Meyer-Lindenberg, A. (2010). Neurala substrat av pleiotropisk verkan av genetisk variation i COMT: en metaanalys. Molekylär psykiatri, 15(9), 918-927.
- Mustapic, M., Maihofer, A. X., Mahata, M., Chen, Y., Baker, D. G., O'Connor, D. T., & Nievergelt, C. M. (2014). Det katekolaminbiosyntetiska enzymet dopamin β-hydroxylas (DBH): första genomomfattande sökpositioner egenskapsbestämmande varianter som verkar additivt i den proximala promotorn. Human molekylär genetik, 23(23), 6375-6384.
- Vincent, S., & Robertson, D. (2002). Den bredare synen: katekolaminavvikelser. Clinical Autonomic Research, 12, I44-I49.
- Hoenicka, J., Aragüés, M., Ponce, G., Rodríguez-Jiménez, R., Jiménez-Arriero, M. A., & Palomo, T. (2007). Från dopaminerga gener till psykiatriska störningar. Forskning om neurotoxicitet, 11, 61-71.
- Hill, S. Y., Hoffman, E. K., Zezza, N., Thalamuthu, A., Weeks, D. E., Matthews, A. G. och Mukhopadhyay, I. (2008). Dopaminerga mutationer: Association inom familjen och koppling i familjer med multiplex alkoholberoende. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 147(4), 517-526.
- He, Y., Martin, N., Zhu, G., & Liu, Y. (2018). Kandidatgener för nyhetssökande: en metaanalys av associationsstudier av: DRD4: exon III och: COMT: Val158Met. Psykiatrisk genetik, 28(6), 97-109.
- Avula, R., Rand, A., Black, J. L. och O'kane, D. J. (2011). Samtidig genotypning av flera polymorfismer i den mänskliga serotonintransportörgenen och upptäckt av nya allelvarianter. Translational psychiatry, 1(8), e32-e32.
- Tivol, E. A., Shalish, C., Schuback, D. E., Hsu, Y. P., & Breakefield, X. O. (1996). Mutationsanalys av den mänskliga MAOA-genen. American journal of medical genetics, 67(1), 92-97.
- Waider, J., Araragi, N., Gutknecht, L., & Lesch, K. P. (2011). Tryptofanhydroxylas-2 (TPH2) vid störningar av kognitiv kontroll och känsloreglering: ett perspektiv. Psykoneuroendokrinologi, 36(3), 393-405.
- Bauer, M. E., & Teixeira, A. L. (2021). Neuroinflammation vid humörsjukdomar: roll för reglerande immunceller. Neuroimmunomodulation, 28(3), 99-107.
- Anderson, G., Kubera, M., Duda, W., Lasoń, W., Berk, M. och Maes, M. (2013). Ökad IL-6 trans-signalering vid depression: fokus på tryptofankatabolitvägen, melatonin och neuroprogression. Farmakologiska rapporter, 65(6), 1647-1654.
- Perry, B. I., Upthegrove, R., Kappelmann, N., Jones, P. B., Burgess, S., & Khandaker, G. M. (2021). Samband mellan immunologiska proteiner/egenskaper och schizofreni, egentlig depression och bipolär sjukdom: en dubbelriktad mendelsk randomiseringsstudie med två stickprov. Brain, behavior, and immunity, 97, 176-185.
- Bradley, J. (2008). TNF-medierad inflammatorisk sjukdom. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 214(2), 149-160.
- Loth, E., Poline, J. B., Thyreau, B., Jia, T., Tao, C., Lourdusamy, A., ... & IMAGEN Consortium. (2014). Oxytocinreceptorgenotyp modulerar ventral striatal aktivitet till sociala ledtrådar och svar på stressiga livshändelser. Biologisk psykiatri, 76(5), 367-376.
- Myers, A. J., Williams, L., Gatt, J. M., McAuley-Clark, E. Z., Dobson-Stone, C., Schofield, P. R., & Nemeroff, C. B. (2014). Variation i oxytocinreceptorgenen är förknippad med ökad risk för ångest, stress och depression hos individer med en historia av exponering för tidig livsstress. Journal of psychiatric research, 59, 93-100.
- Cowansage, K. K., LeDoux, J. E., & Monfils, M. H. (2010). Brain-derived neurotrophic factor: en dynamisk grindvakt för neural plasticitet. Current molecular pharmacology, 3(1), 12-29.
- Chen, Z. Y., Jing, D., Bath, K. G., Ieraci, A., Khan, T., Siao, C. J., ... & Lee, F. S. (2006). Genetisk variant BDNF (Val66Met) polymorfism förändrar ångestrelaterat beteende. vetenskap, 314 (5796), 140-143.
- Phillips, C. (2017). Hjärnderiverad neurotrofisk faktor, depression och fysisk aktivitet: att göra den neuroplastiska anslutningen. Neural plasticitet, 2017.
- Schmeltzer, S. N., Herman, J. P., & Sah, R. (2016). Neuropeptid Y (NPY) och posttraumatisk stressstörning (PTSD): en translationell uppdatering. Experimentell neurologi, 284, 196-210.
- Lux, V. (2016, mars). Epigenetisk programmering i psykobiologisk utveckling: Bevis för teorin om dubbel aktivering och en förmedlande roll för stress i det tidiga livet. I Qatar Foundation Annual Research Conference Proceedings Volume 2016 Issue 1 (Vol. 2016, nr 1, s. HBOP3415). Hamad bin Khalifa University Press (HBKU Press).
- Chukwuma Sr, C. (2022). Epigenetik och dess väsen i förståelsen av mänsklig tillväxt, utveckling och sjukdom. J Med Res, 8(5), 165-172.