Митохондрия являются жизненно важными органеллами, расположенными в цитоплазме эукариотических клеток. Благодаря хорошо функционирующим митохондриям, каждому процессу в организме, от движения и физических упражнений до пищеварения и выздоровления работает лучше. Они играют важную роль в генерации энергии и многих других клеточных процессов. Митохондрии предлагают местоположение для окислительного фосфорилирования, которое производит АТФ, основной источник энергии клетки. Структурно митохондрии могут быть оценены через внешнюю мембрану и сильно сложенную внутреннюю мембрану, которая образует отсеки, необходимые для их метаболизма. Наряду с производством энергии митохондрии выполняют другие действия, такие как передача сигналов кальция и регуляция клеточного метаболизма в дополнение к апоптозу (запрограммированная смерть), что делает их жизненно важными для поддержания клеточного гомеостаза.
Основы митохондриальной функции
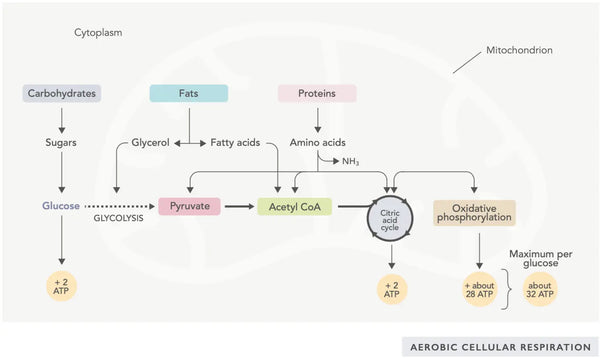
Генерация АТФ (первичная молекула энергии, используемая клетками) является фундаментальной особенностью митохондриальной активности. Этот процесс происходит через два основных биохимических путях: цикл лимонной кислоты (цикл TCA или цикл Krebs) и цепь транспорта электронов (и т. Д.).
Цикл лимонной кислоты
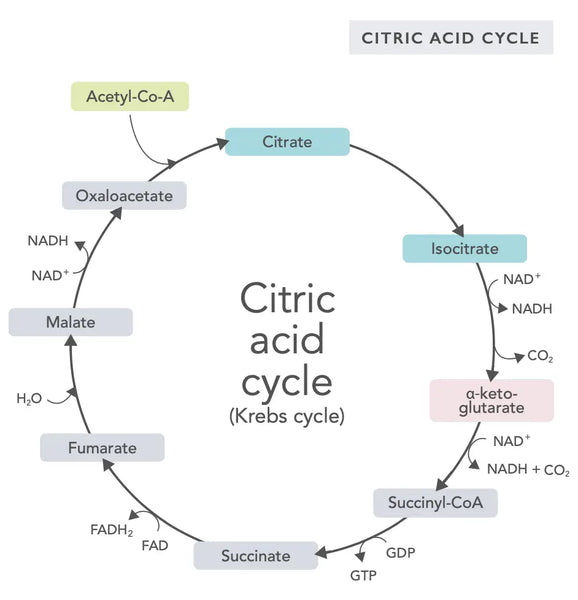
Цикл лимонной кислоты, или цикл Кребса (названный в честь лауреата Нобелевской премии Ханс Адольф Кребс, который его обнаружил), встречается в клеточных митохондриях.(1)Первичным метаболическим соединением цикла лимонной кислоты является уксусная кислота (ацетил -кофермент A), продуцируемый из жирных кислот, углеводов и белков.(2)
Различные реакции цикла лимонной кислоты (см. Изображение) образуют ионы водорода и электроны, которые затем переносятся во внутреннюю митохондриальную мембрану для окислительного фосфорилирования (энергия связывания с молекулами АТФ посредством окисления) и цепь транспорта электронов. Реакция высвобождает NADH и небольшое количество АТФ и углекислый газ.
Цикл лимонной кислоты включает в себя десять этапов, каждый из которых влияет витамины группы В, некоторые минералы, такие как магний и железо, и основной антиоксидант печени, глутатион. Реакции ингибируются тяжелыми металлами, такими как ртуть, мышьяк и алюминий.
Богатые энергией молекулы NADH захватывают большую часть энергии, генерируемой во время цикла лимонной кислоты. Для каждого ацетил -кофермента молекулы три молекулы NADH генерируются и затем используются для энергии в следующей реакции (окислительное фосфорилирование).
Регуляция цикла лимонной кислоты определяется наличием различных аминокислот и ингибирования обратной связи (например, если продуцируется слишком много NADH, ингибируются несколько ферментов цикла лимонной кислоты, замедляя реакции).
Оксалоацетат это соединение, которое удовлетворяет внезапной потребности в производстве энергии (например, в мозге или мышцах). Взятиесалоацетатной добавки может быть полезно, и это может даже повысить регенерацию митохондрий в мозге, уменьшить тихие воспаление в организме и увеличить количество нервных клеток.(3)
Проще говоря, организм включает в себя гениальные системы, которые преобразуют потребляемую пищу в электроны, используемые в качестве энергии для различных потребностей.
Окислительное фосфорилирование
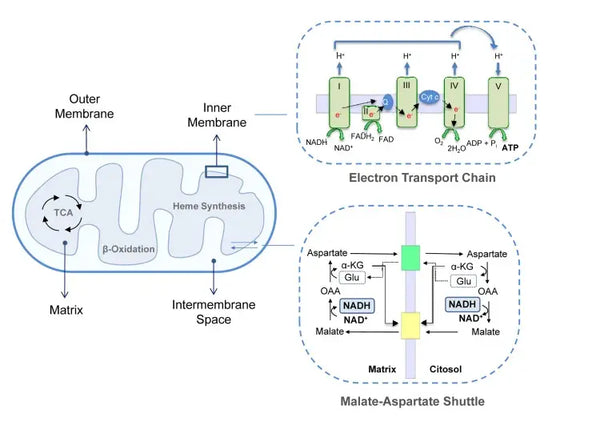
Окислительное фосфорилирование состоит из цепи транспорта электронов и АТФ -синтазы. Окислительное фосфорилирование производит наибольшую энергию, генерируемую в аэробных условиях (АТФ). Это продолжение цикла лимонной кислоты.
В цепи транспорта электронов ионы водорода (H+) высвобождаются в митохондриальное межмембранное пространство. Ионы водорода, высвобождаемые из межмембранного пространства, возвращаются обратно в митохондрион через АТФ -синтазу. Используя энергию, выделяющуюся в процессе, ATP -синтаза преобразует ADP, используемый для энергии в ATP снова.
Убикинон (коэнзим Q10) вносит вклад в электронную транспортную цепь. Он использовался в течение десятилетий в качестве пищевой добавки. Низкие уровни клеточного убихинона могут быть предрасполагающим фактором для различных заболеваний из -за недостаточной продукции аэробной энергии в клетках. Кроме того, использование лекарств от холестерина (статины) является фактором, способствующим дефициту убихинона.(4)
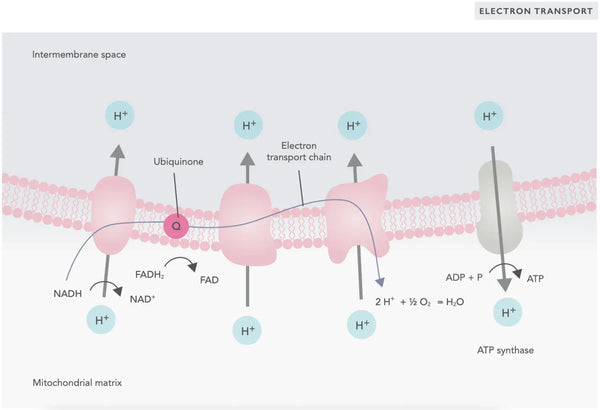
Этот скоординированный набор реакций генерирует АТФ и устанавливает градиент протонов через внутреннюю митохондриальную мембрану, процесс, известный как химиосмосПолем Энергия, хранящаяся в этом градиенте, ведет синтез АТФ, связывая поток электронов через и т. Д. С генерацией клеточной энергии.(5)
Факторы, влияющие на эффективность митохондрий
Митохондриальная эффективность, которая, очевидно, жизненно важна для оптимальной клеточной функции, зависит от различных факторов. Ниже описаны наиболее важные.
Генетический макияж
Митохондрии обладают отдельной и отдельной ДНК (митохондриальной ДНК, мтДНК), отличной от ядерной ДНК. МтДНК кодирует важные компоненты цепи транспорта электронов и митохондриальных белков. Мутации в мтДНК могут привести к дисфункциональным белкам, нарушая цепь транспорта электронов и синтез АТФ. Они могут привести к снижению производства энергии и увеличению генерации активных форм кислорода (АФК), способствующей митохондриальной и клеточной дисфункции.(6)
Окислительный стресс
Митохондрии являются важным источником АФК, которые являются побочными продуктами метаболизма кислорода. В то время как низкие уровни функции АФК в клеточной передаче сигналов, чрезмерный АФК может вызвать окислительное повреждение митохондриальных белков, липидов и ДНК. Этот окислительный стресс ставит под угрозу целостность и функцию митохондриальной целостности, ингибируя выработку АТФ и приводит к дальнейшей продукции АФК в вредном цикле. Антиоксидантная защита, в том числе супероксиддисмутаза и глутатион пероксидаза, играют критическую роль в смягчении этого повреждения.(7-8)
Доступность питательных веществ
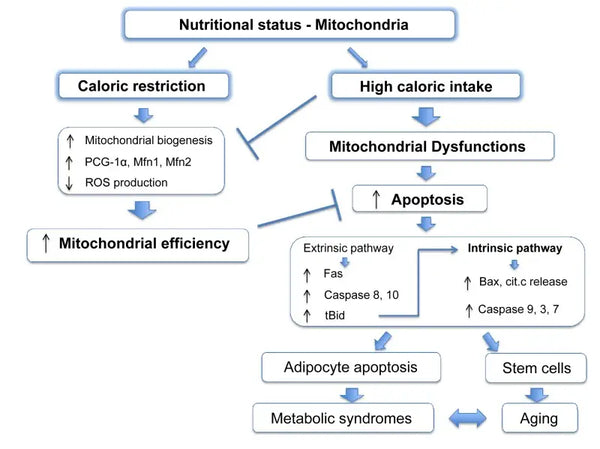
Митохондрии требуют конкретных субстратов для производства энергии. Глюкоза и жирные кислоты являются первичными источниками генерации АТФ посредством гликолиза и β-окисления соответственно. Доступность этих субстратов напрямую влияет на митохондриальную функцию. Например, в условиях избытка питательных веществ, таких как высокая доступность глюкозы, митохондрии могут производить чрезмерное количество АТФ и АФК, что может привести к метаболическим нарушениям.(9-10)
И наоборот, нехватка питательных веществ может ограничить производство митохондриальной энергии, влияя на функцию клеток и выживание. В отличие от некоторых сообщений о исследованиях животных о преимуществах ограничения калорий в митохондриальном биогенезе, кажется, что он не увеличивает митохондриальный биогенез. Однако он сохраняет митохондриальную функцию, защищая целостность и функцию существующих сотовых компонентов.(11-12)
Факторы образа жизни
Упражнение
Физическая активность влияет на митохондриальное количество и качество. Упражнения стимулируют митохондриальный биогенез, что приводит к увеличению плотности митохондрий и эффективности производства энергии.(13) Особенно обучение на выносливость усиливает окислительную способность митохондрий, улучшая их способность использовать кислород для производства АТФ (подробно читайте подробнее в статье).
Диета
Диетические компоненты значительно влияют на митохондриальную функцию. Соотношения макронутриентов, потребление калорий и специфические питательные вещества (такие как антиоксиданты, витамины и минералы) влияют на метаболизм митохондрий. Диеты, богатые питательными веществами, которые поддерживают митохондриальную функцию, могут улучшить производство энергии и снизить окислительный стресс (см. Позже). Активирование кетоз может также увеличить митохондриальный биогенез и повысить эффективность митохондрий.(14-15)
Факторы окружающей среды
Воздействие стрессоров окружающей среды, таких как токсины, загрязняющие вещества, тяжелые металлы (например, свинец, ртуть, мышьяк и кадмий) и радиация, может отрицательно влиять на митохондриальную функцию. Эти стрессоры могут вызвать окислительное повреждение, нарушать активность цепи транспорта электронов и нарушать динамику митохондрий, включая процессы слияния и деления.(16)
Технологические вмешательства
Фотобиомодуляция (или терапия красным светом)
Фотобиомодуляция Является ли использование неионизирующей фотонной энергии для запуска фотохимических изменений в клеточных структурах, которые восприимчивы к фотонам, особенно в митохондриях. Считается, что красный свет и легкая терапия NIR работают в основном через акцепторы фотографий. Красные волны проникают в кожу и достигают митохондрий клетки, увеличивая производство энергии клеток. Различные события приводят к этому, например, ускорение митохондриального дыхания посредством цитохрома С оксидазы. (17) Прочитайте о пользе для здоровья фотобиомодуляции здесь.
Инфракрасная сауна
Инфракрасные сауны используют инфракрасное излучение, которое нагревает ткани тела непосредственно вместо воздуха. Частота излучения, излучаемой инфракрасными саунами, составляет 3–12 мкм, что падает под дальние инфракрасные (FIR). Было обнаружено, что дальний инфракрасный свет обладает эффектами на уровне ткани, особенно на дыхательную цепь митохондрий в процессе производства энергии клеточной энергии и кровоснабжение тканей путем расширения кровеносных сосудов и улучшения циркуляции.(18)
Терапия импульсным электромагнитным полем (PEMF)
PEMF Therapy использует электромагнитные поля для продвижения различных физиологических процессов. Исследования показывают, что PEMF может улучшить функцию митохондрий, увеличивая потребление клеточного кислорода и увеличивая продукцию АТФ. Терапия PEMF напрямую влияет на митохондрии, возвращая клетки в более здоровое состояние энергии и электрического заряда.(19-20) Прочитайте комплексное руководство по терапии PEMF здесь.
Гипербарическая кислородная терапия (HBOT)
HBOT включает в себя дыхание чистого кислорода в подчеркиваемой среде. Клинически доказано, что гипербарическая кислородная терапия оживляет митохондрии и увеличивает образование АТФ, обеспечивая супрафизиологические количества кислорода, необходимого для клеточного дыхания. В недавнем исследовании сообщалось, что HBO увеличивает биогенез митохондрий и аутофагию, частично увеличивая выработку активных форм кислорода. Этот процесс создал новые здоровые митохондрии, а старые дисфункциональные митохондрии были разрушены. Это исследование также обнаружило повышенную активацию транскрипции и репликации ДНК митохондрий.(21-22) Узнайте больше о HBOT здесь.
Питательная и дополнительная поддержка митохондриальной функции
Роль питания в поддержании здоровья митохондрий является ключевой, причем некоторые питательные вещества особенно важны для оптимальной митохондриальной функции. К ним относятся следующее, перечисленное ниже.
- Коэнзим Q10 (COQ10): Убикинон жиро растворимся и напоминает витамин. Убикинон функционирует в качестве электронного носителя в цепи переноса электронов в митохондриях (см. Рисунок справа) и способствует секреции АТФ. Уровни убихинона снижаются в различных тканях со старением.(23)
- Магний: Участвует в синтезе АТФ и имеет решающее значение для поддержания митохондриальной целостности и функции.(24)
- В витамины B: В том числе B1 (тиамин), B2 (рибофлавин), B3 (ниацин), B5 (пантотеновая кислота), B6, B7 (биотин) и B12. Эти витамины группы B имеют решающее значение для различных аспектов метаболизма энергии митохондриальной энергии.(25)
- Альфа-липоевая кислота: ALA является мощным антиоксидантом, который также помогает регенерировать другие антиоксиданты. Он играет роль в энергетическом метаболизме и может улучшить митохондриальную функцию.(26)
- Карнитин (в частности, ацетил-L-карнитин): Транспортирует жирные кислоты в митохондрии для бета-окисления, что имеет решающее значение для производства энергии, особенно в мышечных клетках.(27)
- Креатин: Креатин является естественным соединением в организме, которое помогает поставлять энергию к клеткам, особенно мышечным клеткам, путем увеличения образования аденозинтрифосфата (АТФ). Добавление креатина может повысить митохондриальную эффективность, особенно при высокоинтенсивных упражнениях.(28)
- Пирролохинолин хинон (PQQ): PQQ-это антиоксидант, который увеличивает митохондриальный биогенез через содержание белка PGC-1 и поддерживает митохондриальную функцию.(29)
- Омега-3 жирные кислоты (EPA и DHA): Омега-3 необходимы для поддержания текучести и функции митохондриальной мембраны. Они в основном встречаются в рыбьем жирном жирном жирном жирном масте.(30)
- Никотинамид рибозид (NR) и Никотинамид мононуклеотид (NMN): Эти предшественники NAD+ необходимы для митохондриальной функции и производства энергии. Дополнение NR или NMN может помочь повысить уровень NAD+ и, таким образом, повысить эффективность митохондрий.(31) Узнайте больше об оптимизации NAD+ здесь.
- Куркумин: Куркумин является активным соединением в куркуме. Было показано, что он защищает митохондрии от окислительного повреждения и улучшает их функцию.(32)
- Селен: Основной элемент трассировки, который играет роль в защите митохондрий от окислительного стресса. Селен также активирует митохондриальный биогенез.(33)
Физические упражнения и митохондриальный биогенез
Регулярная физическая активность является критическим фактором в стимулировании митохондриального биогенеза, что приводит к созданию новых митохондрий, тем самым увеличивая их количество и функциональную способность в клетках. Различные формы упражнений оказывают различное влияние на митохондриальную динамику. Двумя наиболее важными формами или упражнениями являются аэробные тренировки и тренировки сопротивления.
Аэробные упражнения
Митохондриальная плотность в клетках скелетных мышц заметно увеличивается во время аэробных упражнений (например, бег, езда на велосипеде и плавание).
Митохондриальный биогенез регулируется с помощью PGC-1α (пролифератор-пролифератор, активируемый пролифератором пероксисом, гамма-коактиватор 1-альфа), необходимый регуляторный белок, который стимулирует экспрессирующие аэробные упражнения. PGC-1α коактивирует ядерные респираторные факторы (NRFS) и фактор транскрипции митохондрий A (TFAM), которые необходимы для транскрибирования мтДНК и воспроизведения митохондрий. Это приводит к повышению эффективности окислительного фосфорилирования, лучшей выносливости и большей генерации АТФ в мышечных клетках.(34)
Интенсивные интервальные тренировки (HIIT) особенно эффективны для увеличения количества митохондрий и максимального поглощения кислорода (VO2MAX).(35-36)
Тренировка сопротивления
Митохондриальная функция и эффективность являются основными мишенями для тренировок с резистентностью (например, поднятие веса и упражнения на веса). Он запускает изменения в синтезе митохондриального белка, повышая качество и эффективность присутствующего митохондрий. Силовая тренировка также увеличивает выработку ферментов в электронных транспортных цепях и цикле Krebs, что еще больше улучшает способность к синтезу АТФ. Это также может увеличить количество и размер митохондрий в мышечных клетках, хотя и не в той же степени, что и аэробные упражнения.(37-38)
Комбинированное влияние этих методов упражнений на митохондриальный биогенез и функцию подчеркивает важность физической активности в поддержании и улучшении здоровья митохондрий. Регулярное аэробное и устойчивое обучение всесторонне усиливает митохондриальную плотность, эффективность и энергетическую метаболизм клеток. Эти адаптации имеют решающее значение для спортивных успеваемости и имеют важное значение для поддержания здоровья, профилактики заболеваний и управления состояниями, связанными с митохондриальной дисфункцией.
Тем не менее, следует отметить, что тренировка как силы, так и выносливости одновременно приводит к меньшей адаптации, поскольку протеинкиназы PKB и AMPK блокируют передачу сигналов друг друга, препятствуя параллельному тренировочному эффекту.(39)
Митофагия и клеточное здоровье
Митофагия относится к селективному типу аутофагии, который играет важную роль в клеточных условиях, способствуя разрушению только поврежденных или нефункциональных митохондрий. Этот механизм имеет решающее значение для здоровья митохондрий и клетки, предотвращая начисление мРНК, которые кодируют дефектную сборку субъединиц, тем самым спасая дальнейшие кризисы в клеточных функциях и многочисленных патологиях.(40)
Устранение поврежденных митохондрий с помощью митофагии помогает снизить окислительный стресс, апоптоз и воспаление (связанные с различными патологиями). Нарушение митофагии облегчает накопление дисфункциональных митохондрий в патогенезе нейродегенерационных расстройств, таких как болезнь Паркинсона и Альцгеймера. Точно так же при метаболических расстройствах потеря митофагии приводит к изменениям метаболизма митохондрий, что приводит к резистентности к инсулину и диабету 2 типа.(41-42)
Было показано, что ограничение калорий способствует митофагии. Отчасти это связано с активацией сиртуинов (SIRT1), AMP-активированной протеинкиназы (AMPK) и фактора транскрипции, которые поддерживают как реакцию как клеточного энергетического кризиса, так и инициацию митофагии. В частности, сиртуины регулируют функцию факторов в механизме митофагии, заставляя замолчать поврежденные митохондрии.(43)
Молекулярные эффекты ограничения калорий имитируются такими соединениями, как ресвератрол (полифенол в красном вине и некоторые ягоды) и многими другими полифенолами. Ресвератрол способствует активации SIRT1 и AMPK, увеличивая митофагию, ответственную за улучшение функций митохондрий и восстановление здоровья клеток.(44-45)
Митофагия может быть усилена с прерывистым постом. Это улучшение, вероятно, смягчается метаболическим переключением от глюкозы на кетоновую энергию во время поста, и этот сдвиг вызывает митофагию (митофагии ((46-47)
Митохондриальная дисфункция как отличительная черта старения
Понимание того, как митохондрии вносят свой вклад в процесс старения, находится в центре исследований геронтологии и клеточной биологии. По мере того, как организмы возрастают, митохондриальная дисфункция становится более распространенной, что играет роль в физиологической стороне старения.
Стареющие митохондрии показывают снижение производства АТФ, что влияет на энергоснабляемые процессы, необходимые для благополучия клеточного благосостояния. Более того, структурные изменения в митохондриях, связанных с возрастом, в большей степени мешают этим снижению энергетического производства, такой как аномальный состав потенциала митохондриальной мембраны и целостность внутренней митохондриальной стенки.(48)
Положение митохондриальная ДНК (мтДНК) Рядом с цепью транспортировки электронов, где происходят активные формы кислорода, влияет на ее уязвимость к мутации. Однако мутации накапливаются со временем, что приводит к митохондриальной дисфункции. В отличие от ядерной ДНК, которая связана с гистонами для защиты и имеет различные доступные механизмы восстановления, мтДНК не имеет защитного покрытия гистонами и не имеет широкого спектра методов восстановления, поэтому она может быть легко повреждена.(49)
В клетках митохондрии продуцируют реактивные формы кислорода (АФК). Хотя ROS служит критическим средством для клетки, чтобы общаться и корректировать себя в окружающей среде, генерация высоких уровней этих молекул ограничена жестким контролем. Чрезмерная продукция в различных возрастных условиях приводит к тому, что клетки, страдающие от окислительного стресса. Он разрушает различные клеточные компоненты, будь то белки, липиды или ДНК. Митохондрии являются даже главным реципиентом окислительного повреждения, создавая порочный круг, поскольку поврежденные митохондрии только генерируют больше АФК, тем самым увеличивая клеточные старение.(50-52)
Митохондриальная динамика имеет решающее значение для митохондриальной функции, которая помогает поддерживать процесс слияния и деления. Тем не менее, эта динамика нарушается старением, и митохондрии подвергаются фрагментации вместо слияния. Эти изменения влияют на функцию митохондрий и их положение в клетках.(53)
Потеря митохондриальной функции является не пассивным явлением, связанным с старением, а активным участником патогенеза возрастных заболеваний. Митохондриальная дисфункция была связана с такими состояниями, как нейродегенеративные заболевания, сердечно -сосудистые заболевания и метаболические нарушения. При этих расстройствах снижение или дефектная выработка энергии, усиление окислительного стресса и неспособность очистить поврежденные митохондрии необходимы в патогенезе и курсе заболевания.(54)
Заключение
Оптимизация здоровья митохондрий и его снижение со старением - сложная задача, но, к счастью, мы можем с этим поделать. Основные вмешательства включают в себя поддержку питания критических субстратов для регенерации, включая коэнзим Q10, магний и витамины группы группы; Регулярное участие в различных дисциплинах упражнений для увеличения митохондриального биогенеза; и модификации образа жизни, такие как ограничение калорий или прерывистый пост, чтобы влиять на механизмы митофагии.
Признание митохондриальной дисфункции как одного из факторов, связанных с старением, делает эти стратегии необходимыми для поддержки здоровья клеток и борьбы с возрастной деградацией. Интегративные подходы, использующие силу научных знаний в сочетании с применимыми изменениями в образе жизни, могут создать благоприятные условия для профилактики и замедления износа митохондрий, которые в целом служат человеческому благополучию и долговечности.
Научные ссылки
- Ли Ф. (2009). Сэр Ханс Адольф Кребс (1900–81), пионер современной медицины, архитектор посредника метаболизма. Журнал медицинской биографии 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Биохимия. 5 -е издание. Глава 17, цикл лимонной кислоты. Нью -Йорк: У. Х. Фриман.
- Wilkins, H. et al. (2014). Оксалоацетат активирует митохондриальный биогенез мозга, усиливает путь инсулина, снижает воспаление и стимулирует нейрогенез. Молекулярная генетика человека 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Первичный и вторичный дефицит Q10 Coenzyme: роль терапевтических добавок. Обзоры питания 71 (3): 180–188. Обзор.
- Saraste, M. (1999). Окислительное фосфорилирование в Fin de Siecle. Наука 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Митохондриальные тРНК человека: биогенез, функция, структурные аспекты и заболевания. Ежегодный обзор генетики 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Являются ли митохондрии основным фактором реактивных форм кислорода в клетках? Журнал экспериментальной биологии 224 (5): JEB221606.
- Thannickal, V. & Fanburg, B. (2000). Реактивные формы кислорода в клеточной передаче сигналов. Американский журнал физиологической клеточной и молекулярной физиологии 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Механизмы производства биоэнергии в митохондриях. Митохондрия и их роль в сердечно -сосудистых заболеваниях 99–121.
- Bottje, W. (2019). Окислительный метаболизм и эффективность: деликатный баланс митохондрий. Наука птицы 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Доступность питательных веществ связывает митохондрии, апоптоз и ожирение. Старение (Олбани Нью -Йорк) 4 (11): 734–741.
- Lanza, I. et al. (2012). Хроническое ограничение калорий сохраняет митохондриальную функцию в старении без увеличения митохондриального биогенеза. Клеточный метаболизм 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Молекулярные механизмы для митохондриальной адаптации к тренировкам в скелетных мышцах. Журнал FASEB 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Регуляция митохондриального биогенеза. Эссе в биохимии 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Метаболическая терапия на основе кетона: увеличение NAD+ первичным механизмом? Границы в молекулярной нейробиологии 10: 377.
- Фаулер Б. (1978). Общие субклеточные эффекты свинца, ртути, кадмия и мышьяка. Перспективы здоровья окружающей среды 22:37-41.
- Хэмблин, М. (2018). Механизмы и митохондриальная окислительно -восстановительная передача сигналов при фотобиомодуляции. Фотохимия и фотобиология 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Дальнее инфракрасное излучение (FIR): его биологические эффекты и медицинские применения. Фотоника и лазеры в медицине 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). Электромагнитная стимуляция увеличивает митохондриальную функцию в остеогенных клетках и способствует восстановлению перелома кости. Научные отчеты 11 (1): 19114.
- Tai, Y. et al. (2020). Магнитные поля модулируют метаболизм и кишечный микробиом в корреляции с экспрессией альфа-1: последующее наблюдение за магнитным митомортическим исследованием in vitro. Журнал FASEB 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perrizet, G. & Hightower, L. (2020). Влияние гипербарического кислорода на метаболизм митохондриальной и гликолитической энергии: концепция калористаза. Клеточный стресс и шапероны 25 (4): 667-677.
- Chen, W. et al. (2020). Гипербарический кислород защищает от повреждения ишемии миокарда путем ингибирования дисфункции митохондрий и аутофагии. Молекулярная медицина сообщает 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). Сложность изготовления убихинона. Тенденции в эндокринологии и метаболизме 30 (12): 929-943.
- Volpe, S. (2013). Магний в профилактике заболеваний и общем здоровье. Достижения в области питания 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O’Brien, P. (2006). Митохондриальная функция и токсичность: роль семейства витаминов В в метаболизме митохондриальной энергии. Химико-биологические взаимодействия 163 (1-2): 94-112.
- Solmonson, A. & Deberardinis, R. (2018). Метаболизм липоевой кислоты и митохондриальная окислительно -восстановительная регуляция. Журнал биологической химии 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Карнитин в биоэнергетике мышц человека: может ли добавка карнитина улучшить физические упражнения? Молекулы 25 (1): 182.
- Воск, B. et al. (2021). Креатин для упражнений и спортивных работ, с соображениями восстановления для здорового населения. Питательные вещества 13 (6): 1915.
- Hwang, P. et al. (2020). Влияние пирролохинолина хинона (PQQ) на аэробные упражнения и индексы митохондриального биогенеза у неподготовленных мужчин. Журнал Американского колледжа питания 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Влияние композиции митохондриальной мембраны и биоэнергетики посредством добавок омега-3. Журнал физиологии 592 (Pt 9): 1913-1914.
- Elhassan, Y. E Al. (2019). Никотинамид рибозид увеличивает стариную скелетную мышцу человека NAD+ и индуцирует транскриптомные и противовоспалительные сигнатуры. Сотовые отчеты 28 (7): 1717-1728.
- De Oliveira, M. et al. (2016). Куркумин, митохондриальный биогенез и митофагия: изучение недавних данных и указание будущих потребностей. Биотехнологические достижения 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Selenium, микроэлемент, который модулирует сердечно -сосудистые здоровья с помощью окислительно -восстановительной фермеры. Питательные вещества 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Регуляция PGC-1α, узлового регулятора митохондриального биогенеза. Американский журнал клинического питания 93 (4): 884S-890S.
- Helgerud, J. et al. (2007). Аэробные высокоинтенсивные интервалы улучшают VO2MAX больше, чем умеренные тренировки. Медицина и наука в спорте и упражнениях 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Аналогичные метаболические адаптации во время упражнений после малого объема интервала спринта и традиционные тренировки на выносливость у людей. Журнал физиологии 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Дифференциальные эффекты устойчивости и упражнений на выносливость в состоянии ФРС на фосфорилирование сигнальной молекулы и синтез белка в мышцах человека. Журнал физиологии 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Тренировка с устойчивости изменяет функцию митохондрий в скелетных мышцах человека. Медицина и наука в спорте и упражнениях 47 (9): 1922-1931.
- Баар, К. (2006). Обучение для выносливости и силы: уроки передачи сигналов клеток. Медицина и наука в спорте и упражнениях 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Пути митофагии для контроля качества и очистки митохондрий. Гибель и дифференциация клеток 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Митохондрии и ось смерти с аутофагией -инфламцией - клетчаткой при старении организма. Наука 333 (6046): 1109-1112.
- Мишра, Э. и Такур, М. (2023). Митофагия: многообещающая терапевтическая мишень для нейропротекции во время старения и возрастных заболеваний. Британский журнал фармакологии 180 (12): 1542-1561.
- Cantó, C. & Auwerx, J. (2011). Ограничение калорий: AMPK является ключевым датчиком и эффектором? Физиология 26 (4): 214-224.
- UM, J. et al. (2010). AMP-активированные мыши, дефицитные протеинкиназы, устойчивы к метаболическим эффектам ресвератрола. Диабет 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Антижирующие свойства антиоксиданта, полученного из винограда, регулируются митохондриальным балансом слияния и деления, что приводит к митофагии, вызванной сигнальной сетью SIRT1-Sirt3-FoxO3-PINK1-Паркин. Окислительная медицина и клеточная долголетие 2014: 345105.
- Longo, V. & Panda, S. (2016). Пост, циркадные ритмы и ограниченное по времени кормление при здоровой жизни. Клеточный метаболизм 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I & Sahebkar, A. (2020). Влияние настенного или калорийного ограничения на индукцию митофагии: обзор литературы. Журнал кахексии, саркопения и мышц 11 (6): 1447-1458.
- Вей, Ю. и Ли, Х. (2002). Окислительный стресс, митохондриальная ДНК -мутация и нарушение антиоксидантных ферментов при старении. Экспериментальная биология и лекарствоE 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). Мутации мтДНК и их роль в старении, заболеваниях и криминалистических науках. Старение и болезнь 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Генерация реактивных форм кислорода митохондриями. Антиоксиданты 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Реактивные формы кислорода и митохондрии: связь клеточного гомеостаза. Окислительно -восстановительная биология 6: 472-485.
- Correia -Melo, C. et al. (2016). Митохондрии необходимы для пропорциональных особенностей стареющего фенотипа. Embo Journal 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Митохондриальные белки слияния и деления в качестве новых терапевтических мишеней для лечения сердечно -сосудистых заболеваний. Европейский журнал фармакологии 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Митофагия: новая роль в стареющих и возрастных заболеваниях. Границы в клеточной биологии и развитии 8: 200.