Mitocôndrias são organelos vitais localizados no citoplasma das células eucarióticas. Com o bom funcionamento das mitocôndrias, todos os processos do corpo, desde o movimento e o exercício até à digestão e à recuperação, funcionam melhor. Desempenham um papel essencial na produção de energia e em muitos outros processos celulares. As mitocôndrias oferecem o local para a fosforilação oxidativa, que produz ATP, a principal fonte de energia da célula. Estruturalmente, as mitocôndrias podem ser avaliadas através de uma membrana externa e de uma membrana interna altamente dobrada que forma os compartimentos necessários para o seu metabolismo. Para além da produção de energia, as mitocôndrias desempenham outras actividades, como a sinalização de cálcio e a regulação do metabolismo celular, para além da apoptose (morte programada), o que as torna vitais para a manutenção da homeostasia celular.
Os fundamentos da função mitocondrial
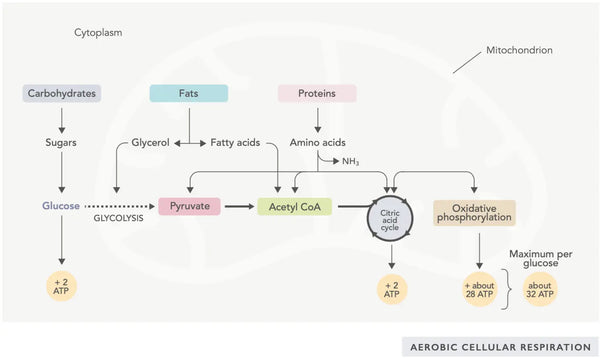
A produção de ATP (a principal molécula de energia utilizada pelas células) é a caraterística fundamental da atividade mitocondrial. Este processo ocorre através de duas vias bioquímicas principais: o ciclo do ácido cítrico (ciclo TCA ou ciclo de Krebs) e a cadeia de transporte de electrões (ETC).
Ciclo do ácido cítrico
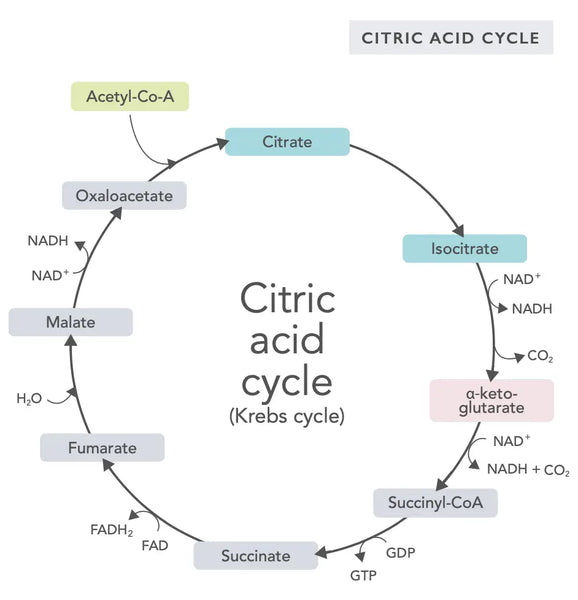
O ciclo do ácido cítrico, ou ciclo de Krebs (nomeado em homenagem ao vencedor do prémio Nobel Hans Adolf Krebs, que o descobriu), ocorre nas mitocôndrias celulares.(1)O principal composto metabólico do ciclo do ácido cítrico é o ácido acético (acetil coenzima A) produzido a partir de ácidos gordos, hidratos de carbono e proteínas.(2)
As várias reacções do ciclo do ácido cítrico (ver imagem) formam iões de hidrogénio e electrões que são depois transferidos para a membrana mitocondrial interna para a fosforilação oxidativa (ligação de energia a moléculas de ATP através da oxidação) e para a cadeia de transporte de electrões. A reação liberta NADH e pequenas quantidades de ATP e dióxido de carbono.
O ciclo do ácido cítrico envolve dez etapas, cada uma delas afetada pelas vitaminas B, por determinados minerais como o magnésio e o ferro e pelo principal antioxidante do fígado, o glutatião. As reacções são inibidas por metais pesados como o mercúrio, o arsénio e o alumínio.
As moléculas de NADH, ricas em energia, captam a maior parte da energia gerada durante o ciclo do ácido cítrico. Por cada molécula de acetil-coenzima A, são geradas três moléculas de NADH, que são depois utilizadas como energia na reação seguinte (fosforilação oxidativa).
A regulação do ciclo do ácido cítrico é determinada pela disponibilidade de vários aminoácidos e pela inibição por retroação (por exemplo, se for produzido demasiado NADH, várias enzimas do ciclo do ácido cítrico são inibidas, abrandando as reacções).
Oxaloacetato é um composto que responde a uma necessidade súbita de produzir energia (por exemplo, no cérebro ou nos músculos). A toma de um suplemento de oxaloacetato pode ser útil, podendo mesmo potenciar a regeneração das mitocôndrias no cérebro, reduzir a inflamação silenciosa no organismo e aumentar o número de células nervosas.(3)
Simplificando, o corpo incorpora sistemas engenhosos que convertem os alimentos consumidos em electrões, utilizados como energia para várias necessidades.
Fosforilação oxidativa
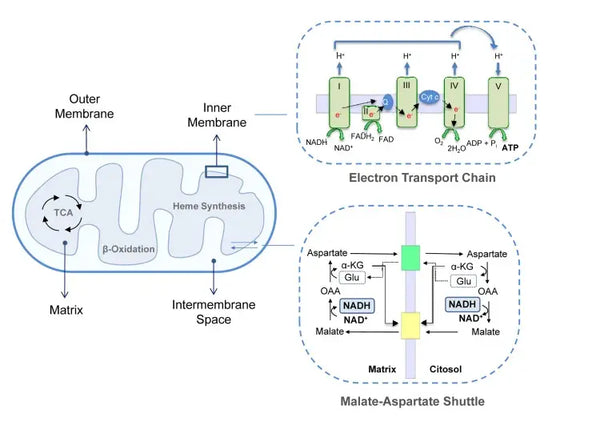
A fosforilação oxidativa é constituída pela cadeia de transporte de electrões e pela ATP sintase. A fosforilação oxidativa produz a maior parte da energia gerada em condições aeróbicas (ATP). É uma continuação do ciclo do ácido cítrico.
Na cadeia de transporte de electrões, os iões de hidrogénio (H+) são libertados no espaço intermembranar mitocondrial. Os iões de hidrogénio libertados do espaço intermembranar voltam a entrar na mitocôndria através da ATP sintase. Utilizando a energia libertada no processo, a ATP sintase converte o ADP utilizado como energia em ATP novamente.
A ubiquinona (coenzima Q10) contribui para a cadeia de transporte de electrões. É utilizada há décadas como suplemento alimentar. Níveis baixos de ubiquinona celular podem ser um fator predisponente para várias doenças devido a uma produção insuficiente de energia aeróbica nas células. Além disso, a utilização de medicamentos para o colesterol (estatinas) é um fator que contribui para a deficiência de ubiquinona.(4)
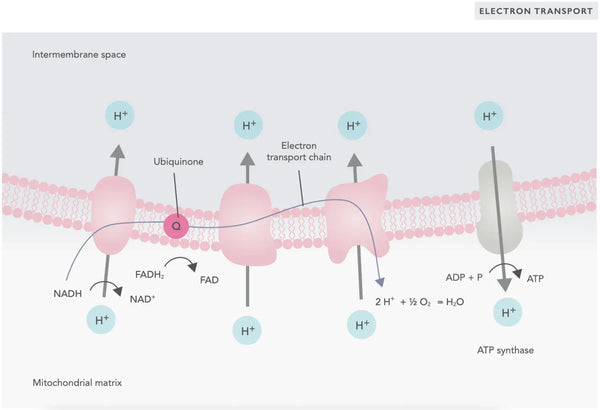
Este conjunto coordenado de reacções gera ATP e estabelece um gradiente de protões através da membrana mitocondrial interna, um processo conhecido como quimiosmose. A energia armazenada neste gradiente impulsiona a síntese de ATP, ligando o fluxo de electrões através da CTE à geração de energia celular.(5)
Factores que influenciam a eficiência mitocondrial
A eficiência mitocondrial, que é obviamente vital para uma função celular óptima, é influenciada por vários factores. Abaixo estão descritos os mais importantes.
Composição genética
As mitocôndrias possuem um ADN separado e individual (ADN mitocondrial, ADNmt) distinto do ADN nuclear. O ADNmt codifica componentes essenciais da cadeia de transporte de electrões e proteínas mitocondriais. As mutações no mtDNA podem levar a proteínas disfuncionais, perturbando a cadeia de transporte de electrões e a síntese de ATP. Estas podem resultar na redução da produção de energia e no aumento da produção de espécies reactivas de oxigénio (ROS), contribuindo para a disfunção mitocondrial e celular.(6)
Stress oxidativo
As mitocôndrias são uma fonte significativa de ERO, que são subprodutos do metabolismo do oxigénio. Embora níveis baixos de ERO funcionem na sinalização celular, o excesso de ERO pode causar danos oxidativos nas proteínas mitocondriais, nos lípidos e no ADN. Este stress oxidativo compromete a integridade e a função mitocondrial, inibindo a produção de ATP e conduzindo a uma maior produção de ROS num ciclo deletério. As defesas antioxidantes, incluindo a superóxido dismutase e a glutationa peroxidase, desempenham um papel fundamental na atenuação destes danos.(7-8)
Disponibilidade de nutrientes
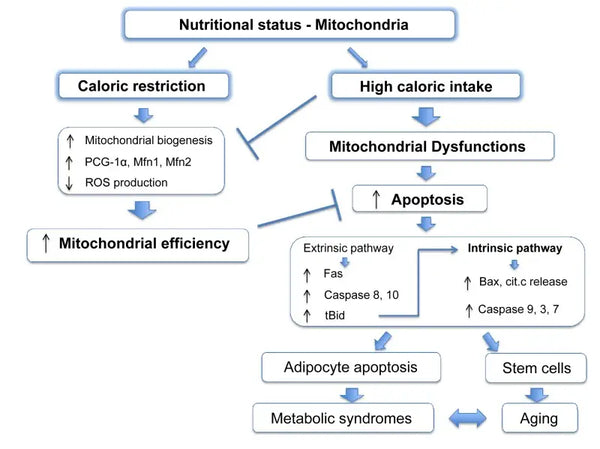
As mitocôndrias necessitam de substratos específicos para a produção de energia. A glicose e os ácidos gordos são fontes primárias para a produção de ATP através da glicólise e da β-oxidação, respetivamente. A disponibilidade destes substratos tem um impacto direto na função mitocondrial. Por exemplo, em condições de excesso de nutrientes, como uma elevada disponibilidade de glucose, as mitocôndrias podem produzir quantidades excessivas de ATP e ROS, conduzindo potencialmente a perturbações metabólicas.(9-10)
Pelo contrário, a escassez de nutrientes pode limitar a produção de energia mitocondrial, afectando a função e a sobrevivência das células. Contrariamente a alguns relatos de estudos em animais sobre os benefícios da restrição calórica na biogénese mitocondrial, parece que esta não aumenta a biogénese mitocondrial. No entanto, preserva a função mitocondrial, protegendo a integridade e a função dos componentes celulares existentes.(11-12)
Factores de estilo de vida
Exercício físico
A atividade física influencia a quantidade e a qualidade das mitocôndrias. O exercício estimula a biogénese mitocondrial, levando a um aumento da densidade mitocondrial e da eficiência na produção de energia.(13) Especialmente o treino de resistência aumenta a capacidade oxidativa das mitocôndrias, melhorando a sua capacidade de utilizar o oxigénio para a produção de ATP (leia mais em detalhe mais à frente neste artigo).
Dieta
Os componentes da dieta afectam significativamente a função mitocondrial. Os rácios de macronutrientes, a ingestão calórica e os nutrientes específicos (como os antioxidantes, as vitaminas e os minerais) influenciam o metabolismo mitocondrial. As dietas ricas em nutrientes que apoiam a função mitocondrial podem aumentar a produção de energia e reduzir o stress oxidativo (ver mais adiante). Ativação cetose pode também aumentar a biogénese mitocondrial e melhorar a eficiência mitocondrial.(14-15)
Factores ambientais
A exposição a factores de stress ambiental, como toxinas, poluentes, metais pesados (por exemplo, chumbo, mercúrio, arsénico e cádmio) e radiação, pode afetar negativamente a função mitocondrial. Estes factores de stress podem induzir danos oxidativos, perturbar a atividade da cadeia de transporte de electrões e prejudicar a dinâmica mitocondrial, incluindo os processos de fusão e fissão.(16)
Intervenções tecnológicas
Fotobiomodulação (ou terapia da luz vermelha)
Fotobiomodulação é a utilização de energia fotónica não ionizante para desencadear alterações fotoquímicas nas estruturas celulares que são receptivas aos fotões, particularmente nas mitocôndrias. Acredita-se que a luz vermelha e a terapia com luz NIR actuam principalmente através de foto-receptores. As ondas de luz vermelha penetram na pele e atingem as mitocôndrias das células, aumentando a sua produção de energia. Vários eventos levam a este facto, por exemplo, a aceleração da respiração mitocondrial através da citocromo c oxidase.(17) Leia sobre os benefícios da fotobiomodulação para a saúde aqui.
Sauna de infravermelhos
As saunas de infravermelhos utilizam radiação infravermelha, que aquece diretamente os tecidos do corpo em vez do ar. A frequência da radiação emitida pelas saunas de infravermelhos é de 3-12 μm, que se enquadra no infravermelho distante (FIR). Verificou-se que a luz infravermelha distante tem efeitos ao nível dos tecidos, particularmente na cadeia respiratória das mitocôndrias no processo de produção de energia celular e no fornecimento de sangue aos tecidos, dilatando os vasos sanguíneos e melhorando a circulação.(18)
Terapia de Campo Eletromagnético Pulsado (PEMF)
A terapia PEMF utiliza campos electromagnéticos para promover vários processos fisiológicos. A investigação sugere que a PEMF pode melhorar a função mitocondrial, aumentando o consumo de oxigénio celular e melhorando a produção de ATP. A terapia PEMF afecta diretamente as mitocôndrias, devolvendo às células um estado energético e de carga eléctrica mais saudável.(19-20) Leia o guia completo sobre a terapia PEMF aqui.
Terapia hiperbárica de oxigénio (HBOT)
A OTH envolve a respiração de oxigénio puro num ambiente pressurizado. Está clinicamente provado que a oxigenoterapia hiperbárica revitaliza as mitocôndrias e aumenta a formação de ATP, fornecendo quantidades suprafisiológicas de oxigénio necessárias para a respiração celular. Um estudo recente relatou que a HBO aumentou a biogénese das mitocôndrias e a autofagia, aumentando parcialmente a produção de espécies reactivas de oxigénio. Este processo produziu novas mitocôndrias saudáveis e as antigas mitocôndrias disfuncionais foram destruídas. Este estudo também constatou um aumento da ativação da transcrição e da replicação do ADN das mitocôndrias.(21-22) Saiba mais sobre a HBOT aqui.
Suporte nutricional e suplementar para a função mitocondrial
O papel da nutrição na manutenção da saúde mitocondrial é fundamental, sendo que determinados nutrientes são particularmente cruciais para uma função mitocondrial óptima. Estes incluem os seguintes listados abaixo.
- Coenzima Q10 (CoQ10): A ubiquinona é solúvel em gordura e assemelha-se a uma vitamina. A ubiquinona funciona como um transportador de electrões na cadeia de transferência de electrões nas mitocôndrias (ver figura à direita) e promove a secreção de ATP. Os níveis de ubiquinona diminuem em vários tecidos com o envelhecimento.(23)
- Magnésio: Envolvido na síntese de ATP e crucial para manter a integridade e a função mitocondrial.(24)
- Vitaminas B: Incluindo B1 (tiamina), B2 (riboflavina), B3 (niacina), B5 (ácido pantoténico), B6, B7 (biotina) e B12. Estas vitaminas B são cruciais para vários aspectos do metabolismo energético mitocondrial.(25)
- Ácido alfa-lipóico: O ALA é um poderoso antioxidante que também ajuda a regenerar outros antioxidantes. Tem um papel no metabolismo energético e pode melhorar a função mitocondrial.(26)
- Carnitina (especificamente Acetil-L-Carnitina): Transporta ácidos gordos para as mitocôndrias para a beta-oxidação, que é crucial para a produção de energia, particularmente nas células musculares.(27)
- Creatina: A creatina é um composto naturalmente presente no organismo que ajuda a fornecer energia às células, nomeadamente às células musculares, aumentando a formação de trifosfato de adenosina (ATP). A suplementação com creatina pode aumentar a eficiência mitocondrial, particularmente em exercícios de alta intensidade.(28)
- Pirroloquinolina Quinona (PQQ): A PQQ é um antioxidante que aumenta a biogénese mitocondrial através do conteúdo da proteína PGC-1 e apoia a função mitocondrial.(29)
- Ácidos gordos ómega 3 (EPA e DHA): Os ómega 3 são essenciais para manter a fluidez e a função da membrana mitocondrial. Encontram-se principalmente no óleo de peixe e nos peixes gordos.(30)
- Ribosídeo de nicotinamida (NR) e Mononucleótido de nicotinamida (NMN): Estes precursores de NAD+ são essenciais para a função mitocondrial e a produção de energia. A toma de suplementos com NR ou NMN pode ajudar a aumentar os níveis de NAD+ e, assim, melhorar a eficiência mitocondrial.(31) Leia mais sobre a otimização do NAD+ aqui.
- Curcumina: A curcumina é o composto ativo do açafrão-da-terra. Foi demonstrado que protege as mitocôndrias dos danos oxidativos e melhora a sua função.(32)
- Selénio: Um oligoelemento essencial que desempenha um papel na proteção das mitocôndrias contra o stress oxidativo. O selénio regula igualmente a biogénese mitocondrial.(33)
O exercício e a biogénese mitocondrial
A atividade física regular é um fator crítico para promover a biogénese mitocondrial, que leva à criação de novas mitocôndrias, aumentando assim a sua quantidade e capacidade funcional nas células. Diferentes formas de exercício físico exercem efeitos distintos na dinâmica mitocondrial. As duas formas mais importantes de exercício são o treino aeróbico e o treino de resistência.
Exercício aeróbico
A densidade mitocondrial nas células musculares esqueléticas aumenta visivelmente durante o exercício aeróbico (por exemplo, corrida, ciclismo e natação).
A biogénese mitocondrial é regulada pela PGC-1α (coactivador 1-alfa do recetor gama ativado por proliferador de peroxissoma), uma proteína reguladora essencial, cuja expressão o exercício aeróbico estimula. A PGC-1α co-ativa os fatores respiratórios nucleares (NRFs) e o fator de transcrição mitocondrial A (TFAM), necessários para transcrever o mtDNA e replicar as mitocôndrias. Isto leva a um aumento da eficiência da fosforilação oxidativa, a uma melhor resistência e a uma maior produção de ATP nas células musculares.(34)
O treino intervalado de alta intensidade (HIIT) é particularmente eficaz para aumentar o número de mitocôndrias e o consumo máximo de oxigénio (VO2max).(35-36)
Treino de resistência
A função e a eficiência mitocondriais são os principais objectivos do treino de resistência (por exemplo, levantamento de pesos e exercícios de peso corporal). Desencadeia alterações na síntese proteica mitocondrial, melhorando a qualidade e a eficácia das mitocôndrias actuais. O treino de força também aumenta a produção de enzimas nas cadeias de transporte de electrões e no ciclo de Krebs, melhorando ainda mais a capacidade das células para a síntese de ATP. Pode também aumentar o número e o tamanho das mitocôndrias nas células musculares, embora não no mesmo grau que o exercício aeróbico.(37-38)
O efeito combinado destas modalidades de exercício na biogénese e função mitocondriais realça a importância da atividade física na manutenção e melhoria da saúde mitocondrial. A prática regular de treino aeróbico e de resistência melhora de forma abrangente a densidade mitocondrial, a eficiência e o metabolismo energético das células. Estas adaptações são cruciais para o desempenho atlético e são significativas na manutenção da saúde, na prevenção de doenças e na gestão de condições associadas à disfunção mitocondrial.
No entanto, é de notar que o treino simultâneo de força e de resistência conduz a uma menor adaptação, uma vez que as proteínas quinases PKB e AMPK bloqueiam a sinalização a jusante uma da outra, impedindo o efeito do treino simultâneo.(39)
Mitofagia e saúde celular
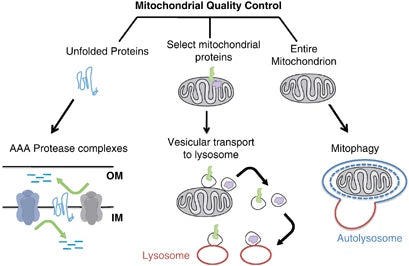
A mitofagia refere-se a um tipo seletivo de autofagia que desempenha um papel essencial nas condições celulares, sendo capaz de degradar apenas as mitocôndrias danificadas ou não funcionais. Este mecanismo é crucial para a saúde das mitocôndrias e de uma célula, impedindo a acumulação de ARNm que codificam a montagem de subunidades defeituosas, evitando assim novas crises nas funções celulares e numerosas patologias.(40)
A eliminação das mitocôndrias danificadas através da mitofagia ajuda a reduzir o stress oxidativo, a apoptose e a inflamação (associados a várias patologias). A deficiência da mitofagia facilita a acumulação de mitocôndrias disfuncionais na patogénese das doenças neurodegenerativas, como as doenças de Parkinson e de Alzheimer. Do mesmo modo, nos distúrbios metabólicos, a perda de mitofagia leva a alterações do metabolismo mitocondrial, resultando em resistência à insulina e diabetes de tipo 2.(41-42)
Foi demonstrado que a restrição calórica promove a mitofagia. Isto deve-se, em parte, à ativação das sirtuínas (SIRT1), da proteína quinase activada por AMP (AMPK) e do fator de transcrição EB, que apoiam tanto a resposta celular à crise energética como o início da mitofagia. Especificamente, as sirtuínas regulam a função dos factores da maquinaria da mitofagia, silenciando as mitocôndrias danificadas.(43)
Os efeitos moleculares da restrição calórica são imitados por compostos como o resveratrol (um polifenol presente no vinho tinto e em algumas bagas) e muitos outros polifenóis. O resveratrol promove a ativação da SIRT1 e da AMPK, aumentando a mitofagia responsável pela melhoria da função das mitocôndrias e pelo restabelecimento da saúde celular.(44-45)
A mitofagia pode ser melhorada com o jejum intermitente. Esta melhoria é provavelmente atenuada pela mudança metabólica da energia baseada na glucose para a energia baseada na cetona durante o jejum e esta mudança desencadeia a mitofagia.46-47)
Disfunção mitocondrial como uma marca registrada do envelhecimento
A compreensão da forma como as mitocôndrias contribuem para o processo de envelhecimento está no centro da investigação em gerontologia e biologia celular. À medida que os organismos envelhecem, a disfunção mitocondrial torna-se mais comum, o que desempenha um papel no lado fisiológico do envelhecimento.
As mitocôndrias envelhecidas apresentam uma diminuição da produção de ATP, o que afecta os processos energéticos necessários ao bem-estar celular. Para além disso, as alterações estruturais das mitocôndrias associadas à idade interferem ainda mais com esta diminuição da produção energética, como a composição anormal do potencial da membrana mitocondrial e a integridade da parede interna das mitocôndrias.(48)
A posição da DNA mitocondrial (mtDNA) perto da cadeia de transporte de electrões, onde ocorrem as espécies reactivas de oxigénio, tem impacto na sua vulnerabilidade à mutação. No entanto, as mutações acumulam-se com o tempo, resultando em disfunção mitocondrial. Ao contrário do ADN nuclear, que se encontra ligado a histonas para proteção e dispõe de uma variedade de mecanismos de reparação, o ADNmt não possui um revestimento protetor de histonas e não dispõe de uma vasta gama de métodos de reparação, pelo que pode ser facilmente danificado.(49)
Nas células, as mitocôndrias produzem espécies reactivas de oxigénio (ROS). Embora as ERO sejam um meio essencial para a célula comunicar com o seu ambiente e se ajustar a ele, a produção de níveis elevados destas moléculas é limitada por um controlo rigoroso. A produção excessiva em várias condições relacionadas com a idade resulta em células que sofrem de stress oxidativo. Este destrói diferentes componentes celulares, sejam eles proteínas, lípidos ou ADN. As mitocôndrias são mesmo o principal destinatário dos danos oxidativos, criando um círculo vicioso, uma vez que as mitocôndrias danificadas apenas geram mais ERO, aumentando assim o stress celular. senescência.(50-52)
A dinâmica mitocondrial é crucial para a função mitocondrial que ajuda a manter o processo de fusão e fissão. No entanto, esta dinâmica é perturbada com o envelhecimento e as mitocôndrias sofrem fragmentação em vez de fusão. Estas alterações afectam a função das mitocôndrias e a sua posição nas células.(53)
A perda da função mitocondrial não é um fenómeno passivo relacionado com o envelhecimento, mas um participante ativo na patogénese das doenças dependentes da idade. A disfunção mitocondrial tem sido associada a doenças como as doenças neurodegenerativas, as doenças cardiovasculares e as perturbações metabólicas. Nestas doenças, a produção de energia reduzida ou defeituosa, o aumento do stress oxidativo e a incapacidade de eliminar as mitocôndrias danificadas são essenciais para a patogénese e a evolução da doença.(54)
Conclusão
A otimização da saúde mitocondrial e do seu declínio com o envelhecimento é uma tarefa difícil, mas felizmente há muito que podemos fazer. As principais intervenções envolvem o apoio nutricional de substratos críticos para a regeneração, incluindo a Coenzima Q10, o magnésio e as vitaminas B; a participação regular em diversas disciplinas de exercício para aumentar a biogénese mitocondrial; e modificações do estilo de vida, como a restrição calórica ou o jejum intermitente, para influenciar os mecanismos de mitofagia.
O reconhecimento da disfunção mitocondrial como um dos factores envolvidos no envelhecimento torna estas estratégias essenciais para apoiar a saúde celular e lutar contra a degradação relacionada com o envelhecimento. As abordagens integrativas que utilizam o poder do conhecimento científico em combinação com alterações aplicáveis ao estilo de vida podem criar condições favoráveis para a prevenção e o abrandamento do desgaste mitocondrial que, de um modo geral, servem o bem-estar e a longevidade do indivíduo.
Referências científicas
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900-81), pioneiro da medicina moderna, arquiteto do metabolismo intermediário. Jornal de Biografia Médica 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biochemistry. 5ª edição. Capítulo 17, O Ciclo do Ácido Cítrico. New York: W. H. Freeman.
- Wilkins, H. et al. (2014). O oxaloacetato ativa a biogênese mitocondrial do cérebro, melhora a via da insulina, reduz a inflamação e estimula a neurogênese. Genética Molecular Humana 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Deficiência primária e secundária de coenzima Q10: o papel da suplementação terapêutica. Revisões de Nutrição 71 (3): 180–188. Revisão.
- Saraste, M. (1999). Oxidative phosphorylation at the fin de siecle. Science 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). TRNAs mitocondriais humanos: biogénese, função, aspectos estruturais e doenças. Revisão Anual de Genética 45: 299–329.
- Zhang, Y. & Wong, H. (2021). As mitocôndrias são o principal contribuinte de espécies reativas de oxigênio nas células? Jornal de Biologia Experimental 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Espécies reactivas de oxigénio na sinalização celular. American Journal of Physiology-Lung Cellular and Molecular Physiology 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Mecanismos de produção de bioenergia em mitocôndrias. Mitocôndrias e seu papel na doença cardiovascular 99–121.
- Bottje, W. (2019). Metabolismo oxidativo e eficiência: o delicado ato de equilíbrio das mitocôndrias. Ciência das aves de capoeira 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). A disponibilidade de nutrientes liga as mitocôndrias, a apoptose e a obesidade. Envelhecimento (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). A restrição calórica crónica preserva a função mitocondrial na senescência sem aumentar a biogénese mitocondrial. Metabolismo celular 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Mecanismos moleculares para adaptação mitocondrial ao treinamento físico no músculo esquelético. O Jornal FASEB 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Regulação da biogénese mitocondrial. Ensaios em Bioquímica 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Terapia metabólica baseada em cetona: o aumento de NAD + é um mecanismo primário? Fronteiras em Neurociência Molecular 10: 377.
- Fowler, B. (1978). General subcellular effects of lead, mercury, cadmium, and arsenic. Perspectivas de Saúde Ambiental 22:37-41.
- Hamblin, M. (2018). Mecanismos e sinalização redox mitocondrial na fotobiomodulação. Fotoquímica e Fotobiologia 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Radiação infravermelha distante (FIR): seus efeitos biológicos e aplicações médicas. Fotónica e Lasers em Medicina 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). A estimulação eletromagnética aumenta a função mitocondrial em células osteogênicas e promove o reparo de fraturas ósseas. Relatórios Científicos 11 (1): 19114.
- Tai, Y. et al. (2020). Os campos magnéticos modulam o metabolismo e o microbioma intestinal em correlação com a expressão de Pgc-1 alfa: Acompanhamento de um estudo mito-hormético magnético in vitro. O Jornal FASEB 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). O efeito do oxigênio hiperbárico no metabolismo energético mitocondrial e glicolítico: o conceito de caloristase. Stress celular e chaperones 25 (4): 667-677.
- Chen, W. et al. (2020). O oxigênio hiperbárico protege contra a lesão de isquemia-reperfusão do miocárdio por meio da inibição da disfunção mitocondrial e da autofagia. Relatórios de Medicina Molecular 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). A complexidade de fazer ubiquinona. Tendências em Endocrinologia e Metabolismo 30 (12): 929-943.
- Volpe, S. (2013). O magnésio na prevenção de doenças e na saúde geral. Avanços em Nutrição 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O'Brien, P. (2006). Mitochondrial function and toxicity: role of the B vitamin family on mitochondrial energy metabolism. Interações químico-biológicas 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Metabolismo do ácido lipóico e regulação redox mitocondrial. Jornal de Química Biológica 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Carnitina na bioenergética muscular humana: a suplementação de carnitina pode melhorar o exercício físico? Moléculas 25 (1): 182.
- Wax, B. et al. (2021). Creatina para exercício e desempenho desportivo, com considerações de recuperação para populações saudáveis. Nutrientes 13 (6): 1915.
- Hwang, P. et al. (2020). Efeitos da suplementação com pirroloquinolina quinona (PQQ) no desempenho do exercício aeróbico e índices de biogénese mitocondrial em homens não treinados. Jornal do Colégio Americano de Nutrição 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Influenciando a composição da membrana mitocondrial e a bioenergética através da suplementação de ómega-3. O Jornal de Fisiologia 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). O ribosídeo de nicotinamida aumenta o metaboloma NAD + do músculo esquelético humano envelhecido e induz assinaturas transcriptômicas e antiinflamatórias. Relatórios de células 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Curcumina, biogénese mitocondrial e mitofagia: Explorando dados recentes e indicando necessidades futuras. Avanços em Biotecnologia 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Selênio, um micronutriente que modula a saúde cardiovascular via enzimologia redox. Nutrientes 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Regulação de PGC-1α, um regulador nodal da biogênese mitocondrial. O Jornal Americano de Nutrição Clínica 93 (4): 884S-890S.
- Helgerud, J. et al. (2007). Os intervalos aeróbicos de alta intensidade melhoram o VO2max mais do que o treino moderado. Medicina e Ciência no Desporto e Exercício 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Adaptações metabólicas semelhantes durante o exercício após treino intervalado de sprint de baixo volume e treino tradicional de resistência em humanos. Jornal de Fisiologia 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Differential effects of resistance and endurance exercise in the fed state on signalling molecule phosphorylation and protein synthesis in human muscle. O Jornal de Fisiologia 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). O treinamento com exercícios de resistência altera a função mitocondrial no músculo esquelético humano. Medicina e Ciência no Desporto e Exercício 47 (9): 1922-1931.
- Baar, K. (2006). Treino para resistência e força: lições da sinalização celular. Medicina e Ciência no Desporto e no Exercício 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). As vias de mitofagia para controle de qualidade e eliminação de mitocôndrias. Morte celular e diferenciação 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitocôndrias e o eixo autofagia-inflamação-morte celular no envelhecimento do organismo. Science 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitophagy: Um alvo terapêutico promissor para a neuroprotecção durante o envelhecimento e doenças relacionadas com a idade. Jornal Britânico de Farmacologia 180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Restrição calórica: a AMPK é um sensor e efetor chave? Physiology 26 (4): 214-224.
- Um, J. et al. (2010). Os ratinhos deficientes em proteína quinase activada por AMP são resistentes aos efeitos metabólicos do resveratrol. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). As propriedades antienvelhecimento de um antioxidante derivado da uva são reguladas pelo equilíbrio mitocondrial de fusão e fissão, levando à mitofagia desencadeada por uma rede de sinalização de Sirt1-Sirt3-Foxo3-PINK1-PARKIN. Medicina Oxidativa e Longevidade Celular 2014: 345105.
- Longo, V. & Panda, S. (2016). Jejum, ritmos circadianos e alimentação com restrição de tempo na vida saudável. Metabolismo celular 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I & Sahebkar, A. (2020). O efeito do jejum ou restrição calórica na indução de mitofagia: uma revisão da literatura. Jornal de Caquexia, Sarcopenia e Músculo 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Oxidative stress, mitochondrial DNA mutation, and impairment of antioxidant enzymes in aging. Experimental Biology and Medicine 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). Mutações no mtDNA e o seu papel no envelhecimento, doenças e ciências forenses. Envelhecimento e Doença 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Geração de espécies reativas de oxigênio por mitocôndrias. Antioxidantes 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Espécies reativas de oxigênio e mitocôndrias: Um nexo de homeostase celular. Biologia Redox 6: 472-485.
- Correia-Melo, C. et al. (2016). As mitocôndrias são necessárias para caraterísticas pró-envelhecimento do fenótipo senescente. Jornal EMBO 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Fusão mitocondrial e proteínas de fissão como novos alvos terapêuticos para o tratamento de doenças cardiovasculares. Jornal Europeu de Farmacologia 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitofagia: um papel emergente no envelhecimento e nas doenças associadas à idade. Fronteiras em Biologia Celular e do Desenvolvimento 8: 200.