O estudo da resiliência através da lente da genética é um campo de interesse em expansão, que se cruza frequentemente com as disciplinas da psicologia, neurobiologia e genómica. Embora o conceito de resiliência - a capacidade de recuperar ou de se adaptar à adversidade ou ao stress - seja multifacetado e influenciado por uma interação complexa de factores genéticos, ambientais e psicológicos, foram desenvolvidos testes de ADN específicos para esclarecer os componentes genéticos desta caraterística.
Introdução
Os genes são segmentos de ADN que contêm as instruções de que o organismo necessita para produzir cada um dos muitos milhares de proteínas necessárias à vida. Cada gene é composto por milhares de combinações de "letras" (chamadas bases) que constituem o seu código genético. O código dá as instruções para produzir as proteínas necessárias para o desenvolvimento e funcionamento corretos.(1)
As variações genéticas podem afetar a expressão de um gene, afectando assim os processos metabólicos que são importantes para manter a saúde celular e a forma como respondemos a intervenções ambientais como a dieta, o estilo de vida, os suplementos e a medicação.
O conhecimento destas variações genéticas oferece uma visão sem paralelo dos sistemas biológicos, permitindo aos profissionais de saúde recomendar intervenções precisas destinadas a ajudar a atingir os objectivos de cada um e a obter uma saúde óptima.
Compreender os marcadores genéticos de resiliência
Resiliência-a capacidade de recuperar ou de se adaptar facilmente à adversidade ou à mudança-é cada vez mais vista através da genética. Ao examinarem os marcadores genéticos, os investigadores e os médicos pretendem descobrir os fundamentos biológicos que podem explicar por que razão alguns indivíduos recuperam do stress e do trauma mais eficazmente do que outros.(2) Este campo de investigação em expansão tem-se centrado em testes de ADN relacionados com a resiliência que examinam marcadores genéticos potencialmente responsáveis pelas diferenças nas respostas individuais ao stress.
No centro desta investigação estão os sistemas endócrino e nervoso (o sistema nervoso autónomo, em particular), centrais na resposta do organismo ao stress. O eixo hipotálamo-pituitária-adrenal (HPA), em particular, é uma área de foco central, uma vez que desempenha um papel crítico na regulação do mecanismo de resposta do organismo ao stress. Esta complexa rede de interações entre o hipotálamo, a glândula pituitária e as glândulas supra-renais orquestra a produção e a regulação das principais hormonas do stress, como o cortisol.
Cortisol tem efeitos de longo alcance em muitas funções corporais e é libertado em resposta ao stress e à baixa concentração de glicose no sangue. Em circunstâncias normais, o cortisol ajuda a restaurar a homeostase após acontecimentos stressantes. No entanto, as variações genéticas que afectam o eixo HPA podem levar a diferenças na forma como o cortisol é produzido, regulado e eliminado do organismo. Estas variações genéticas podem influenciar a resiliência fisiológica de um indivíduo - a sua capacidade de manter ou regressar rapidamente à saúde psicológica e física após uma situação difícil.(3)
Testes de ADN para a resiliência investigam as variantes genéticas associadas aos receptores das hormonas do stress, às proteínas envolvidas nas vias das hormonas do stress e às enzimas que metabolizam estas hormonas. Por exemplo, uma variante do gene FKBP5, que está envolvido na regulação da sensibilidade do recetor de glucocorticóides através do qual o cortisol exerce os seus efeitos, pode modificar a resposta de um indivíduo ao stress e, potencialmente, a sua suscetibilidade a perturbações relacionadas com o stress. Alargando ainda mais o âmbito de aplicação, os genes que codificam os neurotransmissores - os mensageiros químicos do cérebro que contribuem para a regulação do humor e da cognição - estão também a ser objeto de atenção. Estes incluem genes como o COMT, que é fundamental para a degradação da dopamina, um neurotransmissor associado aos sistemas de prazer e recompensa.(4)
Para além disso, inflamação é um processo biológico que tem estado intimamente ligado ao stress e às perturbações do humor. A inflamação crónica, que pode ser influenciada por variações genéticas, pode afetar a função cerebral e o comportamento.(5) Assim, os testes genéticos podem também procurar identificar variantes nos genes das citocinas pró-inflamatórias, como a IL-6 e o TNF, que podem predispor os indivíduos a respostas inflamatórias prolongadas e afetar a sua resiliência mental.
A compreensão destes marcadores genéticos é a pedra angular das intervenções personalizadas. Ao identificar as predisposições genéticas, os indivíduos podem tomar medidas proactivas para reforçar a sua resiliência através de modificações no estilo de vida, estratégias psicológicas e tratamentos médicos adaptados à sua constituição genética única. Esta abordagem exemplifica a mudança para a medicina de precisão, onde o modelo de tamanho único dá lugar a cuidados mais individualizados.
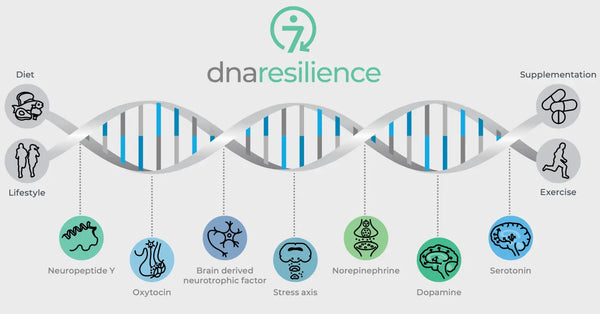
Imagem: As sete vias moleculares da resiliência.
Tipos de testes de ADN para a resiliência
1) Genes de resposta ao stress
Os genes de resposta ao stress são componentes críticos do sistema do nosso corpo para gerir e responder a factores de stress. Codificam proteínas que regulam vários processos fisiológicos, incluindo a libertação e a ação do cortisol, uma hormona fundamental na resposta ao stress.
CRHR1 (Recetor 1 da hormona libertadora de corticotropina)
O CRHR1 codifica um recetor para a hormona libertadora de corticotropina (CRH), uma hormona central que inicia a resposta ao stress. Quando a CRH se liga ao CRHR1, estimula a produção e libertação da hormona adrenocorticotrópica (ACTH), que leva as glândulas supra-renais a produzir cortisol. As variantes no gene CRHR1 podem influenciar a sensibilidade deste recetor à CRH, o que pode alterar a resposta global ao stress. Por exemplo, alguns polimorfismos podem levar a uma resposta ao stress mais intensa, o que pode contribuir para a ansiedade ou depressão. Em contrapartida, outros podem atenuar a resposta, afectando a capacidade de lidar com o stress agudo.(6-7)
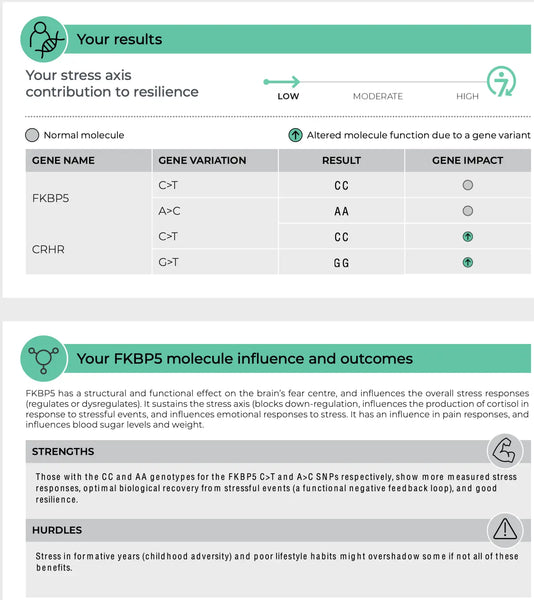
FKBP5 (Proteína de ligação ao FK506 5)
O gene FKBP5 desempenha um papel na regulação da sensibilidade do recetor de glucocorticóides, que é o recetor através do qual o cortisol exerce os seus efeitos. Polimorfismos específicos no FKBP5 têm sido associados a uma inibição de feedback alterada do eixo HPA e a respostas diferenciadas aos glucocorticóides. Por exemplo, algumas variantes do FKBP5 podem reduzir a afinidade do recetor de glucocorticóides pelo cortisol, o que pode levar a uma resposta deficiente ao stress e a um risco acrescido de perturbações psiquiátricas relacionadas com o stress, como a PSPT ou a depressão major.(8-9)
Imagem: Uma página de exemplo do sítio Web teste de resiliência do ADN.
NR3C1 (Subfamília 3 do Recetor Nuclear, Grupo C, Membro 1)
O NR3C1 codifica o próprio recetor de glucocorticóides. As variações neste gene podem afetar a forma como o corpo reage ao cortisol. Polimorfismos específicos no NR3C1 podem influenciar a sensibilidade ou a densidade dos receptores de glucocorticóides, afectando a eficácia com que o cortisol pode desempenhar as suas funções. Isto pode levar a uma série de respostas, desde uma resposta ao stress silenciosa, que pode impedir um indivíduo de reagir adequadamente a factores de stress, até uma resposta exagerada, que pode resultar em sintomas de stress crónico e até depressão.(10-12)
Os resultados dos testes genéticos da resposta ao stress podem dar uma ideia da predisposição de um indivíduo para problemas de saúde relacionados com o stress. Por exemplo:
-
Resposta exagerada ao stress: Os indivíduos com variantes específicas podem ser mais reactivos ao stress e apresentar níveis mais elevados de cortisol durante eventos stressantes.
-
Redução da resposta ao stress: Por outro lado, alguns indivíduos podem ter uma resposta ao stress reduzida, o que pode ser protetor em situações de stress agudo, mas também pode impedir a ativação dos mecanismos fisiológicos necessários em resposta a desafios.
2) Explicação dos testes de função dos neurotransmissores
Os testes de função neurotransmissora são concebidos para investigar os factores genéticos que influenciam a forma como os neurotransmissores são sintetizados, libertados e decompostos no cérebro. Uma vez que os neurotransmissores são mensageiros químicos que regulam o humor, a cognição e as respostas ao stress, as variações nos genes relacionados com estas substâncias podem ter implicações significativas na resiliência psicológica e na saúde mental geral de um indivíduo.
A exploração da função dos neurotransmissores no contexto da resiliência e da resposta ao stress vai além das catecolaminas, como a dopamina. Inclui um espetro mais alargado de sistemas de neurotransmissores envolvidos na regulação do humor, no estado de alerta e na função cognitiva. Vários genes estão envolvidos na síntese, sinalização e degradação destes neurotransmissores, incluindo a dopamina beta-hidroxilase (DBH), os receptores de dopamina (DRD2, DRD4) e vários genes relacionados com a serotonina.(13)
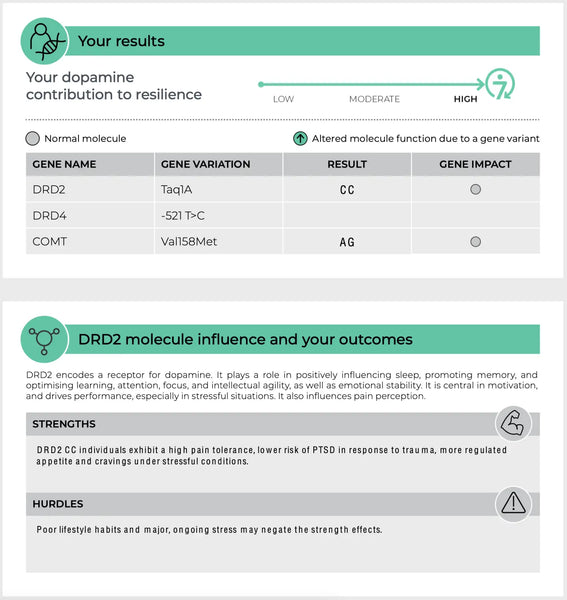
COMT (Catecol-O-Metiltransferase)
O gene COMT é um dos mais extensivamente estudados no que respeita à função dos neurotransmissores. Codifica uma enzima que decompõe as catecolaminas - como a dopamina, a epinefrina e a norepinefrina - neurotransmissores críticos para a resposta ao stress, a cognição e a regulação das emoções.
Existem polimorfismos bem conhecidos no gene COMT, como a variante Val158Met. Esta variante pode afetar o nível de atividade da enzima de diferentes formas:(14-15)
- Forma de alta atividade (variante Val): Esta forma da enzima decompõe a dopamina a um ritmo mais rápido, o que pode levar a níveis mais baixos de dopamina no córtex pré-frontal, uma região do cérebro envolvida na função executiva e na tomada de decisões. Os indivíduos com esta variante podem ter um melhor desempenho em tarefas sob condições estáveis, mas podem ser mais susceptíveis ao declínio cognitivo sob stress devido à menor disponibilidade de dopamina.
- Forma de baixa atividade (variante Met): Por outro lado, esta forma da enzima COMT metaboliza a dopamina mais lentamente, resultando em níveis mais elevados de dopamina no cérebro. Isto pode melhorar a função cognitiva sob stress, mas pode também aumentar o risco de psicopatologias relacionadas com o stress, como as perturbações de ansiedade, uma vez que o cérebro é potencialmente sobre-estimulado pelo excesso de dopamina.
Dopamina Beta-Hidroxilase (DBH)
A DBH é uma enzima que converte a dopamina em norepinefrina, um neurotransmissor envolvido na resposta de luta ou fuga. Variações genéticas no gene DBH podem afetar a atividade da enzima, influenciando os níveis de dopamina e norepinefrina no cérebro e no sistema nervoso periférico.(16-18)
- Baixa atividade: As variantes associadas a uma menor atividade da DBH podem levar a níveis mais elevados de dopamina e a níveis reduzidos de norepinefrina, o que pode afetar funções cognitivas como a atenção e a tomada de decisões e influenciar a forma como um indivíduo responde ao stress.
- Alta atividade: Inversamente, as variantes que resultam numa maior atividade da DBH podem reduzir os níveis de dopamina e aumentar os de norepinefrina, o que pode afetar a reatividade ao stress e a ansiedade.
Receptores de dopamina (DRD2 e DRD4)
DRD2 e DRD4 são genes que codificam os receptores de dopamina D2 e D4, respetivamente. Estes receptores fazem parte do sistema dopaminérgico que regula numerosas funções, incluindo o humor, a recompensa e o controlo motor.19-20)
- DRD2: As variantes no gene DRD2 podem afetar a densidade e a afinidade de ligação dos receptores D2. Isto pode influenciar a vulnerabilidade ao stress e a eficácia das pistas relacionadas com a recompensa, com potenciais implicações para doenças como a dependência e a depressão.
- DRD4: O gene DRD4 é conhecido por um número variável de repetições em tandem (VNTR) na região codificadora. As repetições específicas estão associadas a caraterísticas como a procura de novidades e o risco de perturbações da atenção. Este polimorfismo pode afetar a eficiência da sinalização sináptica da dopamina e tem sido estudado no contexto da resiliência comportamental e psicológica.
Imagem: Uma página de exemplo do sítio Web Teste de resiliência do ADN.
Variações do gene da serotonina
A serotonina é outro neurotransmissor crucial na regulação do humor, do apetite e do sono, que podem ser afectados pelo stress. Vários genes envolvidos na sinalização da serotonina são de interesse:
- 5-HTT (SLC6A4): Este gene codifica o transportador de serotonina, responsável pela recaptação de serotonina da fenda sináptica. O polimorfismo 5-HTTLPR na região promotora deste gene foi estudado devido à sua associação com a sensibilidade ao stress e as perturbações do humor.(21)
- MAOA: O gene da monoamina oxidase A é responsável pela degradação da serotonina. As variações neste gene podem afetar os níveis de serotonina e têm sido associadas a caraterísticas comportamentais e à suscetibilidade ao stress.(22)
- TPH2: A triptofano hidroxilase-2 é uma enzima essencial para a síntese de serotonina no cérebro. As variações genéticas na TPH2 podem influenciar a produção de serotonina, com potencial impacto na regulação emocional e na resposta ao stress.(23)
A interpretação dos resultados desses testes pode ser complexa. Por exemplo, uma variante associada a um maior risco de doenças relacionadas com o stress não significa necessariamente que um indivíduo venha a desenvolver essas doenças, mas pode sugerir uma maior vulnerabilidade. Do mesmo modo, possuir uma variante de "resiliência" não garante uma resistência inatacável ao stress, uma vez que os factores ambientais e as escolhas de estilo de vida desempenham um papel importante.
3) A inflamação e o seu impacto no cérebro
A inflamação crónica pode ser prejudicial para a saúde do cérebro. Pensa-se que contribui para o desenvolvimento e a progressão de doenças neurodegenerativas e pode influenciar a resposta do cérebro ao stress, que está intimamente ligada à resiliência. As citocinas pró-inflamatórias, como a interleucina-6 (IL-6) e o fator de necrose tumoral (TNF), podem atravessar a barreira hemato-encefálica e interagir com as vias que regulam o humor, a motivação e o estado de alerta.(24)
Variantes genéticas associadas à inflamação
IL-6 (Interleucina-6)
A IL-6 é uma citocina que desempenha um papel na resposta inflamatória e está envolvida em várias funções biológicas, incluindo a resposta imunitária, a hematopoiese e o metabolismo ósseo. No contexto do stress e da resiliência, a IL-6 está relacionada com o seguinte(25-26)
- Níveis elevados de IL-6 têm sido associados a um maior risco de desenvolver depressão e outras perturbações do humor.
- Variantes genéticas específicas do gene da IL-6 podem levar a um aumento da expressão da IL-6, potencialmente exacerbando a resposta inflamatória e alterando a capacidade do cérebro para lidar com o stress.
TNF (Fator de Necrose Tumoral)
O TNF é outra citocina envolvida na inflamação sistémica. Tem várias funções, incluindo a regulação das células imunitárias e a indução de febre, apoptose e inflamação.(27)
- A sobreexpressão do TNF tem sido associada a várias doenças crónicas, incluindo a artrite reumatoide, a doença inflamatória intestinal e a psoríase, bem como ao stress psicológico e à depressão.
- As variantes no gene do TNF podem influenciar o nível de produção de TNF, o que pode ter implicações diretas nos processos inflamatórios em todo o corpo e no cérebro.
4) Reguladores neurobiológicos e factores de resiliência
As variações genéticas em reguladores neurobiológicos cruciais também determinam a resiliência ao stress. Estes incluem a oxitocina, o fator neurotrófico derivado do cérebro (BDNF) e o neuropeptídeo Y (NPY). A oxitocina desempenha um papel na regulação dos comportamentos sociais e das respostas ao stress. O BDNF é crucial para manter a neuroplasticidade e a função cognitiva sob stress e o NPY modula a ansiedade e a resposta fisiológica ao stress. Estas moléculas têm um impacto coletivo nos nossos circuitos neuronais e na nossa resiliência psicológica, fornecendo informações sobre as diferenças individuais na resiliência ao stress e potenciais vias para estratégias personalizadas de biohacking.
Oxitocina
A oxitocina é muitas vezes chamada de "hormona do amor" devido ao seu papel na ligação social, comportamentos maternais e intimidade. Também exerce efeitos ansiolíticos e influencia a cognição e o comportamento social.
- Influência genética: As variações no gene do recetor da oxitocina (OXTR) têm sido associadas à regulação emocional, ao comportamento social e à capacidade de resposta ao stress. Polimorfismos específicos no OXTR podem influenciar a eficiência da ligação e os níveis de expressão dos receptores de oxitocina, o que pode afetar a capacidade de um indivíduo para lidar com o stress e estabelecer relações sociais.(28)
- Implicações: No contexto dos testes de resiliência, a avaliação das variantes da OXTR pode fornecer informações sobre a predisposição de um indivíduo para a ansiedade social, os níveis de empatia e a potencial resiliência face ao stress, especialmente o que envolve dinâmicas sociais.(29)
Fator neurotrófico derivado do cérebro (BDNF)
O BDNF é uma proteína crucial envolvida na neuroplasticidade, a capacidade do cérebro para se reorganizar e formar novas ligações neuronais ao longo da vida. É fundamental para a aprendizagem, a memória e a regeneração dos neurónios.(30)
- Variações genéticas: A variante do gene BDNF Val66Met é um dos polimorfismos mais estudados. O alelo Met tem sido associado a uma redução da secreção de BDNF dependente da atividade, o que pode afetar a função cognitiva e a resistência a perturbações neurológicas e psiquiátricas.(31)
- Implicações: O teste de variantes do gene BDNF pode ajudar a prever a capacidade de neuroplasticidade de um indivíduo em resposta ao stress e pode ter implicações na recuperação de insultos neurológicos ou traumas.(32)
Imagem: Uma página de exemplo do sítio Web Análise do teste de resiliência do ADN.
Neuropeptídeo Y (NPY)
O NPY é um dos péptidos mais abundantes no cérebro e está envolvido na regulação das respostas ao stress, ansiedade e ingestão de alimentos. É considerado um agente ansiolítico endógeno.
- Associações genéticas: Os polimorfismos no gene NPY podem levar a diferenças na expressão e secreção de NPY, influenciando potencialmente a resistência de um indivíduo ao stress. Níveis mais elevados de NPY são geralmente protectores contra os efeitos do stress.
- Implicações Os testes genéticos para as variantes do gene NPY podem indicar a resiliência ao stress de base de um indivíduo e podem prever a sua resposta psicológica ao stress crónico e ao trauma.(33)
O papel da epigenética na modulação da resiliência ao stress
O campo da epigenética aprofunda uma camada de complexidade para além da sequência estática do ADN. As modificações epigenéticas consistem em alterações químicas da estrutura do ADN, como a metilação e as modificações das histonas, que podem afetar a forma como os genes são expressos sem alterar o código genético subjacente. Estas alterações são dinâmicas e respondem a estímulos ambientais, incluindo o stress crónico. A exposição ao stress prolongado pode levar a alterações epigenéticas que afectam o funcionamento dos genes envolvidos na resposta ao stress, tornando potencialmente mais difícil para os indivíduos lidarem eficazmente com novos factores de stress.(34-35)
As empresas na vanguarda da medicina personalizada estão agora a aventurar-se na epigenética, procurando descobrir de que forma estas modificações podem contribuir para a capacidade de um indivíduo suportar e recuperar do stress. Ao analisar os marcadores epigenéticos, os cientistas podem obter informações sobre o estado atual dos perfis de expressão dos genes, que resultam tanto da predisposição genética como das influências ambientais. Estes testes podem identificar alterações epigenéticas em resposta ao stress crónico, fornecendo um retrato dos mecanismos moleculares que contribuem para a resposta de um indivíduo ao stress ou à falta dela.
Além disso, a compreensão destas alterações epigenéticas abre a porta a intervenções personalizadas. Podem ser recomendadas mudanças específicas no estilo de vida, ajustes na dieta e estratégias terapêuticas para reverter as modificações epigenéticas adversas. Esta abordagem personalizada não só aumenta a resiliência de um indivíduo, como também contribui para uma compreensão mais ampla do modo como o stress afecta os nossos sistemas biológicos a nível epigenético, o que poderá conduzir a novos tratamentos e estratégias preventivas para as perturbações relacionadas com o stress. Ao mapear a paisagem epigenética da resposta ao stress, podemos começar a traçar um quadro mais abrangente dos factores que contribuem para a nossa capacidade única de lidar com os desafios da vida.
Os benefícios e as limitações dos testes de DNA de resiliência
Estes testes podem oferecer aos indivíduos uma melhor compreensão da sua resiliência inata e da sua resposta ao stress. Esse conhecimento pode informar estratégias personalizadas para gerir o stress e melhorar a saúde mental. No entanto, é essencial abordar estes testes com cuidado:
- Traço complexo: A resiliência não é determinada por um único gene, mas é uma caraterística complexa influenciada por muitos genes e factores ambientais.
- Influência ambiental: A genética não funciona de forma isolada. As experiências de vida, os sistemas de apoio e as escolhas de estilo de vida são importantes para a resiliência.
- Poder preditivo: Embora estes testes possam fornecer informações, não são indicadores definitivos da capacidade de um indivíduo para enfrentar os desafios da vida.
Conclusão
Os testes de ADN relacionados com a resiliência representam uma fronteira intrigante na compreensão da forma como a nossa constituição genética pode influenciar a capacidade de lidar com o stress e de recuperar das adversidades. Embora possam fornecer informações valiosas, devem ser vistos como uma peça do gigantesco puzzle que constitui a resiliência de um indivíduo. Para quem estiver interessado nestes testes, recomenda-se a consulta de um profissional de saúde ou de um conselheiro genético para interpretar os resultados no contexto mais alargado da sua saúde e estilo de vida.
- Faça aqui o seu teste de ADN integral!
- Marque uma consulta para interpretar os seus testes laboratoriais e genéticos com o Dr. Sovijärvi aqui.
Referências científicas:
- Bobrow, M., & Grimbaldeston, A. H. (2000). Medical genetics, the human genome project and public health: Apresentado na Universidade de Liverpool, em 9 de dezembro de 1996 e aceite para publicação em 17 de fevereiro de 2000. Journal of Epidemiology & Community Health, 54(9), 645-649.
- Cicchetti, D. (2010). Resiliência em condições de stress extremo: uma perspetiva multinível. World psychiatry, 9(3), 145.
- Luecken, L. J., & Gallo, L. C. (Eds.). (2008). Handbook of physiological research methods in health psychology (Manual de métodos de investigação fisiológica em psicologia da saúde). Sage.
- Southwick, S. M., Vythilingam, M., & Charney, D. S. (2005). The psychobiology of depression and resilience to stress: implications for prevention and treatment. Annu. Rev. Clin. Psychol., 1, 255-291.
- Michaud, M., Balardy, L., Moulis, G., Gaudin, C., Peyrot, C., Vellas, B., ... & Nourhashemi, F. (2013). Citocinas pró-inflamatórias, envelhecimento e doenças relacionadas com a idade. Jornal da Associação Americana de Diretores Médicos, 14(12), 877-882.
- Aguilera, G., Nikodemova, M., Wynn, P. C., & Catt, K. J. (2004). Receptores da hormona libertadora de corticotropina: duas décadas depois. Peptides, 25(3), 319-329.
- Subbannayya, T., Balakrishnan, L., Sudarshan, G., Advani, J., Kumar, S., Mahmood, R., ... & Prasad, T. K. (2013). Um mapa integrado da via de sinalização do hormônio liberador de corticotropina. Jornal de comunicação e sinalização celular, 7, 295-300.
- Binder, E. B. (2009). O papel da FKBP5, uma co-chaperona do recetor de glucocorticóides na patogénese e na terapia das perturbações afectivas e de ansiedade. Psychoneuroendocrinology, 34, S186-S195.
- Ising, M., Depping, A. M., Siebertz, A., Lucae, S., Unschuld, P. G., Kloiber, S., ... & Holsboer, F. (2008). Os polimorfismos na região do gene FKBP5 modulam a recuperação do stress psicossocial em controlos saudáveis. European Journal of Neuroscience, 28(2), 389-398.
- Vitellius, G., Trabado, S., Bouligand, J., Delemer, B., & Lombès, M. (2018, junho). Fisiopatologia da sinalização de glicocorticóides. Em Annales d'endocrinologie (Vol. 79, No. 3, pp. 98-106). Elsevier Masson.
- Van West, D., Van Den Eede, F., Del-Favero, J., Souery, D., Norrback, K. F., Van Duijn, C., ... & Claes, S. (2006). Análise de SNP baseada no gene do recetor de glucocorticóides em pacientes com depressão maior recorrente. Neuropsychopharmacology, 31(3), 620-627.
- Schneider, K. K., Frings, C., Meyer, J., & Schote, A. B. (2016). O papel do gene do recetor de glicocorticóide (NR3C1) para o processamento de estímulos aversivos. Pesquisa em Neurociência, 107, 8-13.
- Azadmarzabadi, E., Haghighatfard, A., & Mohammadi, A. (2018). A baixa resiliência ao estresse está associada a alterações na expressão de genes candidatos na via de sinalização dopaminérgica. Psicogeriatria, 18(3), 190-201.
- Heinz, A., & Smolka, M. N. (2006). The effects of catechol O-methyltransferase genotype on brain activation elicited by affective stimuli and cognitive tasks. Reviews in the Neurosciences, 17(3), 359-368.
- Mier, D., Kirsch, P., & Meyer-Lindenberg, A. (2010). Substratos neurais da ação pleiotrópica da variação genética na COMT: uma meta-análise. Molecular psychiatry, 15(9), 918-927.
- Mustapic, M., Maihofer, A. X., Mahata, M., Chen, Y., Baker, D. G., O'Connor, D. T., & Nievergelt, C. M. (2014). A enzima biossintética de catecolaminas dopamina β-hidroxilase (DBH): primeiras posições de pesquisa em todo o genoma variantes determinantes de caraterísticas agindo aditivamente no promotor proximal. Human molecular genetics, 23(23), 6375-6384.
- Vincent, S., & Robertson, D. (2002). A visão mais alargada: anomalias das catecolaminas. Clinical Autonomic Research, 12, I44-I49.
- Hoenicka, J., Aragüés, M., Ponce, G., Rodríguez-Jiménez, R., Jiménez-Arriero, M. A., & Palomo, T. (2007). Dos genes dopaminérgicos às perturbações psiquiátricas. Neurotoxicity research, 11, 61-71.
- Hill, S. Y., Hoffman, E. K., Zezza, N., Thalamuthu, A., Weeks, D. E., Matthews, A. G., & Mukhopadhyay, I. (2008). Mutações dopaminérgicas: Associação dentro da família e ligação em famílias com dependência de álcool multiplex. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 147(4), 517-526.
- He, Y., Martin, N., Zhu, G., & Liu, Y. (2018). Genes candidatos para a busca de novidades: uma meta-análise de estudos de associação de: DRD4: exon III e: COMT: Val158Met. Genética psiquiátrica, 28(6), 97-109.
- Avula, R., Rand, A., Black, J. L., & O'kane, D. J. (2011). Genotipagem simultânea de múltiplos polimorfismos no gene do transportador de serotonina humano e deteção de novas variantes alélicas. Psiquiatria translacional, 1(8), e32-e32.
- Tivol, E. A., Shalish, C., Schuback, D. E., Hsu, Y. P., & Breakefield, X. O. (1996). Mutational analysis of the human MAOA gene. American journal of medical genetics, 67(1), 92-97.
- Waider, J., Araragi, N., Gutknecht, L., & Lesch, K. P. (2011). Triptofano hidroxilase-2 (TPH2) em distúrbios do controle cognitivo e regulação da emoção: uma perspetiva. Psychoneuroendocrinology, 36(3), 393-405.
- Bauer, M. E., & Teixeira, A. L. (2021). Neuroinflamação nos transtornos do humor: papel das células imunes reguladoras. Neuroimunomodulação, 28(3), 99-107.
- Anderson, G., Kubera, M., Duda, W., Lasoń, W., Berk, M., & Maes, M. (2013). Aumento da trans-sinalização de IL-6 na depressão: foco na via do catabólito triptofano, melatonina e neuroprogressão. Relatórios Farmacológicos, 65(6), 1647-1654.
- Perry, B. I., Upthegrove, R., Kappelmann, N., Jones, P. B., Burgess, S., & Khandaker, G. M. (2021). Associações de proteínas / traços imunológicos com esquizofrenia, depressão maior e transtorno bipolar: um estudo bidirecional de randomização mendeliana de duas amostras. Cérebro, comportamento e imunidade, 97, 176-185.
- Bradley, J. (2008). Doença inflamatória mediada por TNF. The Journal of Pathology: A Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 214(2), 149-160.
- Loth, E., Poline, J. B., Thyreau, B., Jia, T., Tao, C., Lourdusamy, A., ... & IMAGEN Consortium. (2014). O genótipo do recetor de ocitocina modula a atividade do estriado ventral para pistas sociais e resposta a eventos de vida estressantes. Psiquiatria biológica, 76(5), 367-376.
- Myers, A. J., Williams, L., Gatt, J. M., McAuley-Clark, E. Z., Dobson-Stone, C., Schofield, P. R., & Nemeroff, C. B. (2014). A variação no gene do recetor da ocitocina está associada ao aumento do risco de ansiedade, estresse e depressão em indivíduos com histórico de exposição ao estresse no início da vida. Jornal de pesquisa psiquiátrica, 59, 93-100.
- Cowansage, K. K., LeDoux, J. E., & Monfils, M. H. (2010). Brain-derived neurotrophic fator: a dynamic gatekeeper of neural plasticity. Farmacologia molecular atual, 3(1), 12-29.
- Chen, Z. Y., Jing, D., Bath, K. G., Ieraci, A., Khan, T., Siao, C. J., ... & Lee, F. S. (2006). O polimorfismo da variante genética BDNF (Val66Met) altera o comportamento relacionado com a ansiedade. science, 314(5796), 140-143.
- Phillips, C. (2017). Fator neurotrófico derivado do cérebro, depressão e atividade física: fazendo a conexão neuroplástica. Plasticidade neural, 2017.
- Schmeltzer, S. N., Herman, J. P., & Sah, R. (2016). Neuropeptídeo Y (NPY) e transtorno de estresse pós-traumático (PTSD): uma atualização translacional. Experimental neurology, 284, 196-210.
- Lux, V. (2016, março). Programação epigenética no desenvolvimento psicobiológico: Evidências para a Teoria da Dupla Ativação e um Papel Mediador do Estresse no Início da Vida. Em Proceedings da Conferência Anual de Investigação da Fundação do Qatar Volume 2016 Edição 1 (Vol. 2016, No. 1, p. HBOP3415). Imprensa da Universidade Hamad bin Khalifa (HBKU Press).
- Chukwuma Sr, C. (2022). Epigenética e sua essência na compreensão do crescimento, desenvolvimento e doença humana. J Med Res, 8(5), 165-172.