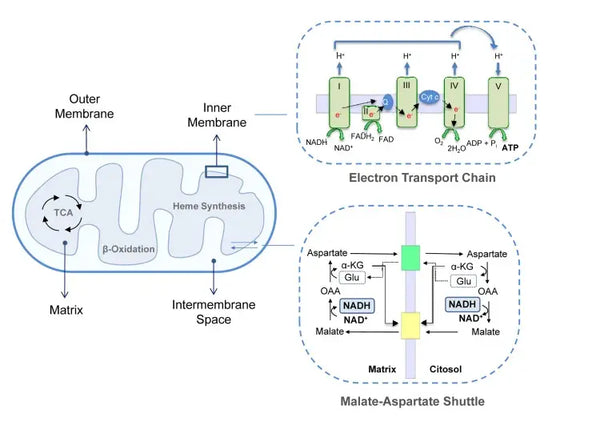
Mitocondri sono organelli vitali situati nel citoplasma delle cellule eucariotiche. Se i mitocondri funzionano bene, ogni processo dell'organismo, dal movimento all'esercizio fisico, dalla digestione al recupero, funziona meglio. Essi svolgono un ruolo essenziale nella produzione di energia e in molti altri processi cellulari. I mitocondri sono la sede della fosforilazione ossidativa, che produce ATP, la principale fonte di energia della cellula. Strutturalmente, i mitocondri possono essere valutati attraverso una membrana esterna e una membrana interna altamente ripiegata che forma i compartimenti necessari al loro metabolismo. Oltre alla produzione di energia, i mitocondri svolgono altre attività, come la segnalazione del calcio e la regolazione del metabolismo cellulare, oltre all'apoptosi (morte programmata), che li rende fondamentali per il mantenimento dell'omeostasi cellulare.
I fondamenti della funzione mitocondriale
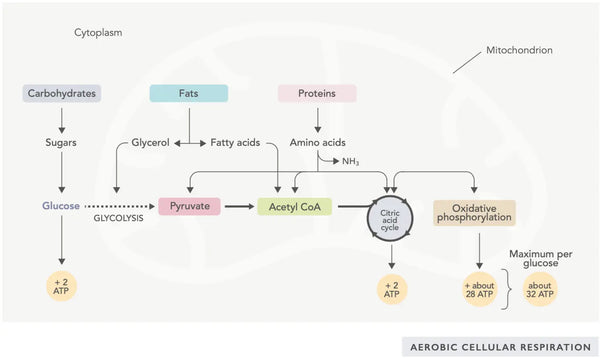
La generazione di ATP (la principale molecola energetica utilizzata dalle cellule) è la caratteristica fondamentale dell'attività mitocondriale. Questo processo avviene attraverso due vie biochimiche principali: il ciclo dell'acido citrico (ciclo TCA o ciclo di Krebs) e la catena di trasporto degli elettroni (ETC).
Ciclo dell'acido citrico
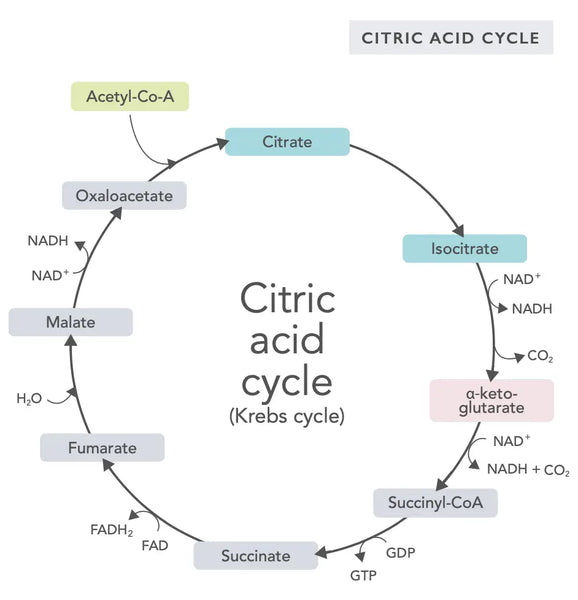
Il ciclo dell'acido citrico, o ciclo di Krebs (dal nome del premio Nobel Hans Adolf Krebs, che lo ha scoperto), avviene nei mitocondri delle cellule.(1)Il composto metabolico principale del ciclo dell'acido citrico è l'acido acetico (acetil coenzima A) prodotto da acidi grassi, carboidrati e proteine.(2)
Le varie reazioni del ciclo dell'acido citrico (vedi immagine) formano ioni idrogeno ed elettroni che vengono poi trasferiti alla membrana mitocondriale interna per la fosforilazione ossidativa (che lega l'energia alle molecole di ATP attraverso l'ossidazione) e alla catena di trasporto degli elettroni. La reazione rilascia NADH e piccole quantità di ATP e anidride carbonica.
Il ciclo dell'acido citrico prevede dieci fasi, ognuna delle quali è influenzata dalle vitamine del gruppo B, da alcuni minerali come il magnesio e il ferro e dal principale antiossidante del fegato, il glutatione. Le reazioni sono inibite da metalli pesanti come mercurio, arsenico e alluminio.
Le molecole di NADH, ricche di energia, catturano la maggior parte dell'energia generata durante il ciclo dell'acido citrico. Per ogni molecola di acetil coenzima A, vengono generate tre molecole di NADH, che vengono poi utilizzate come energia nella reazione successiva (fosforilazione ossidativa).
La regolazione del ciclo dell'acido citrico è determinata dalla disponibilità di vari amminoacidi e dall'inibizione a feedback (ad esempio, se viene prodotto troppo NADH, diversi enzimi del ciclo dell'acido citrico vengono inibiti, rallentando le reazioni).
Ossalacetato è un composto che soddisfa un bisogno improvviso di produrre energia (ad esempio, nel cervello o nei muscoli). L'assunzione di un integratore di ossalacetato può essere utile e può addirittura favorire la rigenerazione dei mitocondri nel cervello, ridurre le infiammazioni silenti nell'organismo e aumentare il numero di cellule nervose.(3)
In poche parole, il corpo incorpora sistemi ingegnosi che convertono il cibo consumato in elettroni, utilizzati come energia per varie necessità.
Fosforilazione ossidativa
La fosforilazione ossidativa è costituita dalla catena di trasporto degli elettroni e dall'ATP sintasi. La fosforilazione ossidativa produce la maggior parte dell'energia generata in condizioni aerobiche (ATP). È la continuazione del ciclo dell'acido citrico.
Nella catena di trasporto degli elettroni, gli ioni idrogeno (H+) vengono rilasciati nello spazio intermembrana mitocondriale. Gli ioni idrogeno rilasciati dallo spazio intermembrana ritornano nel mitocondrio attraverso l'ATP sintasi. Utilizzando l'energia rilasciata nel processo, l'ATP sintasi converte l'ADP utilizzato per l'energia in ATP.
L'ubiquinone (coenzima Q10) contribuisce alla catena di trasporto degli elettroni. Viene utilizzato da decenni come integratore alimentare. Bassi livelli cellulari di ubichinone possono essere un fattore predisponente per varie malattie, a causa dell'insufficiente produzione di energia aerobica nelle cellule. Inoltre, l'uso di farmaci contro il colesterolo (statine) è un fattore che contribuisce alla carenza di ubichinone.(4)
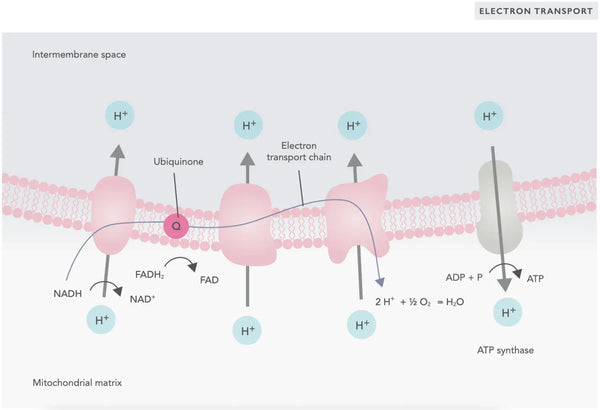
Questo insieme coordinato di reazioni genera ATP e stabilisce un gradiente protonico attraverso la membrana mitocondriale interna, un processo noto come chemiosmosi. L'energia immagazzinata in questo gradiente guida la sintesi di ATP, collegando il flusso di elettroni attraverso l'ETC alla generazione di energia cellulare.(5)
Fattori che influenzano l'efficienza mitocondriale
L'efficienza mitocondriale, ovviamente vitale per una funzione cellulare ottimale, è influenzata da diversi fattori. Di seguito sono descritti i più importanti.
Trucco genetico
I mitocondri possiedono un DNA separato e individuale (DNA mitocondriale, mtDNA) distinto dal DNA nucleare. Il mtDNA codifica per i componenti essenziali della catena di trasporto degli elettroni e per le proteine mitocondriali. Le mutazioni nel mtDNA possono portare a proteine disfunzionali, interrompendo la catena di trasporto degli elettroni e la sintesi di ATP. Ciò può comportare una ridotta produzione di energia e una maggiore generazione di specie reattive dell'ossigeno (ROS), contribuendo alla disfunzione mitocondriale e cellulare.(6)
Stress ossidativo
I mitocondri sono una fonte significativa di ROS, che sono sottoprodotti del metabolismo dell'ossigeno. Sebbene bassi livelli di ROS siano funzionali alla segnalazione cellulare, un eccesso di ROS può causare danni ossidativi alle proteine mitocondriali, ai lipidi e al DNA. Questo stress ossidativo compromette l'integrità e la funzione mitocondriale, inibendo la produzione di ATP e portando a un'ulteriore produzione di ROS in un ciclo deleterio. Le difese antiossidanti, tra cui la superossido dismutasi e la glutatione perossidasi, svolgono un ruolo fondamentale nel mitigare questo danno.(7-8)
Disponibilità di nutrienti
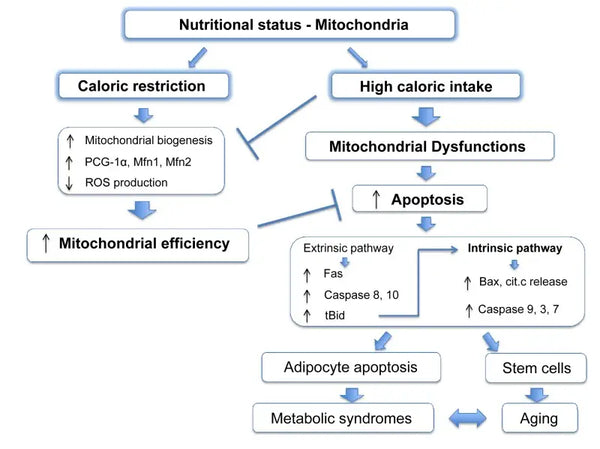
I mitocondri richiedono substrati specifici per la produzione di energia. Il glucosio e gli acidi grassi sono fonti primarie per la generazione di ATP attraverso la glicolisi e la β-ossidazione, rispettivamente. La disponibilità di questi substrati influisce direttamente sulla funzione mitocondriale. Ad esempio, in condizioni di eccesso di nutrienti, come un'elevata disponibilità di glucosio, i mitocondri possono produrre quantità eccessive di ATP e ROS, portando potenzialmente a disturbi metabolici.(9-10)
Al contrario, la scarsità di nutrienti può limitare la produzione di energia mitocondriale, compromettendo la funzione e la sopravvivenza delle cellule. Contrariamente a quanto riportato da alcuni studi sugli animali sui benefici della restrizione calorica sulla biogenesi mitocondriale, sembra che essa non aumenti la biogenesi mitocondriale. Tuttavia, preserva la funzione mitocondriale proteggendo l'integrità e la funzione dei componenti cellulari esistenti.(11-12)
Fattori dello stile di vita
Esercizio fisico
L'attività fisica influenza la quantità e la qualità dei mitocondri. L'esercizio fisico stimola la biogenesi mitocondriale, portando a un aumento della densità mitocondriale e dell'efficienza nella produzione di energia.(13) In particolare, l'allenamento di resistenza aumenta la capacità ossidativa dei mitocondri, migliorando la loro capacità di utilizzare l'ossigeno per la produzione di ATP (si veda l'approfondimento più avanti nell'articolo).
Dieta
I componenti della dieta influenzano in modo significativo la funzione mitocondriale. I rapporti tra macronutrienti, l'apporto calorico e nutrienti specifici (come antiossidanti, vitamine e minerali) influenzano il metabolismo mitocondriale. Le diete ricche di nutrienti che supportano la funzione mitocondriale possono aumentare la produzione di energia e ridurre lo stress ossidativo (vedi più avanti). Attivare chetosi può anche aumentare la biogenesi mitocondriale e migliorare l'efficienza mitocondriale.(14-15)
Fattori ambientali
L'esposizione a fattori di stress ambientale, come tossine, inquinanti, metalli pesanti (ad esempio, piombo, mercurio, arsenico e cadmio) e radiazioni, può influire negativamente sulla funzione mitocondriale. Questi fattori di stress possono indurre danni ossidativi, interrompere l'attività della catena di trasporto degli elettroni e compromettere la dinamica mitocondriale, compresi i processi di fusione e fissione.(16)
Interventi tecnologici
Fotobiomodulazione (o terapia della luce rossa)
Fotobiomodulazione è l'utilizzo di energia fotonica non ionizzante per innescare cambiamenti fotochimici all'interno di strutture cellulari ricettive ai fotoni, in particolare nei mitocondri. Si ritiene che la luce rossa e la terapia con luce NIR agiscano principalmente attraverso i fotoaccettori. Le onde di luce rossa penetrano nella pelle e raggiungono i mitocondri delle cellule, aumentandone la produzione di energia. Diversi eventi portano a questo risultato, ad esempio l'accelerazione della respirazione mitocondriale attraverso la citocromo c ossidasi.(17) Per conoscere i benefici della fotobiomodulazione per la salute, leggere qui.
Sauna a infrarossi
Le saune a infrarossi utilizzano la radiazione infrarossa, che riscalda i tessuti del corpo direttamente al posto dell'aria. La frequenza della radiazione emessa dalle saune a infrarossi è di 3-12 μm, che rientra nell'infrarosso lontano (FIR). È stato dimostrato che la luce all'infrarosso lontano ha effetti a livello tissutale, in particolare sulla catena respiratoria dei mitocondri nel processo di produzione di energia delle cellule e sull'irrorazione sanguigna dei tessuti, dilatando i vasi sanguigni e migliorando la circolazione.(18)
Terapia con campo elettromagnetico pulsato (CEMP)
La terapia CEMP utilizza campi elettromagnetici per promuovere vari processi fisiologici. Le ricerche suggeriscono che i CEMP possono migliorare la funzione mitocondriale aumentando il consumo di ossigeno cellulare e potenziando la produzione di ATP. La terapia CEMP agisce direttamente sui mitocondri, riportando le cellule a uno stato energetico e di carica elettrica più sano.(19-20) Leggete qui la guida completa sulla terapia CEMP.
Ossigenoterapia iperbarica (HBOT)
L'HBOT consiste nel respirare ossigeno puro in un ambiente pressurizzato. È stato dimostrato clinicamente che l'ossigenoterapia iperbarica rivitalizza i mitocondri e aumenta la formazione di ATP fornendo quantità sovrafisiologiche di ossigeno necessarie per la respirazione cellulare. Uno studio recente ha riportato che l'HBO ha aumentato la biogenesi dei mitocondri e l'autofagia, aumentando in parte la produzione di specie reattive dell'ossigeno. Questo processo ha prodotto nuovi mitocondri sani, mentre i vecchi mitocondri disfunzionali sono stati distrutti. Questo studio ha anche rilevato una maggiore attivazione della trascrizione e della replicazione del DNA dei mitocondri.(21-22) Per saperne di più sull'HBOT, cliccate qui.
Supporto nutrizionale e integratore per la funzione mitocondriale
Il ruolo dell'alimentazione nel mantenimento della salute mitocondriale è fondamentale e alcuni nutrienti sono particolarmente importanti per una funzione mitocondriale ottimale. Tra questi vi sono i seguenti.
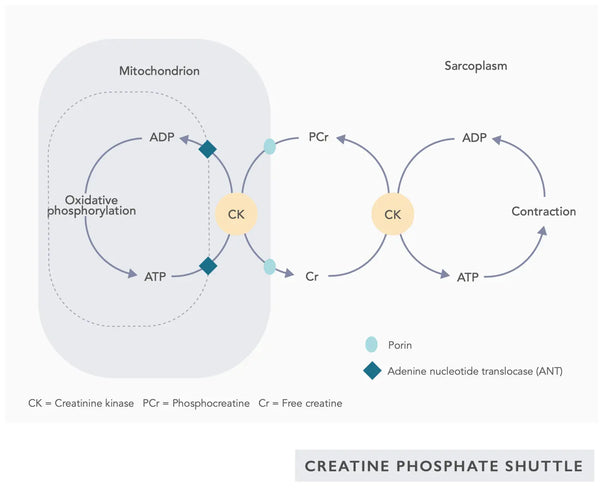
- Coenzima Q10 (CoQ10): L'ubiquinone è liposolubile e assomiglia a una vitamina. L'ubiquinone funge da trasportatore di elettroni nella catena di trasferimento degli elettroni nei mitocondri (vedi figura a destra) e favorisce la secrezione di ATP. I livelli di ubiquinone diminuiscono in vari tessuti con l'invecchiamento.(23)
- Il magnesio: Coinvolto nella sintesi dell'ATP e fondamentale per mantenere l'integrità e la funzione dei mitocondri.(24)
- Vitamine B: Comprendono B1 (tiamina), B2 (riboflavina), B3 (niacina), B5 (acido pantotenico), B6, B7 (biotina) e B12. Queste vitamine del gruppo B sono fondamentali per vari aspetti del metabolismo energetico mitocondriale.(25)
- Acido alfa-lipoico: L'ALA è un potente antiossidante che aiuta anche a rigenerare altri antiossidanti. Ha un ruolo nel metabolismo energetico e può migliorare la funzione mitocondriale.(26)
- Carnitina (in particolare acetil-L-carnitina): Trasporta gli acidi grassi nei mitocondri per la beta-ossidazione, fondamentale per la produzione di energia, in particolare nelle cellule muscolari.(27)
- Creatina: La creatina è un composto naturalmente presente nell'organismo che contribuisce a fornire energia alle cellule, in particolare a quelle muscolari, aumentando la formazione di adenosina trifosfato (ATP). L'integrazione di creatina può migliorare l'efficienza mitocondriale, in particolare negli esercizi ad alta intensità.(28)
- Pirrolochinolina chinone (PQQ): La PQQ è un antiossidante che aumenta la biogenesi mitocondriale attraverso il contenuto della proteina PGC-1 e supporta la funzione mitocondriale.(29)
- Acidi grassi Omega-3 (EPA e DHA): Gli omega-3 sono essenziali per mantenere la fluidità e la funzione della membrana mitocondriale. Si trovano principalmente nell'olio di pesce e nei pesci grassi.(30)
- Nicotinamide Riboside (NR) e Nicotinammide mononucleotide (NMN): Questi precursori del NAD+ sono essenziali per la funzione mitocondriale e la produzione di energia. L'integrazione con NR o NMN può contribuire ad aumentare i livelli di NAD+ e quindi a migliorare l'efficienza mitocondriale.(31) Per saperne di più sull'ottimizzazione del NAD+, leggete qui.
- Curcumina: La curcumina è il composto attivo della curcuma. È stato dimostrato che protegge i mitocondri dal danno ossidativo e ne migliora la funzione.(32)
- Selenio: È un oligoelemento essenziale che svolge un ruolo di protezione dei mitocondri dallo stress ossidativo. Il selenio regola anche la biogenesi mitocondriale.(33)
Esercizio fisico e biogenesi mitocondriale
L'attività fisica regolare è un fattore critico per la promozione della biogenesi mitocondriale, che porta alla creazione di nuovi mitocondri, aumentandone la quantità e la capacità funzionale nelle cellule. Diverse forme di esercizio fisico esercitano effetti distinti sulla dinamica mitocondriale. Le due forme di esercizio più importanti sono l'allenamento aerobico e l'allenamento di resistenza.
Esercizio aerobico
La densità mitocondriale nelle cellule muscolari scheletriche aumenta sensibilmente durante l'esercizio aerobico (ad esempio, corsa, ciclismo e nuoto).
La biogenesi mitocondriale è regolata da PGC-1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha), una proteina regolatrice essenziale, la cui espressione è stimolata dall'esercizio aerobico. PGC-1α coattiva i fattori respiratori nucleari (NRF) e il fattore di trascrizione mitocondriale A (TFAM), necessari per trascrivere il mtDNA e replicare i mitocondri. Questo porta a una maggiore efficienza della fosforilazione ossidativa, a una migliore resistenza e a una maggiore generazione di ATP nelle cellule muscolari.(34)
L'allenamento a intervalli ad alta intensità (HIIT) è particolarmente efficace per aumentare il numero di mitocondri e l'assorbimento massimo di ossigeno (VO2max).(35-36)
Allenamento di resistenza
La funzione e l'efficienza mitocondriale sono gli obiettivi principali dell'allenamento di resistenza (ad esempio, il sollevamento pesi e gli esercizi di bodyweight). Esso innesca cambiamenti nella sintesi proteica mitocondriale, migliorando la qualità e l'efficacia dei mitocondri presenti. L'allenamento alla resistenza aumenta anche la produzione di enzimi delle catene di trasporto degli elettroni e del ciclo di Krebs, migliorando ulteriormente la capacità delle cellule di sintetizzare ATP. Può anche aumentare il numero e le dimensioni dei mitocondri nelle cellule muscolari, anche se non nella stessa misura dell'esercizio aerobico.(37-38)
L'effetto combinato di queste modalità di esercizio sulla biogenesi e sulla funzione mitocondriale evidenzia l'importanza dell'attività fisica nel mantenere e migliorare la salute mitocondriale. L'impegno regolare nell'allenamento aerobico e di resistenza migliora in modo completo la densità, l'efficienza e il metabolismo energetico dei mitocondri delle cellule. Questi adattamenti sono fondamentali per le prestazioni atletiche e sono importanti per il mantenimento della salute, la prevenzione delle malattie e la gestione delle condizioni associate alla disfunzione mitocondriale.
Tuttavia, occorre notare che l'allenamento simultaneo per la forza e la resistenza porta a un minore adattamento, poiché le protein chinasi PKB e AMPK bloccano l'una la segnalazione a valle dell'altra, ostacolando l'effetto dell'allenamento simultaneo.(39)
Mitofagia e salute cellulare
La mitofagia si riferisce a un tipo selettivo di autofagia che svolge un ruolo essenziale nelle condizioni cellulari, essendo in grado di degradare solo i mitocondri danneggiati o non funzionanti. Questo meccanismo è cruciale per la salute dei mitocondri e di una cellula, in quanto impedisce l'accumulo di mRNA che codificano assemblaggi di subunità difettose, evitando così ulteriori crisi nelle funzioni cellulari e numerose patologie.(40)
L'eliminazione dei mitocondri danneggiati attraverso la mitofagia contribuisce a ridurre lo stress ossidativo, l'apoptosi e l'infiammazione (associati a varie patologie). L'alterazione della mitofagia facilita l'accumulo di mitocondri disfunzionali nella patogenesi di disturbi neurodegenerativi come il Parkinson e il morbo di Alzheimer. Analogamente, nei disturbi metabolici, la perdita della mitofagia porta ad alterazioni del metabolismo mitocondriale, con conseguente resistenza all'insulina e diabete di tipo 2.(41-42)
È stato dimostrato che la restrizione calorica promuove la mitofagia. Ciò è dovuto in parte all'attivazione delle sirtuine (SIRT1), dell'AMP-activated protein kinase (AMPK) e del fattore di trascrizione EB, che supportano sia la risposta alla crisi energetica cellulare sia l'avvio della mitofagia. In particolare, le sirtuine regolano la funzione dei fattori del macchinario della mitofagia, silenziando i mitocondri danneggiati.(43)
Gli effetti molecolari della restrizione calorica sono imitati da composti come il resveratrolo (un polifenolo presente nel vino rosso e in alcuni frutti di bosco) e molti altri polifenoli. Il resveratrolo promuove l'attivazione di SIRT1 e AMPK, aumentando la mitofagia responsabile del miglioramento della funzione dei mitocondri e del ripristino della salute cellulare.(44-45)
La mitofagia può essere potenziata con il digiuno intermittente. Questo miglioramento è probabilmente attenuato dal passaggio del metabolismo dall'energia basata sul glucosio a quella basata sui chetoni durante il digiuno e questo passaggio innesca la mitofagia.(46-47)
La disfunzione mitocondriale come segno distintivo dell'invecchiamento
La comprensione del contributo dei mitocondri al processo di invecchiamento è al centro della ricerca in gerontologia e biologia cellulare. Con l'invecchiamento degli organismi, la disfunzione mitocondriale diventa più comune e svolge un ruolo nel lato fisiologico dell'invecchiamento.
I mitocondri invecchiati mostrano una diminuzione della produzione di ATP, che influisce sui processi energetici necessari per il benessere cellulare. Inoltre, i cambiamenti strutturali dei mitocondri associati all'età interferiscono ancora di più con questa diminuzione della produzione energetica, come la composizione anomala del potenziale di membrana mitocondriale e l'integrità della parete interna mitocondriale.(48)
La posizione di DNA mitocondriale (mtDNA) vicino alla catena di trasporto degli elettroni, dove avvengono le specie reattive dell'ossigeno, influisce sulla sua vulnerabilità alle mutazioni. Tuttavia, le mutazioni si accumulano con il tempo, provocando una disfunzione mitocondriale. A differenza del DNA nucleare, che è legato agli istoni per la protezione e dispone di una serie di meccanismi di riparazione, il mtDNA non ha il rivestimento protettivo degli istoni e non dispone di un'ampia gamma di metodi di riparazione, per cui può essere facilmente danneggiato.(49)
Nelle cellule, i mitocondri producono specie reattive dell'ossigeno (ROS). Sebbene i ROS siano un mezzo fondamentale per la cellula per comunicare e regolarsi all'interno del suo ambiente, la generazione di alti livelli di queste molecole è limitata da uno stretto controllo. Una produzione eccessiva in varie condizioni legate all'età porta le cellule a soffrire di stress ossidativo. Esso distrugge diversi componenti cellulari, siano essi proteine, lipidi o DNA. I mitocondri sono addirittura i primi destinatari del danno ossidativo, creando un circolo vizioso in quanto i mitocondri danneggiati non fanno altro che generare altri ROS, aumentando così la produzione cellulare. senescenza cellulare.(50-52)
La dinamica mitocondriale è cruciale per la funzione mitocondriale che aiuta a mantenere il processo di fusione e fissione. Tuttavia, queste dinamiche vengono interrotte con l'invecchiamento e i mitocondri subiscono una frammentazione anziché una fusione. Questi cambiamenti influenzano la funzione dei mitocondri e la loro posizione nelle cellule.(53)
La perdita della funzione mitocondriale non è un fenomeno passivo legato all'invecchiamento, ma partecipa attivamente alla patogenesi delle malattie dipendenti dall'età. La disfunzione mitocondriale è stata associata a condizioni quali le malattie neurodegenerative, le malattie cardiovascolari e i disturbi metabolici. In questi disturbi, la ridotta o difettosa produzione di energia, l'aumento dello stress ossidativo e l'incapacità di eliminare i mitocondri danneggiati sono essenziali nella patogenesi e nel decorso della malattia.(54)
Conclusioni
L'ottimizzazione della salute mitocondriale e del suo declino con l'invecchiamento è un compito impegnativo, ma fortunatamente possiamo fare molto al riguardo. I principali interventi riguardano il supporto nutrizionale dei substrati critici per la rigenerazione, tra cui il coenzima Q10, il magnesio e le vitamine del gruppo B; la partecipazione regolare a diverse discipline di esercizio fisico per aumentare la biogenesi mitocondriale; e le modifiche dello stile di vita, come la restrizione calorica o il digiuno intermittente per influenzare i meccanismi di mitofagia.
Riconoscere la disfunzione mitocondriale come uno dei fattori coinvolti nell'invecchiamento rende queste strategie essenziali per sostenere la salute cellulare e combattere il degrado legato all'età. Gli approcci integrativi che utilizzano la potenza delle conoscenze scientifiche, in combinazione con le modifiche dello stile di vita applicabili, possono creare condizioni favorevoli per la prevenzione e il rallentamento dell'usura mitocondriale, a vantaggio del benessere e della longevità dell'individuo.
Riferimenti scientifici
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900-81), pioniere della medicina moderna, architetto del metabolismo intermedio. Rivista di biografia medica 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biochimica. 5a edizione. Capitolo 17, Il ciclo dell'acido citrico. New York: W. H. Freeman.
- Wilkins, H. et al. (2014). L'ossalacetato attiva la biogenesi mitocondriale del cervello, potenzia la via dell'insulina, riduce l'infiammazione e stimola la neurogenesi. Genetica molecolare umana 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Carenza primaria e secondaria di coenzima Q10: il ruolo dell'integrazione terapeutica. Recensioni sulla nutrizione 71 (3): 180–188. Recensione.
- Saraste, M. (1999). La fosforilazione ossidativa alla fine del secolo. Scienza 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). TRNA mitocondriali umani: biogenesi, funzione, aspetti strutturali e malattie. Rivista annuale di genetica 45: 299–329.
- Zhang, Y. & Wong, H. (2021). I mitocondri sono il principale responsabile delle specie reattive dell'ossigeno nelle cellule? Rivista di biologia sperimentale 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Specie reattive dell'ossigeno nella segnalazione cellulare. American Journal of Physiology-Fisiologia cellulare e molecolare del polmone 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Meccanismi di produzione di bioenergia nei mitocondri. I mitocondri e il loro ruolo nelle malattie cardiovascolari 99–121.
- Bottje, W. (2019). Metabolismo ossidativo ed efficienza: il delicato gioco di equilibri dei mitocondri. Scienza del pollame 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). La disponibilità di nutrienti collega mitocondri, apoptosi e obesità. Invecchiamento (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). La restrizione calorica cronica preserva la funzione mitocondriale nella senescenza senza aumentare la biogenesi mitocondriale. Metabolismo cellulare 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Meccanismi molecolari per l'adattamento mitocondriale all'allenamento nel muscolo scheletrico. La rivista FASEB 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Regolazione della biogenesi mitocondriale. Saggi di biochimica 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Terapia metabolica a base di chetoni: l'aumento di NAD+ è un meccanismo primario? Frontiere della neuroscienza molecolare 10: 377.
- Fowler, B. (1978). Effetti subcellulari generali di piombo, mercurio, cadmio e arsenico. Prospettive di salute ambientale 22:37-41.
- Hamblin, M. (2018). Meccanismi e segnalazione redox mitocondriale nella fotobiomodulazione. Fotochimica e fotobiologia 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Radiazione infrarossa lontana (FIR): effetti biologici e applicazioni mediche. Fotonica e laser in medicina 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). La stimolazione elettromagnetica aumenta la funzione mitocondriale nelle cellule osteogeniche e promuove la riparazione delle fratture ossee. Rapporti scientifici 11 (1): 19114.
- Tai, Y. et al. (2020). I campi magnetici modulano il metabolismo e il microbioma intestinale in correlazione con l'espressione di Pgc-1 alfa: Follow-up di uno studio magnetico mitotico in vitro. La rivista FASEB 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). L'effetto dell'ossigeno iperbarico sul metabolismo energetico mitocondriale e glicolitico: il concetto di caloristasi. Stress cellulare e chaperoni 25 (4): 667-677.
- Chen, W. et al. (2020). L'ossigeno iperbarico protegge dal danno da ischemia-riperfusione miocardica attraverso l'inibizione della disfunzione dei mitocondri e dell'autofagia. Rapporti sulla medicina molecolare 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). La complessità della produzione di ubichinone. Tendenze in Endocrinologia e Metabolismo 30 (12): 929-943.
- Volpe, S. (2013). Il magnesio nella prevenzione delle malattie e nella salute generale. I progressi della nutrizione 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O'Brien, P. (2006). Funzione mitocondriale e tossicità: ruolo della famiglia delle vitamine B sul metabolismo energetico mitocondriale. Interazioni chimico-biologiche 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Metabolismo dell'acido lipoico e regolazione redox mitocondriale. Rivista di Chimica Biologica 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). La carnitina nella bioenergetica del muscolo umano: l'integrazione di carnitina può migliorare l'esercizio fisico? Molecole 25 (1): 182.
- Wax, B. et al. (2021). La creatina per l'esercizio fisico e le prestazioni sportive, con considerazioni sul recupero per le popolazioni sane. Nutrienti 13 (6): 1915.
- Hwang, P. et al. (2020). Effetti dell'integrazione di pirrolochinolina chinone (PQQ) sulle prestazioni di esercizio aerobico e sugli indici di biogenesi mitocondriale in uomini non allenati. Giornale del Collegio Americano di Nutrizione 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Influenza della composizione della membrana mitocondriale e della bioenergetica attraverso l'integrazione di omega-3. Rivista di fisiologia 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). La nicotinamide riboside aumenta il metaboloma NAD+ del muscolo scheletrico umano invecchiato e induce firme trascrittomiche e antinfiammatorie. Rapporti sulle cellule 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Curcumina, biogenesi mitocondriale e mitofagia: esplorazione dei dati recenti e indicazione delle esigenze future. Progressi della biotecnologia 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Il selenio, un micronutriente che modula la salute cardiovascolare attraverso l'enzimologia redox. Nutrienti 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Regolazione di PGC-1α, un regolatore nodale della biogenesi mitocondriale. American Journal of Clinical Nutrition 93 (4): 884S-890S.
- Helgerud, J. et al. (2007). Gli intervalli aerobici ad alta intensità migliorano il VO2max più dell'allenamento moderato. Medicina e scienza nello sport e nell'esercizio fisico 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Simili adattamenti metabolici durante l'esercizio dopo un allenamento a intervalli di sprint a basso volume e un allenamento di resistenza tradizionale nell'uomo. Giornale di fisiologia 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Effetti differenziali dell'esercizio di resistenza e di endurance nello stato di alimentazione sulla fosforilazione delle molecole di segnalazione e sulla sintesi proteica nel muscolo umano. La rivista di fisiologia 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). L'allenamento di resistenza altera la funzione mitocondriale nel muscolo scheletrico umano. Medicina e scienza nello sport e nell'esercizio fisico 47 (9): 1922-1931.
- Baar, K. (2006). Allenamento per la resistenza e la forza: lezioni dalla segnalazione cellulare. Medicina e scienza nello sport e nell'esercizio fisico 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Le vie della mitofagia per il controllo della qualità e l'eliminazione dei mitocondri. Morte cellulare e differenziamento 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). I mitocondri e l'asse autofagia-infiammazione-morte cellulare nell'invecchiamento dell'organismo. Scienza 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitofagia: un promettente bersaglio terapeutico per la neuroprotezione durante l'invecchiamento e le malattie legate all'età. Rivista britannica di farmacologia 180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Restrizione calorica: l'AMPK è un sensore e un effettore chiave? Fisiologia 26 (4): 214-224.
- Um, J. et al. (2010). Topi con deficit di AMP-activated protein kinase sono resistenti agli effetti metabolici del resveratrolo. Diabete 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Le proprietà antiaging di un antiossidante derivato dall'uva sono regolate dall'equilibrio mitocondriale di fusione e fissione che porta alla mitofagia innescata da una rete di segnalazione di Sirt1-Sirt3-Foxo3-PINK1-PARKIN. Medicina ossidativa e longevità cellulare 2014: 345105.
- Longo, V. & Panda, S. (2016). Digiuno, ritmi circadiani e alimentazione limitata nel tempo in una vita sana. Metabolismo cellulare 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I& Sahebkar, A. (2020). L'effetto del digiuno o della restrizione calorica sull'induzione della mitofagia: una revisione della letteratura. Rivista di cachessia, sarcopenia e muscolatura. 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Stress ossidativo, mutazione del DNA mitocondriale e compromissione degli enzimi antiossidanti nell'invecchiamento. Biologia sperimentale e medicinae 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). Mutazioni del mtDNA e loro ruolo nell'invecchiamento, nelle malattie e nelle scienze forensi. Invecchiamento e malattie 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Generazione di specie reattive dell'ossigeno da parte dei mitocondri. Gli antiossidanti 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Specie reattive dell'ossigeno e mitocondri: Un nesso dell'omeostasi cellulare. Biologia Redox 6: 472-485.
- Correia-Melo, C. et al. (2016). I mitocondri sono necessari per le caratteristiche pro-invecchiamento del fenotipo senescente. La rivista EMBO 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Le proteine di fusione e fissione mitocondriale come nuovi bersagli terapeutici per il trattamento delle malattie cardiovascolari. Rivista europea di farmacologia 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitofagia: un ruolo emergente nell'invecchiamento e nelle malattie associate all'età. Frontiere in Biologia cellulare e dello sviluppo 8: 200.