Resilienssin tutkiminen genetiikan kautta on laajeneva kiinnostuksen kohde, joka usein risteää psykologian, neurobiologian ja genomiikan tieteenalojen kanssa. Vaikka resilienssin käsite - kyky toipua vastoinkäymisistä tai stressistä tai sopeutua niihin - on monitahoinen ja siihen vaikuttaa geneettisten, ympäristöön liittyvien ja psykologisten tekijöiden monimutkainen vuorovaikutus, on kehitetty erityisiä DNA-testejä, jotka valaisevat tämän ominaisuuden geneettisiä komponentteja.
Johdanto
Geenit ovat DNA:n osia, jotka sisältävät ohjeet, joita elimistö tarvitsee tehdäkseen kutakin monista tuhansista elämässä tarvittavista proteiineista. Kukin geeni koostuu tuhansista kirjainyhdistelmistä (emäksistä), jotka muodostavat geneettisen koodin. Koodi antaa ohjeet asianmukaisen kehityksen ja toiminnan edellyttämien proteiinien valmistamiseksi.(1)
Geneettiset vaihtelut voivat vaikuttaa geenin ilmentymiseen ja siten aineenvaihduntaprosesseihin, jotka ovat tärkeitä solujen terveyden ylläpitämisessä ja siinä, miten reagoimme ympäristön toimenpiteisiin, kuten ruokavalioon, elämäntapaan, lisäravinteisiin ja lääkkeisiin.
Näiden geneettisten variaatioiden tuntemus tarjoaa vertaansa vailla olevaa tietoa biologisista järjestelmistä, minkä ansiosta terveydenhuollon ammattilaiset voivat suositella täsmällisiä toimenpiteitä, joiden tarkoituksena on auttaa saavuttamaan omat tavoitteet ja optimaalinen terveys.
Resilienssin geneettisten merkkiaineiden ymmärtäminen
Resilienssi-eli kyky toipua vastoinkäymisistä tai muutoksista tai sopeutua niihin helposti, näkyy yhä useammin genetiikan kautta. Tutkijat ja lääkärit pyrkivät geneettisiä merkkiaineita tutkimalla löytämään biologiset taustatekijät, jotka voivat selittää, miksi jotkut yksilöt toipuvat stressistä ja traumasta tehokkaammin kuin toiset.(2) Tällä kasvavalla tutkimusalalla on keskitytty resilienssiin liittyviin DNA-testeihin, joissa tutkitaan geneettisiä merkkiaineita, jotka mahdollisesti ovat vastuussa yksilöllisten stressireaktioiden eroista.
Tutkimuksen ytimessä ovat hormonitoiminta ja hermosto... (erityisesti autonominen hermosto), jotka ovat keskeisessä asemassa elimistön stressireaktiossa. Erityisesti hypotalamus-aivolisäke-lisämunuaiskuoriakseli (HPA-akseli) on keskeinen kohdealue, koska sillä on ratkaiseva rooli elimistön stressireaktiomekanismin säätelyssä. Tämä monimutkainen hypotalamuksen, aivolisäkkeen ja lisämunuaisten välinen vuorovaikutusverkosto ohjaa keskeisten stressihormonien, kuten kortisolin, tuotantoa ja säätelyä.
Kortisoli on kauaskantoisia vaikutuksia moniin kehon toimintoihin, ja sitä vapautuu stressin ja alhaisen verensokeripitoisuuden seurauksena. Normaalioloissa kortisoli auttaa palauttamaan homeostaasin stressitilanteiden jälkeen. HPA-akseliin vaikuttavat geenimuunnokset voivat kuitenkin johtaa eroihin siinä, miten kortisolia tuotetaan, säädellään ja poistuu elimistöstä. Nämä geenivaihtelut voivat vaikuttaa yksilön fysiologiseen sietokykyyn eli kykyyn ylläpitää psyykkistä ja fyysistä terveyttä tai palata nopeasti siihen vaikeuksien jälkeen.(3)
Kestävyyttä mittaavat DNA-testit tutkitaan geenimuunnoksia, jotka liittyvät stressihormonien reseptoreihin, stressihormonireitteihin osallistuviin proteiineihin ja entsyymeihin, jotka metaboloivat näitä hormoneja. Esimerkiksi FKBP5-geenin variantti, joka osallistuu glukokortikoidireseptorin, jonka kautta kortisoli vaikuttaa, herkkyyden säätelyyn, voi muuttaa yksilön stressireaktiota ja mahdollisesti alttiutta stressiin liittyville häiriöille. Laajentamalla soveltamisalaa edelleen, myös geenit, jotka koodaavat neurotransmittereita - aivojen kemiallisia viestinviejiä, jotka vaikuttavat mielialan säätelyyn ja kognitioon - ovat valokeilassa. Näihin kuuluvat esimerkiksi COMT-geenit, jotka osallistuvat mielihyvään ja palkitsemisjärjestelmiin liittyvän välittäjäaineen, dopamiinin, hajottamiseen.(4)
Lisäksi, tulehdus on biologinen prosessi, joka on tiiviisti yhteydessä stressiin ja mielialahäiriöihin. Krooninen tulehdus, johon geneettiset vaihtelut voivat vaikuttaa, voi vaikuttaa aivojen toimintaan ja käyttäytymiseen.(5) Geneettisillä testeillä voidaankin pyrkiä tunnistamaan myös tulehdusta edistävien sytokiinigeenien, kuten IL-6:n ja TNF:n, variantteja, jotka voivat altistaa henkilöitä pitkittyneille tulehdusreaktioille ja vaikuttaa heidän psyykkiseen joustavuuteensa.
Näiden geneettisten merkkiaineiden ymmärtäminen on kulmakivi yksilöllisten interventioiden toteuttamiselle. Tunnistamalla geneettiset alttiudet yksilöt voivat ryhtyä ennakoiviin toimiin vahvistaakseen vastustuskykyään elämäntapamuutoksilla, psykologisilla strategioilla ja lääketieteellisillä hoidoilla, jotka on räätälöity heidän ainutlaatuisen geneettisen koostumuksensa mukaan. Tämä lähestymistapa on esimerkki siirtymästä kohti täsmälääketiedettä, jossa yhden koon malli väistyy yksilöllisemmän hoidon tieltä.
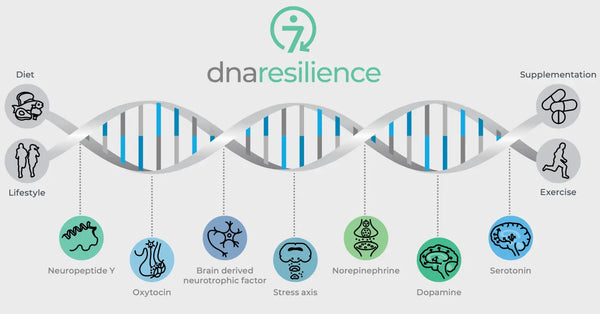
Kuva: Resilienssin seitsemän molekyylireittiä.
Kestävyyttä mittaavien DNA-testausten tyypit
1) Stressivasteen geenit
Stressivasteen geenit ovat elimistömme stressitekijöiden hallintaan ja niihin reagoimiseen tarkoitetun järjestelmän kriittisiä osia. Ne koodaavat proteiineja, jotka säätelevät erilaisia fysiologisia prosesseja, mukaan lukien kortisolin, stressivasteessa keskeisen hormonin, vapautumista ja toimintaa.
CRHR1 (kortikotropiinia vapauttavan hormonin reseptori 1).
CRHR1 koodaa reseptoria kortikotropiinia vapauttavalle hormonille (CRH), joka on keskeinen stressivasteen käynnistävä hormoni. Kun CRH sitoutuu CRHR1:een, se stimuloi adrenokortikotrooppisen hormonin (ACTH) tuotantoa ja vapautumista, mikä saa lisämunuaiset tuottamaan kortisolia. CRHR1-geenin variantit voivat vaikuttaa siihen, kuinka herkkä tämä reseptori on CRH:lle, mikä voi muuttaa yleistä stressivasteeseen reagoimista. Jotkin polymorfismit voivat esimerkiksi johtaa kohonneeseen stressivasteeseen, mikä voi edistää ahdistusta tai masennusta. Toiset taas voivat vaimentaa vastetta, mikä vaikuttaa kykyyn käsitellä akuuttia stressiä.(6-7)
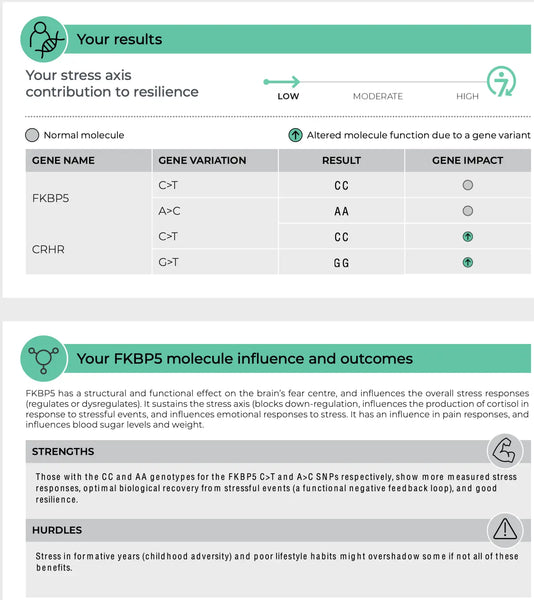
FKBP5 (FK506-sitova proteiini 5)
FKBP5-geenillä on merkitystä glukokortikoidireseptorin herkkyyden säätelyssä, sillä se on reseptori, jonka kautta kortisoli vaikuttaa. FKBP5:n spesifiset polymorfismit on yhdistetty HPA-akselin muuttuneeseen takaisinkytkennän estoon ja erilaisiin vasteisiin glukokortikoidille. Esimerkiksi jotkin FKBP5:n variantit voivat vähentää glukokortikoidireseptorin affiniteettia kortisolia kohtaan, mikä saattaa johtaa heikentyneeseen stressivasteeseen ja suurentuneeseen riskiin sairastua stressiin liittyviin psykiatrisiin häiriöihin, kuten PTSD:hen tai vakavaan masennukseen.(8-9)
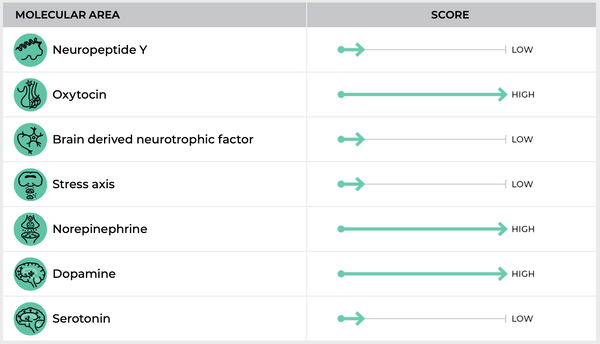
Kuva: Esimerkkisivu DNA Resilience -testistä.
NR3C1 (ydinreseptorien 3. alaryhmän ryhmän C jäsen 1).
NR3C1 koodaa itse glukokortikoidireseptoria. Tämän geenin vaihtelut voivat vaikuttaa siihen, miten elimistö reagoi kortisoliin. NR3C1:n tietyt polymorfismit voivat vaikuttaa glukokortikoidireseptorien herkkyyteen tai tiheyteen, mikä vaikuttaa siihen, kuinka tehokkaasti kortisoli voi hoitaa tehtäviään. Tämä voi johtaa erilaisiin vasteisiin, jotka vaihtelevat vaimeasta stressivasteesta, joka voi estää yksilöä reagoimasta riittävästi stressitekijöihin, liioiteltuun vasteeseen, joka voi johtaa kroonisiin stressioireisiin ja jopa masennukseen.(10-12)
Stressivasteen geenitestauksen tulokset voivat antaa tietoa yksilön taipumuksesta stressiin liittyviin terveysongelmiin. Esim:
-
Kohonnut stressireaktio: Yksilöt, joilla on tiettyjä variantteja, saattavat reagoida stressiin herkemmin ja kokea korkeampia kortisolitasoja stressitilanteissa.
-
Vähentynyt stressireaktio: Tämä voi olla suojaava tekijä akuuteissa stressitilanteissa, mutta se voi myös estää tarvittavien fysiologisten mekanismien aktivoitumisen haasteisiin vastaamiseksi.
2) Neurotransmitterien toimintakokeet selitettyinä
Neurotransmitterien toimintakokeet on suunniteltu tutkimaan geneettisiä tekijöitä, jotka vaikuttavat siihen, miten neurotransmitterit syntetisoituvat, vapautuvat ja hajoavat aivoissa. Koska välittäjäaineet ovat kemiallisia viestinviejiä, jotka säätelevät mielialaa, kognitiota ja stressireaktioita, näihin aineisiin liittyvien geenien vaihteluilla voi olla merkittäviä vaikutuksia yksilön psykologiseen joustavuuteen ja yleiseen mielenterveyteen.
Neurotransmitterien toiminnan tutkiminen resilienssin ja stressivasteen yhteydessä ulottuu katekoliamiinin, kuten dopamiinin, lisäksi myös muihin aineisiin. Se kattaa laajemman kirjon välittäjäainejärjestelmiä, jotka osallistuvat mielialan säätelyyn, valppauteen ja kognitiivisiin toimintoihin. Useat geenit osallistuvat näiden välittäjäaineiden synteesiin, signalointiin ja hajoamiseen, mukaan lukien dopamiinin beeta-hydroksylaasi (DBH), dopamiinireseptorit (DRD2, DRD4) ja erilaiset serotoniiniin liittyvät geenit.(13)
COMT (katekoli-O-metyylitransferaasi).
COMT-geeni on yksi laajimmin tutkituista neurotransmitterien toimintaa koskevista geeneistä. Se koodaa entsyymiä, joka hajottaa katekoliamiineja - kuten dopamiinia, adrenaliinia ja noradrenaliinia - välittäjäaineita, jotka ovat kriittisiä stressivasteen, kognition ja tunteiden säätelyn kannalta.
COMT-geenissä on tunnettuja polymorfismeja, kuten Val158Met-muunnos. Tämä variantti voi vaikuttaa entsyymin aktiivisuustasoon eri tavoin:(14-15)
- Korkean aktiivisuuden muoto (Val-variantti): Tämä entsyymin muoto hajottaa dopamiinia nopeammin, mikä voi johtaa dopamiinin määrän vähenemiseen prefrontaalisessa aivokuoressa, joka on aivojen alue, joka osallistuu toimeenpaneviin toimintoihin ja päätöksentekoon. Henkilöt, joilla on tämä variantti, saattavat suoriutua tehtävistä paremmin vakaissa olosuhteissa, mutta saattavat olla alttiimpia kognitiiviselle heikkenemiselle stressitilanteessa dopamiinin vähäisemmän saatavuuden vuoksi.
- Vähäaktiivinen muoto (Met-variantti): COMT-entsyymin tämä muoto sen sijaan metaboloi dopamiinia hitaammin, mikä johtaa korkeampiin dopamiinipitoisuuksiin aivoissa. Tämä voi parantaa kognitiivisia toimintoja stressitilanteessa, mutta se voi myös lisätä stressiin liittyvien psykopatologioiden, kuten ahdistuneisuushäiriöiden, riskiä, koska liiallinen dopamiinin määrä saattaa ylistimuloida aivoja.
Dopamiinin beeta-hydroksylaasi (DBH)
DBH on entsyymi, joka muuntaa dopamiinia noradrenaliiniksi, joka on taistelu- tai pakoreaktioon liittyvä välittäjäaine. Geneettiset variaatiot DBH-geenissä voivat vaikuttaa entsyymin aktiivisuuteen, mikä vaikuttaa dopamiini- ja noradrenaliinitasoihin aivoissa ja ääreishermostossa.(16-18)
- Alhainen aktiivisuus: Matalampaan DBH-aktiivisuuteen liittyvät variantit voivat johtaa korkeampiin dopamiinitasoihin ja alhaisempiin noradrenaliinitasoihin, mikä voi vaikuttaa kognitiivisiin toimintoihin, kuten tarkkaavaisuuteen ja päätöksentekoon, ja vaikuttaa siihen, miten yksilö reagoi stressiin.
- Korkea aktiivisuus: Sitä vastoin variantit, jotka johtavat korkeampaan DBH-aktiivisuuteen, voivat alentaa dopamiinitasoja ja lisätä noradrenaliinitasoja, mikä saattaa vaikuttaa stressireaktiivisuuteen ja ahdistuneisuuteen.
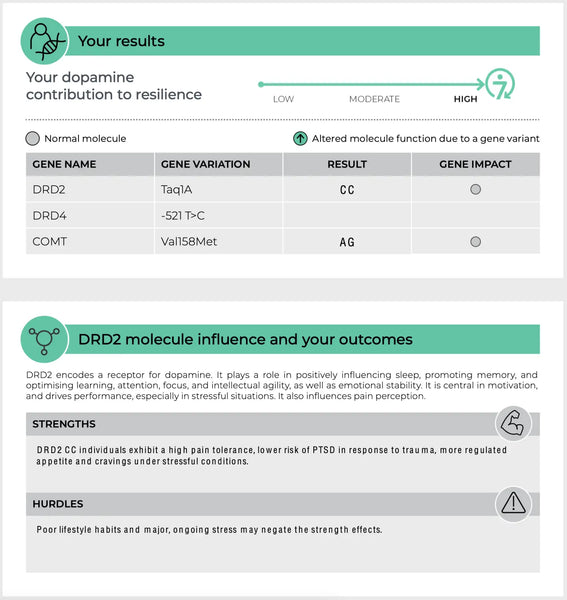
Dopamiinireseptorit (DRD2 ja DRD4)
DRD2 ja DRD4 ovat geenejä, jotka koodaavat dopamiinireseptoreita D2 ja D4. Nämä reseptorit ovat osa dopamiinijärjestelmää, joka säätelee lukuisia toimintoja, kuten mielialaa, palkitsemista ja motorista kontrollia(.19-20)
- DRD2: DRD2-geenin variantit voivat vaikuttaa D2-reseptorien tiheyteen ja sitoutumisaffiniteettiin. Tämä voi vaikuttaa haavoittuvuuteen stressille ja palkitsemiseen liittyvien vihjeiden tehokkuuteen, millä voi olla vaikutuksia esimerkiksi riippuvuuteen ja masennukseen.
- DRD4: DRD4-geeni tunnetaan koodaavan alueen vaihtelevasta tandemtoistojen määrästä (VNTR). Tietyt toistot liittyvät ominaisuuksiin, kuten uutuuden etsimiseen ja tarkkaavaisuushäiriöiden riskiin. Tämä polymorfismi voi vaikuttaa synaptisen dopamiinisignaalin välittämisen tehokkuuteen, ja sitä on tutkittu käyttäytymisen ja psykologisen joustavuuden yhteydessä.
Kuva: Esimerkkisivu DNA Resilienssi -testistä.
Serotoniinigeenin muunnokset
Serotoniini on toinen tärkeä välittäjäaine mielialan, ruokahalun ja unen säätelyssä, joihin kaikkiin stressi voi vaikuttaa. Useat serotoniinisignalointiin osallistuvat geenit ovat kiinnostavia:
- 5-HTT (SLC6A4): Tämä geeni koodaa serotoniinikuljettajaa, joka vastaa serotoniinin takaisinotosta synaptisesta raosta. Tämän geenin promoottorialueella olevaa 5-HTTLPR-polymorfismia on tutkittu sen vuoksi, että sillä on yhteys stressiherkkyyteen ja mielialahäiriöihin.(21)
- MAOA: Monoamiinioksidaasi A -geeni vastaa serotoniinin hajottamisesta. Tämän geenin variaatiot voivat vaikuttaa serotoniinitasoihin, ja ne on yhdistetty käyttäytymispiirteisiin ja alttiuteen stressille.(22)
- TPH2: Tryptofaanihydroksylaasi-2 on entsyymi, joka on kriittinen serotoniinin syntetisoinnissa aivoissa. TPH2:n geneettiset vaihtelut voivat vaikuttaa serotoniinin tuotantoon, mikä saattaa vaikuttaa tunteiden säätelyyn ja stressiin reagoimiseen.(23)
Näiden testien tulosten tulkinta voi olla monimutkaista. Esimerkiksi muunnos, johon liittyy suurempi riski stressiin liittyviin tiloihin, ei välttämättä tarkoita, että yksilö sairastuu tällaisiin tiloihin, mutta se voi viitata lisääntyneeseen haavoittuvuuteen. Vastaavasti "resilienssi"-muunnoksen omaaminen ei takaa kiistatonta stressinsietokykyä, sillä ympäristötekijöillä ja elämäntapavalinnoilla on merkittävä rooli.
3) Tulehdus ja sen vaikutus aivoihin
Krooninen tulehdus voi olla haitallista aivojen terveydelle. Sen uskotaan edistävän hermoston rappeutumissairauksien kehittymistä ja etenemistä, ja se voi vaikuttaa aivojen stressireaktioon, joka on läheisesti sidoksissa resilienssiin. Tulehdusta edistävät sytokiinit, kuten interleukiini-6 (IL-6) ja tuumorinekroositekijä (TNF), voivat läpäistä veri-aivoesteen ja olla vuorovaikutuksessa mielialaa, motivaatiota ja vireystilaa säätelevien reittien kanssa.(24)
Tulehdukseen liittyvät geenimuunnokset
IL-6 (Interleukiini-6)
IL-6 on sytokiini, jolla on rooli tulehdusreaktiossa ja joka osallistuu useisiin biologisiin toimintoihin, kuten immuunivasteeseen, hematopoieesiin ja luun aineenvaihduntaan. Stressin ja resilienssin yhteydessä IL-6 liittyy seuraaviin seikkoihin:(25-26)
- Kohonneet IL-6-tasot on yhdistetty suurempaan riskiin sairastua masennukseen ja muihin mielialahäiriöihin.
- IL-6-geenin tietyt geneettiset variantit voivat johtaa IL-6:n lisääntyneeseen ilmentymiseen, mikä mahdollisesti pahentaa tulehdusreaktiota ja muuttaa aivojen kykyä selviytyä stressistä.
TNF (tuumorinekroositekijä).
TNF on toinen systeemiseen tulehdukseen osallistuva sytokiini. Sillä on erilaisia tehtäviä, kuten immuunisolujen säätely ja kuumeen, apoptoosin ja tulehduksen indusointi.(27)
- TNF:n yliekspressio on yhdistetty erilaisiin kroonisiin sairauksiin, kuten nivelreumaan, tulehdukselliseen suolistosairauteen ja psoriaasiin, sekä psykologiseen stressiin ja masennukseen.
- TNF-geenin variantit voivat vaikuttaa TNF:n tuotannon tasoon, millä voi olla suoria vaikutuksia tulehdusprosesseihin koko kehossa ja aivoissa.
4) Neurobiologiset säätelijät ja resilienssitekijät
Geneettiset variaatiot keskeisissä neurobiologisissa säätelijöissä säätelevät myös stressinsietokykyä. Näihin kuuluvat oksitosiini, aivoista peräisin oleva neurotrofinen tekijä (BDNF) ja neuropeptidi Y (NPY). Oksitosiinilla on merkitystä sosiaalisen käyttäytymisen ja stressireaktioiden säätelyssä. BDNF on ratkaisevan tärkeä neuroplastisuuden ja kognitiivisten toimintojen ylläpitämisessä stressitilanteessa, ja NPY moduloi ahdistusta ja fysiologista stressivastetta. Nämä molekyylit vaikuttavat kollektiivisesti hermopiireihimme ja psykologiseen joustavuuteen, mikä antaa tietoa stressinsietokyvyn yksilöllisistä eroista ja mahdollisista keinoista yksilöllistämiseksi. biohakkerointi strategioita.
Oksitosiini
Oksitosiinia kutsutaan usein "rakkaushormoniksi", koska sillä on tärkeä rooli sosiaalisessa sitoutumisessa, äidillisessä käyttäytymisessä ja läheisyydessä. Sillä on myös anksiolyyttisiä vaikutuksia ja se vaikuttaa sosiaaliseen kognitioon ja käyttäytymiseen.
- Geneettinen vaikutus: Oksitosiinireseptorigeenin (OXTR) vaihtelut on yhdistetty tunteiden säätelyyn, sosiaaliseen käyttäytymiseen ja stressiin reagoimiseen. OXTR:n spesifiset polymorfismit voivat vaikuttaa oksitosiinireseptorien sitoutumistehokkuuteen ja ilmentymistasoihin, mikä voi vaikuttaa yksilön kykyyn käsitellä stressiä ja muodostaa sosiaalisia suhteita.(28)
- Vaikutukset: OXTR-varianttien arviointi resilienssitestauksen yhteydessä voi antaa tietoa yksilön taipumuksesta sosiaaliseen ahdistuneisuuteen, empatiatasosta ja potentiaalisesta stressinsietokyvystä, erityisesti stressin, johon liittyy sosiaalista dynamiikkaa.(29)
Aivoista peräisin oleva neurotrofinen tekijä (BDNF).
BDNF on keskeinen proteiini, joka osallistuu neuroplastisuuteen eli aivojen kykyyn järjestäytyä uudelleen ja muodostaa uusia hermoyhteyksiä koko elämän ajan. Se on kriittinen oppimisen, muistin ja neuronien uudistumisen kannalta.(30)
- Geneettiset muunnokset: BDNF-geenin variantti Val66Met on yksi tutkituimmista polymorfismeista. Met-alleeli on yhdistetty BDNF:n vähentyneeseen aktiivisuudesta riippuvaan eritykseen, mikä saattaa vaikuttaa kognitiivisiin toimintoihin ja vastustuskykyyn neurologisia ja psykiatrisia häiriöitä kohtaan.(31)
- Vaikutukset: BDNF-geenivarianttien testaaminen voisi auttaa ennustamaan yksilön kykyä neuroplastisuuteen stressin vaikutuksesta, ja sillä voisi olla vaikutuksia neurologisista loukkauksista tai traumoista toipumiseen.(32)
Kuva: Esimerkkisivu DNA Resilience -testin analyysi.
Neuropeptidi Y (NPY)
NPY on yksi aivojen runsaimmista peptideistä, ja se osallistuu stressireaktioiden, ahdistuksen ja ruoan saannin säätelyyn. Sitä pidetään endogeenisena anksiolyyttisenä aineena.
- Geneettiset yhteydet: NPY-geenin polymorfismit voivat johtaa eroihin NPY:n ilmentymisessä ja erittymisessä, mikä saattaa vaikuttaa yksilön stressinsietokykyyn. Korkeammat NPY-pitoisuudet suojaavat yleensä stressin vaikutuksilta.
- Vaikutukset NPY-geenin varianttien geneettinen testaus voi mahdollisesti osoittaa yksilön stressinsietokykyä ja ennustaa psykologista vastetta krooniseen stressiin ja traumaan.(33)
Epigenetiikan rooli stressinsietokyvyn moduloinnissa
Epigenetiikan tutkimusala epigenetiikka syventyy staattisen DNA-sekvenssin ylittävään monimutkaisuuteen. Epigeneettiset muutokset koostuvat DNA:n rakenteen kemiallisista muutoksista, kuten metylaatiosta ja histonimuutoksista, jotka voivat vaikuttaa siihen, miten geenit ilmenevät muuttamatta taustalla olevaa geneettistä koodia. Nämä muutokset ovat dynaamisia ja reagoivat ympäristöärsykkeisiin, kuten krooniseen stressiin. Pitkäaikainen stressi voi johtaa epigeneettisiin muutoksiin, jotka vaikuttavat stressivasteeseen osallistuvien geenien toimintaan, jolloin yksilöiden on mahdollisesti vaikeampi käsitellä uusia stressitekijöitä tehokkaasti.(34-35)
Henkilökohtaisen lääketieteen eturintamassa olevat yritykset ovat nyt mukana epigenetiikassa ja pyrkivät selvittämään, miten nämä muutokset voivat vaikuttaa yksilön kykyyn kestää stressiä ja toipua siitä. Analysoimalla epigeneettisiä merkkiaineita tutkijat voivat saada tietoa geeniekspressioprofiilien nykytilasta, joka on seurausta sekä geneettisestä alttiudesta että ympäristövaikutuksista. Tällaisilla testeillä voidaan tunnistaa epigeneettiset muutokset kroonisen stressin seurauksena, jolloin saadaan tilannekuva molekyylimekanismeista, jotka vaikuttavat yksilön stressireaktioon tai sen puuttumiseen.
Lisäksi näiden epigeneettisten muutosten ymmärtäminen avaa mahdollisuuden yksilöllisiin interventioihin. Haitallisten epigeneettisten muutosten kumoamiseksi voidaan suositella erityisiä elämäntapamuutoksia, ruokavalion mukauttamista ja terapeuttisia strategioita. Tämä yksilöllinen lähestymistapa ei ainoastaan paranna yksilön sietokykyä, vaan myös edistää laajempaa ymmärrystä siitä, miten stressi vaikuttaa biologisiin järjestelmiimme epigeneettisellä tasolla, mikä voi johtaa uusiin hoitoihin ja ennaltaehkäiseviin strategioihin stressiin liittyviä häiriöitä vastaan. Kartoittamalla stressireaktion epigeneettistä maisemaa voimme alkaa hahmottaa kattavampaa kuvaa tekijöistä, jotka vaikuttavat ainutlaatuiseen kykyymme selviytyä elämän haasteista.
Resilienssi-DNA-testien hyödyt ja rajoitukset
Nämä testit voivat tarjota yksilöille paremman ymmärryksen heidän synnynnäisestä sietokyvystään ja stressivasteestaan. Tällainen tieto voi antaa tietoa yksilöllisistä strategioista stressin hallitsemiseksi ja mielenterveyden parantamiseksi. On kuitenkin tärkeää suhtautua näihin testeihin varovaisesti:
- Complex Trait: Se on monimutkainen ominaisuus, johon vaikuttavat monet geenit ja ympäristötekijät.
- Ympäristön vaikutus: Genetiikka ei toimi eristyksissä. Elämänkokemuksilla, tukijärjestelmillä ja elämäntapavalinnoilla on merkitystä sietokyvyn kannalta.
- Ennustusvoima: Vaikka nämä testit voivat antaa tietoa, ne eivät ole lopullisia ennusteita yksilön kyvystä selviytyä elämän haasteista.
Johtopäätös
Sietokykyyn liittyvät DNA-testit edustavat mielenkiintoista ulottuvuutta sen ymmärtämisessä, miten geneettinen perimämme saattaa vaikuttaa kykyyn käsitellä stressiä ja toipua vastoinkäymisistä. Vaikka ne voivat tarjota arvokkaita tietoja, niitä olisi pidettävä vain yhtenä palana yksilön sietokyvyn muodostamassa valtavassa palapelissä. Kaikille näistä testeistä kiinnostuneille suositellaan neuvonpitoa terveydenhuollon tarjoajan tai geneettisen neuvojan kanssa, jotta he voivat tulkita tuloksia laajemmassa yhteydessä terveytensä ja elämäntapansa kanssa.
- Hanki Integral DNA -testisi täältä!
- Varaa konsultaatio laboratorio- ja geenitestien tulkitsemiseksi tohtori Sovijärven kanssa täältä.
Tieteelliset referenssit:
- Bobrow, M., & Grimbaldeston, A. H. (2000). Lääketieteellinen genetiikka, ihmisen genomiprojekti ja kansanterveys: Esitelty Liverpoolin yliopistossa 9. joulukuuta 1996 ja hyväksytty julkaistavaksi 17. helmikuuta 2000. Journal of Epidemiology & Community Health, 54(9), 645-649.
- Cicchetti, D. (2010). Resilienssi äärimmäisessä stressissä: monitasoinen näkökulma. World Psychiatry, 9(3), 145.
- Luecken, L. J., & Gallo, L. C. (toim.). (2008). Handbook of physiological research methods in health psychology. Sage.
- Southwick, S. M., Vythilingam, M., & Charney, D. S. (2005). Masennuksen psykobiologia ja stressinsietokyky: vaikutukset ennaltaehkäisyyn ja hoitoon. Annu. Rev. Clin. Psychol., 1, 255-291.
- Michaud, M., Balardy, L., Moulis, G., Gaudin, C., Peyrot, C., Vellas, B., ... & Nourhashemi, F. (2013). Proinflammatoriset sytokiinit, ikääntyminen ja ikään liittyvät sairaudet. Journal of the American Medical Directors Association, 14(12), 877-882.
- Aguilera, G., Nikodemova, M., Wynn, P. C., & Catt, K. J. (2004). Kortikotropiinia vapauttavan hormonin reseptorit: kaksi vuosikymmentä myöhemmin. Peptides, 25(3), 319-329.
- Subbannayya, T., Balakrishnan, L., Sudarshan, G., Advani, J., Kumar, S., Mahmood, R., ... & Prasad, T. K. (2013). Integroitu kartta kortikotropiinia vapauttavan hormonin signalointireitistä. Journal of cell communication and signaling, 7, 295-300.
- Binder, E. B. (2009). FKBP5:n, glukokortikoidireseptorin ko-kapersonin rooli affektiivisten ja ahdistuneisuushäiriöiden patogeneesissä ja hoidossa. Psychoneuroendocrinology, 34, S186-S195.
- Ising, M., Depping, A. M., Siebertz, A., Lucae, S., Unschuld, P. G., Kloiber, S., ... & Holsboer, F. (2008). FKBP5-geenialueen polymorfismit moduloivat psykososiaalisesta stressistä toipumista terveillä kontrolleilla. European Journal of Neuroscience, 28(2), 389-398.
- Vitellius, G., Trabado, S., Bouligand, J., Delemer, B., & Lombès, M. (2018, kesäkuu). Glukokortikoidisignaloinnin patofysiologia. In Annales d'endocrinologie (Vol. 79, No. 3, pp. 98-106). Elsevier Masson.
- Van West, D., Van Den Eede, F., Del-Favero, J., Souery, D., Norrback, K. F., Van Duijn, C., ... & Claes, S. (2006). Glukokortikoidireseptorigeeniin perustuva SNP-analyysi potilailla, joilla on toistuva vakava masennus. Neuropsykofarmakologia, 31(3), 620-627.
- Schneider, K. K., Frings, C., Meyer, J., & Schote, A. B. (2016). Glukokortikoidireseptorigeenin (NR3C1) rooli vastenmielisten ärsykkeiden käsittelyssä. Neuroscience Research, 107, 8-13.
- Azadmarzabadi, E., Haghighatfard, A., & Mohammadi, A. (2018). Matala stressinsietokyky liittyy dopaminergisen signalointireitin kandidaattigeenien ilmentymismuutoksiin. Psychogeriatrics, 18(3), 190-201.
- Heinz, A., & Smolka, M. N. (2006). Katekoli O-metyylitransferaasin genotyypin vaikutukset affektiivisten ärsykkeiden ja kognitiivisten tehtävien aikaansaamaan aivojen aktivaatioon. Reviews in the Neurosciences, 17(3), 359-368.
- Mier, D., Kirsch, P., & Meyer-Lindenberg, A. (2010). COMT:n geneettisen variaation pleiotrooppisen vaikutuksen hermostolliset substraatit: meta-analyysi. Molecular psychiatry, 15(9), 918-927.
- Mustapic, M., Maihofer, A. X., Mahata, M., Chen, Y., Baker, D. G., O'Connor, D. T., & Nievergelt, C. M. (2014). Katekoliamiinin biosynteettisen entsyymin dopamiini β-hydroksylaasi (DBH): ensimmäinen genominlaajuinen haku paikoista, joissa ominaisuutta määrittävät variantit vaikuttavat additiivisesti proksimaalisessa promoottorissa. Human molecular genetics, 23(23), 6375-6384.
- Vincent, S., & Robertson, D. (2002). Laajempi näkökulma: katekoliamiinipoikkeavuudet. Clinical Autonomic Research, 12, I44-I49.
- Hoenicka, J., Aragüés, M., Ponce, G., Rodríguez-Jiménez, R., Jiménez-Arriero, M. A., & Palomo, T. (2007). Dopaminergisistä geeneistä psykiatrisiin häiriöihin. Neurotoxicity research, 11, 61-71.
- Hill, S. Y., Hoffman, E. K., Zezza, N., Thalamuthu, A., Weeks, D. E., Matthews, A. G., & Mukhopadhyay, I. (2008). Dopaminergiset mutaatiot: Perheen sisäinen assosiaatio ja linkitys moninkertaisissa alkoholiriippuvuusperheissä. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 147(4), 517-526.
- He, Y., Martin, N., Zhu, G., & Liu, Y. (2018). Uutuuden etsimisen kandidaattigeenit: assosiaatiotutkimusten meta-analyysi: DRD4: eksoni III ja: COMT: Val158Met. Psykiatrinen genetiikka, 28(6), 97-109.
- Avula, R., Rand, A., Black, J. L., & O'kane, D. J. (2011). Ihmisen serotoniinikuljettajageenin useiden polymorfismien samanaikainen genotyypitys ja uusien alleelisten varianttien havaitseminen. Translational psychiatry, 1(8), e32-e32.
- Tivol, E. A., Shalish, C., Schuback, D. E., Hsu, Y. P., & Breakefield, X. O. (1996). Ihmisen MAOA-geenin mutaatioanalyysi. American journal of medical genetics, 67(1), 92-97.
- Waider, J., Araragi, N., Gutknecht, L., & Lesch, K. P. (2011). Tryptofaanihydroksylaasi-2 (TPH2) kognitiivisen kontrollin ja tunteiden säätelyn häiriöissä: näkökulma. Psykoneuroendokrinologia, 36(3), 393-405.
- Bauer, M. E., & Teixeira, A. L. (2021). Neuroinflammaatio mielialahäiriöissä: säätelykykyisten immuunisolujen rooli. Neuroimmunomodulaatio, 28(3), 99-107.
- Anderson, G., Kubera, M., Duda, W., Lasoń, W., Berk, M., & Maes, M. (2013). Lisääntynyt IL-6-transsignaalisignaalinanto masennuksessa: painopiste tryptofaanikataboliittireitillä, melatoniinilla ja neuroprogressiolla. Farmakologiset raportit, 65(6), 1647-1654.
- Perry, B. I., Upthegrove, R., Kappelmann, N., Jones, P. B., Burgess, S., & Khandaker, G. M. (2021). Immunologisten proteiinien/ominaisuuksien yhteydet skitsofreniaan, vakavaan masennukseen ja kaksisuuntaiseen mielialahäiriöön: kaksisuuntainen kahden näytteen mendelin satunnaistamistutkimus. Aivot, käyttäytyminen ja immuniteetti, 97, 176-185.
- Bradley, J. (2008). TNF-välitteinen tulehdussairaus. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 214(2), 149-160.
- Loth, E., Poline, J. B., Thyreau, B., Jia, T., Tao, C., Lourdusamy, A., ... & IMAGEN Consortium. (2014). Oksitosiinireseptorin genotyyppi moduloi ventraalisen striatumin aktiivisuutta sosiaalisiin vihjeisiin ja vasteeseen stressaaviin elämäntapahtumiin. Biologinen psykiatria, 76(5), 367-376.
- Myers, A. J., Williams, L., Gatt, J. M., McAuley-Clark, E. Z., Dobson-Stone, C., Schofield, P. R., & Nemeroff, C. B. (2014). Oksitosiinireseptorigeenin variaatio liittyy lisääntyneeseen ahdistuksen, stressin ja masennuksen riskiin henkilöillä, jotka ovat altistuneet varhaiselämän stressille. Journal of psychiatric research, 59, 93-100.
- Cowansage, K. K., LeDoux, J. E., & Monfils, M. H. (2010). Aivoista peräisin oleva neurotrofinen tekijä: hermoston plastisuuden dynaaminen portinvartija. Current molecular pharmacology, 3(1), 12-29.
- Chen, Z. Y., Jing, D., Bath, K. G., Ieraci, A., Khan, T., Siao, C. J., ... & Lee, F. S. (2006). Geneettinen BDNF (Val66Met) polymorfismi muuttaa ahdistukseen liittyvää käyttäytymistä. science, 314(5796), 140-143.
- Phillips, C. (2017). Aivoperäinen neurotrofinen tekijä, masennus ja fyysinen aktiivisuus: neuroplastisen yhteyden luominen. Neuraalinen plastisuus, 2017.
- Schmeltzer, S. N., Herman, J. P., & Sah, R. (2016). Neuropeptidi Y (NPY) ja posttraumaattinen stressihäiriö (PTSD): translaatiopäivitys. Kokeellinen neurologia, 284, 196-210.
- Lux, V. (2016, maaliskuu). Epigeneettinen ohjelmointi psykobiologisessa kehityksessä: Todisteet kaksoisaktivaatioteoriasta ja varhaisen elämän stressin välittävästä roolista. In Qatar Foundation Annual Research Conference Proceedings Volume 2016 Issue 1 (Vol. 2016, No. 1, p. HBOP3415). Hamad bin Khalifa University Press (HBKU Press).
- Chukwuma Sr, C. (2022). Epigenetiikka ja sen olemus ihmisen kasvun, kehityksen ja sairauksien ymmärtämisessä. J Med Res, 8(5), 165-172.