Mitokondriot ovat elintärkeitä organelleja, jotka sijaitsevat eukaryoottisolujen sytoplasmassa. Hyvin toimivien mitokondrioiden ansiosta kaikki kehon prosessit, liikkumisesta ja liikunnasta ruoansulatukseen ja palautumiseen, toimivat paremmin. Niillä on keskeinen rooli energiantuotannossa ja monissa muissa soluprosesseissa. Mitokondriot tarjoavat paikan oksidatiiviselle fosforylaatiolle, joka tuottaa ATP:tä, solun ensisijaista energianlähdettä. Rakenteellisesti mitokondrioita voidaan arvioida ulkokalvon ja voimakkaasti taitetun sisemmän kalvon kautta, jotka muodostavat niiden aineenvaihdunnan kannalta välttämättömiä lokeroita. Energiantuotannon ohella mitokondriot suorittavat apoptoosin (ohjelmoitu kuolema) lisäksi myös muita toimintoja, kuten kalsiumsignaalien välittämistä ja solun aineenvaihdunnan säätelyä, mikä tekee niistä elintärkeitä solun homeostaasin ylläpidon kannalta.
Mitokondrioiden toiminnan perusteet
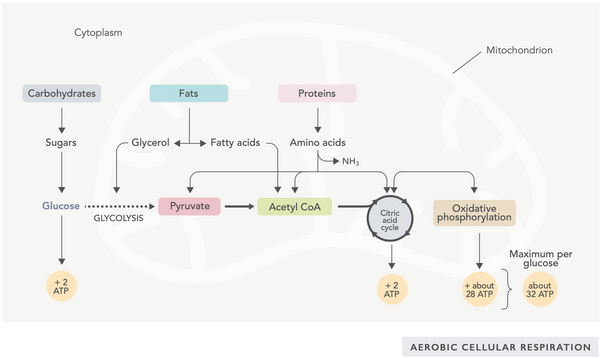
ATP:n tuottaminen (solujen käyttämä ensisijainen energiamolekyyli) on mitokondrioiden toiminnan perusominaisuus. Tämä prosessi tapahtuu kahden tärkeimmän biokemiallisen reitin kautta: sitruunahappokierto (TCA-kierto tai Krebsin kierto) ja elektroninsiirtoketju (ETC).
Sitruunahappokierto
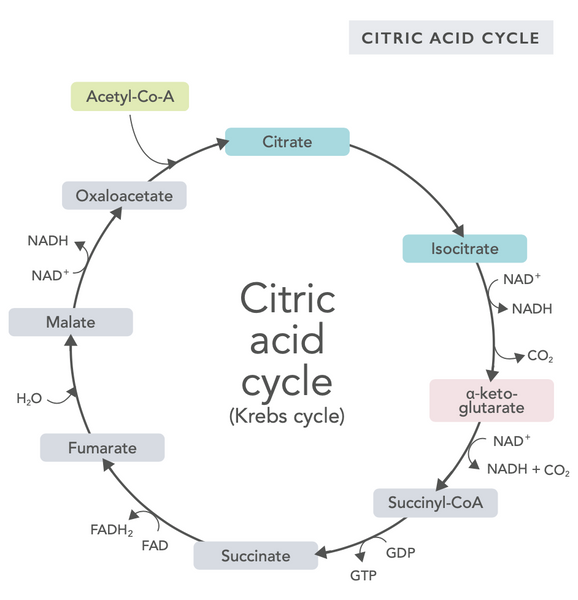
Sitruunahappokierto eli Krebsin sykli (nimetty Nobel-palkitun Hans Adolf Krebsin mukaan, joka löysi sen) tapahtuu solun mitokondrioissa.(1)Sitruunahappokierron ensisijainen aineenvaihduntayhdiste on rasvahapoista, hiilihydraateista ja proteiineista tuotettu etikkahappo (asetyylikoentsyymi A).(2)
Sitruunahappokierron eri reaktioissa (ks. kuva) muodostuu vetyioneja ja elektroneja, jotka sitten siirretään mitokondrioiden sisäiseen kalvoon hapettavaa fosforylaatiota (energian sitominen ATP-molekyyleiksi hapettamalla) ja elektroninsiirtoketjua varten. Reaktio vapauttaa NADH:ta ja pieniä määriä ATP:tä ja hiilidioksidia.
Sitruunahappokiertoon kuuluu kymmenen vaihetta, joista kuhunkin vaikuttavat B-vitamiinit, tietyt kivennäisaineet, kuten magnesium ja rauta, sekä maksan tärkein antioksidantti glutationi. Reaktioita estävät raskasmetallit, kuten elohopea, arseeni ja alumiini.
Energiarikkaat NADH-molekyylit kaappaavat suurimman osan sitruunahappokierron aikana syntyvästä energiasta. Jokaista asetyylikoentsyymi A -molekyyliä kohti syntyy kolme NADH-molekyyliä, jotka käytetään energiaksi seuraavassa reaktiossa (oksidatiivinen fosforylaatio).
Sitruunahappokierron säätely määräytyy eri aminohappojen saatavuuden ja takaisinkytkentäisen eston mukaan (jos esimerkiksi NADH:ta tuotetaan liikaa, useat sitruunahappokierron entsyymit estyvät, mikä hidastaa reaktioita).
Oksaloasetaatti on yhdiste, joka täyttää äkillisen energiantuotannon tarpeen (esimerkiksi aivoissa tai lihaksissa). Oksaloasetaattilisän nauttiminen voi olla hyödyllistä, ja se voi jopa lisätä mitokondrioiden uusiutumista aivoissa, vähentää elimistön hiljaista tulehdusta ja lisätä hermosolujen määrää.(3)
Yksinkertaisesti sanottuna keho sisältää nerokkaita järjestelmiä, jotka muuttavat kulutetun ruoan elektroneiksi, joita käytetään energiana erilaisiin tarpeisiin.
Hapettava fosforylaatio
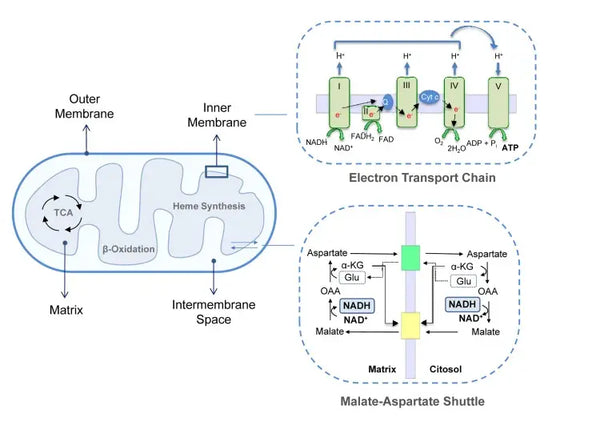
Oksidatiivinen fosforylaatio koostuu elektroninkuljetusketjusta ja ATP-syntaasista. Oksidatiivinen fosforylaatio tuottaa eniten energiaa aerobisissa olosuhteissa (ATP). Se on jatkoa sitruunahappokierrolle.
Elektroninkuljetusketjussa vetyioneja (H+) vapautuu mitokondrioiden kalvoväliin. Kalvojen välisestä tilasta vapautuvat vetyionit siirtyvät takaisin mitokondrioon ATP-syntaasin kautta. Käyttämällä prosessissa vapautuvaa energiaa ATP-syntaasi muuttaa energiaksi käytetyn ADP:n jälleen ATP:ksi.
Ubikinoni (koentsyymi Q10) osallistuu elektronien kuljetusketjuun. Sitä on käytetty vuosikymmeniä ravintolisänä. Alhaiset solujen ubikinonitasot voivat olla altistava tekijä erilaisille sairauksille, jotka johtuvat solujen riittämättömästä aerobisesta energiantuotannosta. Lisäksi kolesterolilääkkeiden (statiinien) käyttö on ubikinonin puutetta edistävä tekijä.(4)
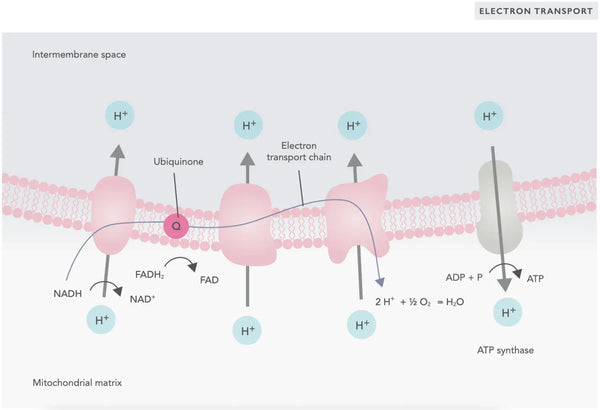
Tämä koordinoitu reaktiosarja tuottaa ATP:tä ja luo protonigradientin mitokondrioiden sisemmän kalvon poikki. kemiosmoosi. Tähän gradienttiin varastoitunut energia ohjaa ATP:n synteesiä, mikä yhdistää elektronien virtauksen ETC:n läpi soluenergian tuottamiseen.(5)
Mitokondrioiden tehokkuuteen vaikuttavat tekijät
Mitokondrioiden tehokkuuteen, joka on luonnollisesti elintärkeä solujen optimaalisen toiminnan kannalta, vaikuttavat monet tekijät. Seuraavassa kuvataan tärkeimmät niistä.
Geneettinen koostumus
Mitokondrioilla on erillinen ja yksilöllinen DNA (mitokondrion DNA, mtDNA), joka eroaa ydin-DNA:sta. MtDNA koodaa elektroninkuljetusketjun keskeisiä komponentteja ja mitokondrioiden proteiineja. Mutaatiot mtDNA:ssa voivat johtaa proteiinien toimintahäiriöihin, jotka häiritsevät elektroninkuljetusketjua ja ATP-synteesiä. Nämä voivat johtaa vähentyneeseen energiantuotantoon ja lisääntyneeseen reaktiivisten happilajien (ROS) muodostumiseen, mikä edistää mitokondrioiden ja solujen toimintahäiriöitä.(6)
Hapettava stressi
Mitokondriot ovat merkittävä ROS:ien lähde, jotka ovat hapen aineenvaihdunnan sivutuotteita. Vaikka matalat ROS-pitoisuudet toimivat solujen viestinvälityksessä, liialliset ROS-pitoisuudet voivat aiheuttaa oksidatiivisia vaurioita mitokondrioiden proteiineille, lipideille ja DNA:lle. Tämä oksidatiivinen stressi vaarantaa mitokondrioiden eheyden ja toiminnan, estää ATP:n tuotannon ja johtaa ROS:n lisätuotantoon haitallisessa kierrossa. Antioksidanttipuolustuksella, kuten superoksididismutaasilla ja glutationiperoksidaasilla, on ratkaiseva rooli tämän vahingon lieventämisessä.(7-8)
Ravinteiden saatavuus
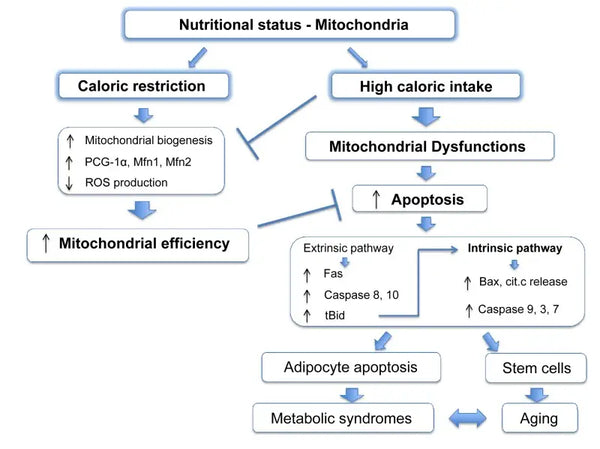
Mitokondriot tarvitsevat tiettyjä substraatteja energiantuotantoon. Glukoosi ja rasvahapot ovat ensisijaisia lähteitä ATP:n tuottamiseen glykolyysin ja β-oksidaation avulla. Näiden substraattien saatavuus vaikuttaa suoraan mitokondrioiden toimintaan. Esimerkiksi ravinteiden ylijäämässä, kuten glukoosin suuressa saatavuudessa, mitokondriot voivat tuottaa liikaa ATP:tä ja ROS:ää, mikä voi johtaa aineenvaihdunnan häiriöihin.(9-10)
Ravintoaineiden niukkuus taas voi rajoittaa mitokondrioiden energiantuotantoa, mikä vaikuttaa solujen toimintaan ja eloonjäämiseen. Toisin kuin eräissä eläinkokeissa on raportoitu kalorien rajoittamisen hyödyistä mitokondrioiden biogeneesiin, näyttää siltä, että se ei lisää mitokondrioiden biogeneesiä. Se kuitenkin säilyttää mitokondrioiden toiminnan suojelemalla olemassa olevien solukomponenttien eheyttä ja toimintaa.(11-12)
Elämäntapatekijät
Liikunta
Liikunta vaikuttaa mitokondrioiden määrään ja laatuun. Liikunta stimuloi mitokondrioiden biogeneesiä, mikä johtaa mitokondrioiden tiheyden ja energiantuotannon tehokkuuden lisääntymiseen.(13) Erityisesti kestävyysharjoittelu lisää mitokondrioiden hapetuskapasiteettia, mikä parantaa niiden kykyä hyödyntää happea ATP:n tuottamiseen (lue lisää yksityiskohtaisesti myöhemmin artikkelissa).
Ruokavalio
Ruokavalion komponentit vaikuttavat merkittävästi mitokondrioiden toimintaan. Makroravintosisällöt, kalorien saanti ja tietyt ravintoaineet (kuten antioksidantit, vitamiinit ja kivennäisaineet) vaikuttavat mitokondrioiden aineenvaihduntaan. Mitokondriotoimintaa tukevia ravintoaineita runsaasti sisältävä ruokavalio voi tehostaa energiantuotantoa ja vähentää hapetusstressiä (ks. myöhemmin). Aktivointi ketoosi voi myös lisätä mitokondrioiden biogeneesiä ja parantaa mitokondrioiden tehokkuutta.(14-15)
Ympäristötekijät
Altistuminen ympäristön stressitekijöille, kuten myrkkyille, saasteille, raskasmetalleille (esim. lyijy, elohopea, arseeni ja kadmium) ja säteilylle, voi vaikuttaa haitallisesti mitokondrioiden toimintaan. Nämä stressitekijät voivat aiheuttaa oksidatiivisia vaurioita, häiritä elektroninsiirtoketjun toimintaa ja heikentää mitokondrioiden dynamiikkaa, mukaan lukien fuusio- ja fissioprosessit.(16)
Teknologiset interventiot
Fotobiomodulaatio (tai punavalohoito)
Fotobiomodulaatio on ionisoimattoman fotonienergian hyödyntämistä fotokemiallisten muutosten aikaansaamiseksi fotoneille vastaanottavissa solurakenteissa, erityisesti mitokondrioissa. Punaisen valon ja NIR-valohoidon uskotaan toimivan pääasiassa valon akseptorien kautta. Punaisen valon aallot läpäisevät ihon ja pääsevät solun mitokondrioihin, mikä lisää solujen energiantuotantoa. Tähän johtavat erilaiset tapahtumat, esimerkiksi mitokondrioiden hengityksen kiihtyminen sytokromi-c-oksidaasin kautta(17). Lue fotobiomodulaation terveyshyödyistä täältä.
Infrapunasauna
Infrapunasaunoissa käytetään infrapunasäteilyä, joka lämmittää kehon kudoksia suoraan ilman sijaan. Infrapunasaunojen lähettämän säteilyn taajuus on 3-12 μm, mikä kuuluu kaukoinfrapunaan (FIR). Kaukoinfrapunavalolla on todettu olevan kudostason vaikutuksia erityisesti mitokondrioiden hengitysketjuun solujen energiantuotantoprosessissa ja kudosten verenkiertoon laajentamalla verisuonia ja parantamalla verenkiertoa.(18)
Pulssimuotoinen sähkömagneettinen kenttä (PEMF) Hoito.
PEMF-terapiassa käytetään sähkömagneettisia kenttiä edistämään erilaisia fysiologisia prosesseja. Tutkimusten mukaan PEMF voi parantaa mitokondrioiden toimintaa lisäämällä solujen hapenkulutusta ja tehostamalla ATP:n tuotantoa. PEMF-hoito vaikuttaa suoraan mitokondrioihin ja palauttaa solut terveempään energia- ja sähkövaraustilaan.(19-20) Lue kattava opas PEMF-hoidosta täältä.
Ylipainehappihoito (HBOT)
HBOT tarkoittaa puhtaan hapen hengittämistä paineistetussa ympäristössä. Ylipainehappihoidon on kliinisesti todistettu elvyttävän mitokondrioita ja lisäävän ATP:n muodostumista tarjoamalla soluhengitykseen tarvittavia suprafysiologisia määriä happea. Tuoreessa tutkimuksessa raportoitiin, että HBO lisäsi mitokondrioiden biogeneesiä ja autofagiaa lisäämällä osittain reaktiivisten happilajien tuotantoa. Tämä prosessi tuotti uusia terveitä mitokondrioita, ja vanhat toimimattomat mitokondriot tuhoutuivat. Tässä tutkimuksessa havaittiin myös mitokondrioiden DNA:n transkription ja replikaation lisääntynyt aktivoituminen.(21-22) Lue lisää HBOT:sta täältä.
Mitokondriotoiminnan ravitsemuksellinen ja täydentävä tuki
Ravitsemuksen merkitys mitokondrioiden terveyden ylläpitämisessä on keskeinen, ja tietyt ravintoaineet ovat erityisen tärkeitä mitokondrioiden optimaalisen toiminnan kannalta. Näihin kuuluvat seuraavat alla luetellut ravintoaineet.
- Koentsyymi Q10 (CoQ10): Ubikinoni on rasvaliukoinen ja muistuttaa vitamiinia. Ubikinoni toimii elektronin kuljettajana mitokondrioiden elektroninsiirtoketjussa (ks. kuva oikealla) ja edistää ATP:n erittymistä. Ubikinonipitoisuudet pienenevät eri kudoksissa ikääntymisen myötä.(23)
- Magnesium: Osallistuu ATP-synteesiin ja on ratkaisevan tärkeä mitokondrioiden eheyden ja toiminnan ylläpitämiseksi.(24)
- B-vitamiinit: B1 (tiamiini), B2 (riboflaviini), B3 (niasiini), B5 (pantoteenihappo), B6, B7 (biotiini) ja B12. Nämä B-vitamiinit ovat ratkaisevan tärkeitä mitokondrioiden energia-aineenvaihdunnan eri osa-alueille.(25)
- Alfa-lipoiinihappo: ALA on voimakas antioksidantti, joka auttaa myös uusiutumaan muita antioksidantteja. Sillä on merkitystä energia-aineenvaihdunnassa ja se voi parantaa mitokondrioiden toimintaa.(26)
- Karnitiini (erityisesti asetyyli-L-karnitiini): Kuljettaa rasvahappoja mitokondrioihin beeta-oksidaatiota varten, mikä on ratkaisevan tärkeää energiantuotannolle erityisesti lihassoluissa.(27)
- Kreatiini: Kreatiini on elimistössä luonnostaan esiintyvä yhdiste, joka auttaa tuottamaan energiaa soluille, erityisesti lihassoluille, lisäämällä adenosiinitrifosfaatin (ATP) muodostumista. Kreatiinilisäys voi parantaa mitokondrioiden tehokkuutta erityisesti korkean intensiteetin harjoituksissa.(28)
- Pyrrolokinoliinikinoni (PQQ): PQQ on antioksidantti, joka lisää mitokondrioiden biogeneesiä PGC-1-proteiinipitoisuuden kautta ja tukee mitokondrioiden toimintaa.(29)
- Omega-3-rasvahapot (EPA ja DHA): Omega-3-rasvahapot ovat välttämättömiä mitokondriokalvojen nestemäisyyden ja toiminnan ylläpitämiseksi. Niitä on pääasiassa kalaöljyssä ja rasvaisissa kaloissa.(30)
- Nikotiiniamidi-ribosidi (NR) ja Nikotiiniamidi-mononukleotidi (NMN): Nämä NAD+:n esiasteet ovat välttämättömiä mitokondrioiden toiminnalle ja energiantuotannolle. NR:n tai NMN:n lisääminen voi auttaa nostamaan NAD+-tasoja ja siten parantamaan mitokondrioiden tehokkuutta.(31) Lue lisää NAD+:n optimoinnista täältä.
- Kurkumiini: Kurkumiini on kurkuman aktiivinen yhdiste. Sen on osoitettu suojaavan mitokondrioita hapettumisvaurioilta ja parantavan niiden toimintaa.(32)
- Seleeni: Välttämätön hivenaine, jolla on merkitystä mitokondrioiden suojaamisessa hapettumisstressiltä. Seleeni myös säätelee mitokondrioiden biogeneesiä.(33)
Liikunta ja mitokondrioiden biogeneesi
Säännöllinen liikunta on kriittinen tekijä mitokondrioiden biogeneesin edistämisessä, mikä johtaa uusien mitokondrioiden syntyyn, mikä lisää niiden määrää ja toimintakykyä soluissa. Eri liikuntamuodoilla on erilaiset vaikutukset mitokondrioiden dynamiikkaan. Kaksi tärkeintä liikuntamuotoa ovat aerobinen harjoittelu ja kestävyysharjoittelu.
Aerobinen harjoittelu
Mitokondrioiden tiheys luurankolihassoluissa lisääntyy huomattavasti aerobisen liikunnan aikana (esim. juoksu, pyöräily ja uinti).
Mitokondrioiden biogeneesiä säätelee PGC-1α (peroksisome proliferaattori-aktivoitu reseptor gamma koaktivaattori 1-alfa), joka on olennainen säätelijäproteiini, jonka ilmentymistä aerobinen liikunta stimuloi. PGC-1α koaktivaatio aktivoi ydinvoimatekijöitä (NRF) ja mitokondriaalista transkriptiotekijää A (TFAM), jotka ovat välttämättömiä mtDNA:n transkriboimiseksi ja mitokondrioiden monistamiseksi. Tämä johtaa lisääntyneeseen oksidatiivisen fosforylaation tehokkuuteen, parempaan kestävyyteen ja suurempaan ATP:n tuotantoon lihassoluissa.(34)
Korkean intensiteetin intervalliharjoittelu (HIIT) on erityisen tehokasta mitokondrioiden määrän ja maksimaalisen hapenottokyvyn (VO2max) lisäämiseen.(35-36)
Vastusharjoittelu
Mitokondrioiden toiminta ja tehokkuus ovat kestävyysharjoittelun (esim. painonnosto ja kehonpainoharjoitukset) ensisijaisia tavoitteita. Se laukaisee muutoksia mitokondrioiden proteiinisynteesissä, mikä parantaa nykyisten mitokondrioiden laatua ja tehokkuutta. Voimaharjoittelu lisää myös elektroninsiirtoketjujen ja Krebsin syklin entsyymien tuotantoa, mikä parantaa edelleen solujen ATP-synteesikapasiteettia. Se voi myös lisätä mitokondrioiden määrää ja kokoa lihassoluissa, vaikkakaan ei samassa määrin kuin aerobinen harjoittelu.(37-38)
Näiden liikuntamuotojen yhteisvaikutus mitokondrioiden biogeneesiin ja toimintaan korostaa liikunnan merkitystä mitokondrioiden terveyden ylläpitämisessä ja parantamisessa. Säännöllinen aerobinen ja kestävyysharjoittelu parantaa kokonaisvaltaisesti solujen mitokondrioiden tiheyttä, tehokkuutta ja energia-aineenvaihduntaa. Nämä mukautukset ovat ratkaisevia urheilusuorituksen kannalta, ja niillä on merkitystä terveyden ylläpitämisessä, sairauksien ehkäisyssä ja mitokondrioiden toimintahäiriöihin liittyvien sairauksien hallinnassa.
On kuitenkin huomattava, että sekä voimaa että kestävyyttä koskeva samanaikainen harjoittelu johtaa vähäisempään sopeutumiseen, koska proteiinikinaasit PKB ja AMPK estävät toistensa downstream-signalointia, mikä estää samanaikaisen harjoittelun vaikutuksen.(39)
Mitofagia ja solujen terveys
Mitofagialla tarkoitetaan valikoivaa autofagian tyyppiä, jolla on olennainen rooli solutiloissa, koska se pystyy hajottamaan vain vahingoittuneet tai toimimattomat mitokondriot. Tämä mekanismi on ratkaisevan tärkeä mitokondrioiden ja solun terveyden kannalta, sillä se estää mRNA:iden, jotka koodaavat viallisia alayksikkökokoonpanoja, syntymisen ja säästää siten solutoimintojen kriiseiltä ja lukuisilta patologioilta.(40)
Vaurioituneiden mitokondrioiden poistaminen mitofagian avulla auttaa vähentämään oksidatiivista stressiä, apoptoosia ja tulehdusta (jotka liittyvät erilaisiin patologioihin). Heikentynyt mitofagia helpottaa toimintahäiriöisten mitokondrioiden kertymistä neurodegeneraatiohäiriöiden, kuten Parkinsonin ja Alzheimerin taudin, patogeneesissä. Vastaavasti aineenvaihduntahäiriöissä mitofagian häviäminen johtaa mitokondrioiden aineenvaihdunnan muutoksiin, mikä johtaa insuliiniresistenssiin ja tyypin 2 diabetekseen.(41-42)
On osoitettu, että kalorien rajoittaminen edistää mitofagiaa. Tämä johtuu osittain sirtuiinien (SIRT1), AMP-aktivoidun proteiinikinaasin (AMPK) ja transkriptiotekijä EB:n aktivoitumisesta, jotka tukevat sekä solujen energiakriisivasteiden että mitofagian käynnistymistä. Erityisesti sirtuiinit säätelevät mitofagikoneiston tekijöiden toimintaa, vaimentamalla vaurioituneita mitokondrioita.(43)
Kalorimäärän rajoittamisen molekulaarisia vaikutuksia jäljittelevät sellaiset yhdisteet kuin resveratroli (punaviinin ja joidenkin marjojen polyfenoli) ja monet muut polyfenolit. Resveratroli edistää SIRT1:n ja AMPK:n aktivoitumista, mikä lisää mitofagiaa, joka vastaa mitokondrioiden toiminnan parantumisesta ja solujen terveyden palauttamisesta.(44-45)
Mitofagiaa voidaan tehostaa ajoittaisella paastolla. Tätä parannusta lieventää todennäköisesti metabolinen siirtyminen glukoosipohjaisesta energiasta ketoonipohjaiseen energiaan paaston aikana, ja tämä siirtyminen laukaisee mitofagian.(46-47)
Mitokondrioiden toimintahäiriö ikääntymisen tunnusmerkkinä.
Sen ymmärtäminen, miten mitokondriot vaikuttavat ikääntymisprosessiin, on gerontologian ja solubiologian tutkimuksen keskiössä. Eliöiden ikääntyessä mitokondrioiden toimintahäiriöt yleistyvät, mikä vaikuttaa ikääntymisen fysiologiseen puoleen.
Ikääntyvissä mitokondrioissa ATP:n tuotanto on vähentynyt, mikä vaikuttaa solujen hyvinvoinnille välttämättömiin energiapohjaisiin prosesseihin. Lisäksi ikääntymiseen liittyvät mitokondrioiden rakenteelliset muutokset, kuten mitokondrioiden kalvopotentiaalin epänormaali koostumus ja mitokondrioiden sisäisen seinämän eheys, häiritsevät vielä enemmän tätä energiatuotannon vähenemistä.(48)
Asento mitokondrioiden DNA:n (mtDNA) asema. lähellä elektroninsiirtoketjua, jossa tapahtuu reaktiivisia happilajeja, vaikuttaa sen alttiuteen mutaatioille. Mutaatiot kuitenkin kasautuvat ajan myötä, mikä johtaa mitokondrioiden toimintahäiriöön. Toisin kuin ydin-DNA, joka on sidottu histoneihin suojaksi ja jolla on käytössään erilaisia korjausmekanismeja, mtDNA:lta puuttuu histonien suojaava päällyste, eikä sillä ole monenlaisia korjausmenetelmiä, joten se voi vaurioitua helposti.(49)
Soluissa mitokondriot tuottavat reaktiivisia happilaatuja (ROS). Vaikka ROS on solulle tärkeä keino kommunikoida ympäristönsä kanssa ja sopeutua siihen, näiden molekyylien suuria määriä on rajoitettu tiukalla valvonnalla. Liiallinen tuotanto erilaisissa ikään liittyvissä tiloissa johtaa siihen, että solut kärsivät hapetusstressistä. Se tuhoaa solun eri osia, olivatpa ne sitten proteiineja, lipidejä tai DNA:ta. Mitokondriot ovat jopa hapettumisvaurioiden ensisijainen vastaanottaja, mikä luo noidankehän, sillä vaurioituneet mitokondriot tuottavat vain lisää ROS:ia ja lisäävät näin solujen soluvaurioita. senesenssiä.(50-52)
Mitokondrioiden dynamiikka on ratkaisevan tärkeää mitokondrioiden toiminnalle, joka auttaa ylläpitämään fuusio- ja fissioprosessia. Dynamiikka kuitenkin häiriintyy ikääntymisen myötä, ja mitokondriot pirstoutuvat fuusion sijaan. Nämä muutokset vaikuttavat mitokondrioiden toimintaan ja niiden asemaan soluissa.(53)
Mitokondrioiden toiminnan heikkeneminen ei ole passiivinen ikääntymiseen liittyvä ilmiö vaan aktiivinen osallistuja iästä riippuvaisten sairauksien patogeneesissä. Mitokondrioiden toimintahäiriöt on yhdistetty esimerkiksi neurodegeneratiivisiin sairauksiin, sydän- ja verisuonisairauksiin ja aineenvaihduntahäiriöihin. Näissä sairauksissa vähentynyt tai puutteellinen energiantuotanto, lisääntynyt oksidatiivinen stressi ja kyvyttömyys poistaa vaurioituneita mitokondrioita ovat olennaisia tekijöitä taudin patogeneesissä ja kulussa.(54)
Johtopäätös
Mitokondrioterveyden ja sen heikkenemisen optimointi ikääntymisen myötä on haastava tehtävä, mutta onneksi voimme tehdä asialle paljon. Tärkeimpiin toimenpiteisiin kuuluu ravitsemuksellinen tuki uudistumisen kannalta kriittisille substraateille, mukaan lukien koentsyymi Q10, magnesium ja B-vitamiinit; säännöllinen osallistuminen erilaisiin liikuntalajeihin mitokondrioiden biogeneesin lisäämiseksi; ja elintapojen muutokset, kuten kalorien rajoittaminen tai ajoittainen paastoaminen, mitofagian mekanismeihin vaikuttamiseksi.
Koska mitokondrioiden toimintahäiriö on yksi ikääntymiseen vaikuttavista tekijöistä, nämä strategiat ovat välttämättömiä solujen terveyden tukemiseksi ja ikääntymiseen liittyvän hajoamisen torjumiseksi. Integroivat lähestymistavat, joissa hyödynnetään tieteeseen perustuvan tiedon voimaa yhdessä sovellettavien elämäntapamuutosten kanssa, voivat luoda suotuisat olosuhteet ennaltaehkäisyyn ja mitokondrioiden kulumisen hidastamiseen, mikä palvelee yleisesti yksilön hyvinvointia ja pitkäikäisyyttä.
Tieteelliset viitteet
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900-81), modernin lääketieteen pioneeri, välittäjäaineenvaihdunnan arkkitehti. Journal of Medical Biography 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biokemia. Viides painos. Luku 17, Sitruunahappokierto. New York: W. H. Freeman.
- Wilkins, H. et al. (2014). Oksaloasetaatti aktivoi aivojen mitokondrioiden biogeneesiä, tehostaa insuliinireittiä, vähentää tulehdusta ja stimuloi neurogeneesiä. Human Molecular Genetics 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Primaarinen ja sekundaarinen koentsyymi Q10:n puutos: terapeuttisen lisäravinteen merkitys. Nutrition Reviews 71 (3): 180–188. Katsaus.
- Saraste, M. (1999). Hapettava fosforylaatio fin de siecle. Science 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Ihmisen mitokondrioiden tRNA:t: biogeneesi, toiminta, rakenteelliset näkökohdat ja sairaudet. Annual Review of Genetics 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Ovatko mitokondriot tärkein reaktiivisten happilajien aiheuttaja soluissa? Journal of Experimental Biology 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Reaktiiviset happilajit solujen signaloinnissa. American Journal of Physiology - Keuhkojen solu- ja molekyylifysiologia. 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Bioenergian tuotannon mekanismit mitokondrioissa. Mitokondriot ja niiden rooli sydän- ja verisuonitaudeissa. 99–121.
- Bottje, W. (2019). Hapettava aineenvaihdunta ja tehokkuus: mitokondrioiden herkkä tasapainoilu. Siipikarjatiede 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Ravinteiden saatavuus yhdistää mitokondriot, apoptoosin ja lihavuuden. Aging (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). Krooninen kalorien rajoittaminen säilyttää mitokondrioiden toiminnan senesenssissä lisäämättä mitokondrioiden biogeneesiä. Cell Metabolism 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Mitokondrioiden sopeutumisen molekulaariset mekanismit luurankolihaksessa tapahtuvaan harjoitteluun. The FASEB Journal 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Mitokondrioiden biogeneesin säätely. Essays in Biochemistry 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Ketonipohjainen aineenvaihduntaterapia: onko lisääntynyt NAD+ ensisijainen mekanismi? Frontiers in Molecular Neuroscience 10: 377.
- Fowler, B. (1978). Lyijyn, elohopean, kadmiumin ja arseenin yleiset alisoluvaikutukset. Environmental Health Perspectives 22:37-41.
- Hamblin, M. (2018). Mekanismit ja mitokondriaalinen redox-signalointi fotobiomodulaatiossa. Fotokemia ja fotobiologia 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Kaukoinfrapunasäteily (FIR): sen biologiset vaikutukset ja lääketieteelliset sovellukset. Photonics and Lasers in Medicine 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). Sähkömagneettinen stimulaatio lisää mitokondrioiden toimintaa osteogeenisissä soluissa ja edistää luunmurtumien korjautumista. Scientific Reports 11 (1): 19114.
- Tai, Y. et al. (2020). Magneettikentät muokkaavat aineenvaihduntaa ja suolistomikrobiomia korrelaatiossa Pgc-1 alfa-ekspression kanssa: Seuranta in vitro -magneettisen mitohormettitutkimuksen jälkeen. The FASEB Journal 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). Hyperbaarisen hapen vaikutus mitokondriaaliseen ja glykolyyttiseen energia-aineenvaihduntaan: kaloristaasi-käsite. Cell Stress and Chaperones 25 (4): 667-677.
- Chen, W. et al. (2020). Hyperbaarinen happi suojaa sydänlihaksen iskemia-reperfuusiovauriolta estämällä mitokondrioiden toimintahäiriöitä ja autofagiaa. Molecular Medicine Reports 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). Ubikinonin valmistuksen monimutkaisuus. Trends in Endocrinology & Metabolism. 30 (12): 929-943.
- Volpe, S. (2013). Magnesium sairauksien ehkäisyssä ja yleisessä terveydessä. Advances in Nutrition 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O'Brien, P. (2006). Mitokondrioiden toiminta ja toksisuus: B-vitamiiniperheen rooli mitokondrioiden energia-aineenvaihdunnassa. Kemiallis-biologiset vuorovaikutukset 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Lipoiinihapon aineenvaihdunta ja mitokondrioiden redox-säätely. Journal of Biological Chemistry 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Karnitiini ihmisen lihaksen bioenergetiikassa: voiko karnitiinilisä parantaa fyysistä harjoittelua? Molecules 25 (1): 182.
- Wax, B. et al. (2021). Kreatiini liikunnan ja urheilusuorituksen kannalta, palautumiseen liittyviä näkökohtia terveille väestöille. Ravintoaineet 13 (6): 1915.
- Hwang, P. et al. (2020). Pyrrolokinoliinikinonin (PQQ) lisäyksen vaikutukset aerobiseen liikuntasuoritukseen ja mitokondrioiden biogeneesin indekseihin harjoittelemattomilla miehillä. Journal of the American College of Nutrition 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Mitokondriokalvojen koostumukseen ja bioenergetiikkaan vaikuttaminen omega-3-lisäravinteella. The Journal of Physiology 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). Nikotiiniamidi-ribosidi lisää ikääntyneen ihmisen luurankolihaksen NAD + -metabloomia ja indusoi transkriptomisia ja anti-inflammatorisia allekirjoituksia. Cell Reports 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Kurkumiini, mitokondriaalinen biogeneesi ja mitofagia: Viimeaikaisten tietojen tutkiminen ja tulevien tarpeiden osoittaminen. Biotekniikan edistysaskeleet 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Seleeni, mikroravintoaine, joka moduloi sydän- ja verisuoniterveyttä redox-entsymologian kautta. Nutrients 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). PGC-1α:n, mitokondrioiden biogeneesin solmukeskeisen säätelijän, säätely. The American Journal of Clinical Nutrition 93 (4): 884S-890S.
- Helgerud, J. et al. (2007). Aerobiset korkean intensiteetin intervallit parantavat VO2maxia enemmän kuin kohtuullinen harjoittelu. Medicine and Science in Sports and Exercise 39 (4): 665–671.
- Burgomaster, K. ym. (2008). Samankaltaiset metaboliset sopeutumiset harjoituksen aikana pienen volyymin sprinttiintervalliharjoittelun ja perinteisen kestävyysharjoittelun jälkeen ihmisillä. Journal of Physiology 586 (1): 151–160.
- Wilkinson, S. ym. (2008). Syötetyssä tilassa tapahtuvan kestävyys- ja kestävyysharjoittelun erilaiset vaikutukset signaalimolekyylien fosforylaatioon ja proteiinisynteesiin ihmisen lihaksessa. Fysiologian aikakauskirja 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Vastusharjoittelu muuttaa mitokondrioiden toimintaa ihmisen luurankolihaksessa. Medicine and Science in Sports and Exercise 47 (9): 1922-1931.
- Baar, K. (2006). Kestävyys- ja voimaharjoittelu: oppitunteja solusignaalien välityksestä. Medicine & Science in Sports & Exercise 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Mitofagian polut mitokondrioiden laadunvalvontaan ja puhdistukseen. Cell Death & Differentiation 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitokondriot ja autofagia-tulehdus-solukuolema-akseli elimistön vanhenemisessa. Science 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitofagia: lupaava terapeuttinen kohde neuroprotektiossa ikääntymisen ja ikään liittyvien sairauksien aikana. British Journal of Pharmacology 180 (12): 1542-1561.
- Cantó, C. & Auwerx, J. (2011). Kalorien rajoittaminen: onko AMPK keskeinen sensori ja efektori? Physiology 26 (4): 214-224.
- Um, J. et al. (2010). AMP-aktivoidun proteiinikinaasin puutteelliset hiiret ovat resistenttejä resveratrolin metabolisille vaikutuksille. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Viinirypäleestä peräisin olevan antioksidantin ikääntymistä ehkäiseviä ominaisuuksia säätelee mitokondrioiden fuusio- ja fissiotasapaino, joka johtaa mitofagiaan, jonka käynnistää Sirt1-Sirt3-Foxo3-PINK1-PARKIN-signaaliverkosto. Oksidatiivinen lääketiede ja solujen pitkäikäisyys 2014: 345105.
- Longo, V. & Panda, S. (2016). Paasto, vuorokausirytmi ja ajallisesti rajoitettu ruokailu terveessä eliniässä. Cell Metabolism 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I& Sahebkar, A. (2020). Paaston tai kalorimäärän rajoittamisen vaikutus mitofagian induktioon: kirjallisuuskatsaus. Journal of Cachexia, Sarcopenia and Muscle -lehti. 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Oksidatiivinen stressi, mitokondriaalisen DNA:n mutaatio ja antioksidanttientsyymien heikentyminen ikääntymisessä. Experimental Biology and Medicine 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). mtDNA-mutaatiot ja niiden rooli ikääntymisessä, sairauksissa ja rikostutkimuksessa. Aging and Disease 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Reaktiivisten happilajien tuottaminen mitokondrioissa. Antioksidants 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Reaktiiviset happilajit ja mitokondriot: Solujen homeostaasin yhteys. Redox Biology 6: 472-485.
- Correia-Melo, C. et al. (2016). Mitokondrioita tarvitaan senesenssifenotyypin pro-ageing-piirteisiin. The EMBO Journal 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Mitokondrioiden fuusio- ja fissioproteiinit uusina terapeuttisina kohteina sydän- ja verisuonitautien hoidossa. European Journal of Pharmacology 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitofagia: nouseva rooli ikääntymisessä ja ikään liittyvissä sairauksissa. Frontiers in Cell and Developmental Biology. 8: 200.