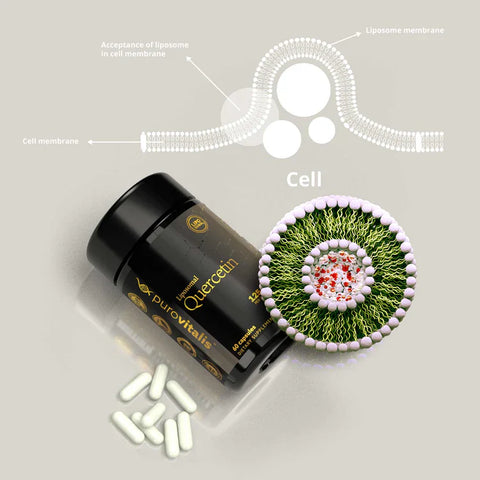
Opi välttämättömät lisäravinteet oppaamme avulla kolmesta tärkeimmästä luonnollisesta senolyytistä, jotka voivat nuorentaa soluja ja parantaa terveyttä. Ikääntyessämme solujen vanheneminen – jolloin solut lakkaavat jakautumasta ja kerääntyvät kehoomme – voi johtaa erilaisiin ikääntymiseen liittyviin sairauksiin. Tietyt luonnolliset yhdisteet on kuitenkin tunnistettu tehokkaiksi senolyyttisiksi aineiksi, jotka pystyvät selektiivisesti puhdistamaan nämä vanhentuneet solut. Tässä artikkelissa tarkastellaan tarkemmin näiden merkittävien aineiden takana olevaa tiedettä ja niiden sisällyttämistä päivittäisiin rutiineihin ikääntymisen uhmaavien terveyshyötyjen saavuttamiseksi.
Johdanto
Ikääntyminen on monimutkainen biologinen prosessi, jolle on ominaista fysiologisen toiminnan asteittainen heikkeneminen ja lisääntynyt alttius sairauksille. Vaikka ikääntymistä on pitkään pidetty väistämättömänä osana elämää, viimeaikaiset biogerontologian edistysaskeleet ovat paljastaneet sen taustalla olevat solu- ja molekyylimekanismit. Solujen vanheneminen on noussut merkittäväksi tekijäksi ikään liittyvissä patologioissa näiden mekanismien joukossa. Se on peruuttamaton kasvupysähdys, jonka laukaisevat erilaiset stressitekijät. (1)
Koska vanhenevien solujen määrä lisääntyy ikääntymisen myötä, on oletettu, että vanheneminen edistää ikääntymistä. Vanhenemista tarvitaan estämään vaurioituneiden solujen leviäminen ja lisääntyminen, mikä laukaisee immuunijärjestelmän vasteen. Tämä solujen tarkistuspiste vaatii tehokkaan solukorvausjärjestelmän, joka sisältää sekä vanhenevien solujen puhdistuman että progenitorisolujen mobilisoinnin optimaalisen solumäärän palauttamiseksi. (2)
Ydin-DNA-vaurion raportoidaan usein olevan yleinen ikääntymisen taustalla oleva syy, pääasiassa DNA:n kaksoisjuostekatkoksia (DSB:t), jotka aktivoivat DNA-vauriovasteen (DDR) -reitin. Pitkittynyt DDR-aktivointi aktivoi vanhenemisen. Yksi tai muutama DDR-signalointitelomeeri (kromosomin pää) riittää laukaisemaan replikatiivisen solun vanhenemisen. Onkogeeniaktivaatio on myös voimakas vanhenemisen laukaisin. (3)
Vanhenevat solut ilmentävät merkittäviä muutoksia erityksessään, joka on erityisen rikastunut proinflammatorisista sytokiineista ja matriksin metalloproteinaaseista. Tästä syystä sitä kutsutaan vanhenemiseen liittyväksi sekretoriseksi fenotyypiksi (SASP) . Vanhenevat solut osoittavat selkeitä fenotyyppisiä muutoksia, kuten litistynyttä morfologiaa, muuttunutta geeniekspressiota ja proinflammatoristen molekyylien eritystä. Vaikka vanheneminen toimii alun perin kasvaimia estävänä mekanismina pysäyttämällä vaurioituneiden solujen lisääntymisen, vanhenevien solujen kertyminen ajan myötä edistää kudosten toimintahäiriöitä ja edistää ikääntymiseen liittyviä sairauksia. (4)
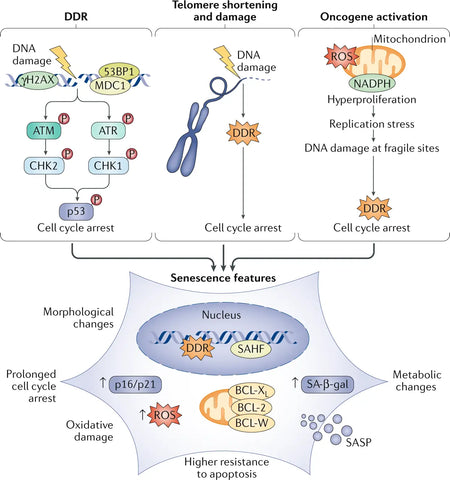
Kuva : Vanhenemisen tekijät ja fenotyypit.
Lähde : Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Solujen vanheneminen ikääntymisessä: mekanismeista terapeuttisiin mahdollisuuksiin. Nature Reviews Molecular Cell Biology 22 (2): 75–95.
Ottaen huomioon vanhenevien solujen haitalliset vaikutukset kudosten homeostaasiin ja terveydenhuoltoon, näiden solujen kohdistaminen on noussut lupaavaksi terapeuttiseksi strategiaksi. Senolyyttiset aineet ovat yhdisteitä, jotka on suunniteltu indusoimaan apoptoosia vanhenevissa soluissa samalla kun säästelevät terveitä soluja selektiivisesti. Niillä on potentiaalia lievittää tulehdusta, tehostaa kudosten uusiutumista ja viivyttää ikään liittyvien patologioiden ilmaantumista. (5)
Senolyyttiset yhdisteet
Lukuisia luonnollisia ja synteettisiä yhdisteitä on tunnistettu mahdollisiksi senolyyttisiksi aineiksi , ja kversetiini (luonnollinen yhdiste) ja dasatinibi (synteettinen huume) edustavat tämän luokan varhaisia ehdokkaita. Kversetiinin ja dasatinibin lisäksi useat muut yhdisteet, mukaan lukien fisetiini, navitoklaksi ja ABT-263, ovat osoittaneet lupaavia senolyyttisiä ominaisuuksia prekliinisissä malleissa. Tämä artikkeli kattaa kolme parasta mahdollista ja lupaavaa luonnollista senolyyttistä ainetta, jotka ovat saatavilla tänään.
Fisetin
Fisetiini on bioaktiivinen flavonoli (polyfenoli), jonka kykyä edistää terveyttä ja pitkäikäisyyttä, lähinnä lieventämällä solujen vanhenemista, on tutkittu huomattavasti. Sitä esiintyy pääasiassa mansikoissa, omenoissa, kakissa, sipulissa, viinirypäleissä ja pieniä määriä kurkussa (katso kuva). Fisetiinillä on useita biologisia aktiivisuuksia, jotka johtuvat sen ainutlaatuisesta molekyylirakenteesta (tasomainen rakenne ja useita hiilirenkaita). (6-7)
Fisetinin ominaisuuksien alustava tutkiminen paljastaa sen tehokkaan antioksidanttikapasiteetin, joka johtuu sen kyvystä poistaa reaktiivisia happilajeja (ROS). Siten sillä on ratkaiseva rooli solujen puolustuksessa oksidatiivista stressiä vastaan. (8)

Kuva : Fisetiinin ravinnon lähteet.
Lähde : Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetiini: ravinnon antioksidantti terveyden edistämiseen. Antioxidants & Redox Signaling 19 (2): 151–162.
Fisetinin senolyyttinen aktiivisuus on pitkäikäisyystutkimuksen ensisijainen painopiste. Solujen vanheneminen on tila, jossa solut lakkaavat lisääntymästä ja kerääntyvät ajan myötä – se liittyy erilaisiin ikääntymiseen liittyviin sairauksiin (katso tarkemmin edellä). Fisetiinin on havaittu indusoivan apoptoosia näissä vanhenevissa soluissa selektiivisesti. Tämän selektiivisen puhdistuman oletetaan lievittävän ikääntymiseen liittyviä fenotyyppejä, mikä myötävaikuttaa ikään liittyvien patologioiden viivästymiseen tai ehkäisyyn. Verrattuna toiseen mahdolliseen senolyyttiseen yhdisteeseen, fisetiini on noin kaksi kertaa tehokkaampi kuin kversetiini (katso myöhemmin artikkelissa). (9-10)
Flavonoidien (kuten fisetiini) prooksidanttiaktiivisuus on tärkeä näkökohta senolyyttien seulonnassa. Vanhenevat solut keräävät suuria määriä kuparia ja rautaa. Kversetiinin tai fisetiinin selektiivinen mekanismi liittyy eksplisiittisesti kuparin/raudan edistämään oksidatiiviseen vaurioon vanhenevissa soluissa, mikä tappaa apoptoosille vastustuskykyisiä soluja. (11)
Fisetiini vaikuttaa myös tärkeisiin solujen signalointireitteihin, jotka ovat olennainen osa ikääntymisprosessia. Se moduloi sirtuiinien (erityisesti SIRT1), mTOR:n (inhibition) ja JAK-STAT/NF-κB:n toimintaa, jotka ovat tärkeitä solujen eloonjäämisen, apoptoosin ja autofagian säätelyssä. Moduloimalla näitä reittejä Fisetin voi teoriassa parantaa solujen toimintaa, vähentää tulehdusta ja ylläpitää kudosten homeostaasia. (12-14)
Fisetiinillä on myös osoitettu olevan hermostoa suojaavia ominaisuuksia. Se lieventää hermosolujen vaurioita ja parantaa kognitiivisia toimintoja ensisijaisesti antioksidanttivaikutuksensa ja hermosolujen signalointireittejä moduloimalla. (15-16)
Näistä lupaavista prekliinisistä löydöistä huolimatta on olennaista tunnustaa, että suurin osa Fisetinin tutkimuksesta on rajoittunut in vitro ja eläinmalleihin. Näiden tulosten muuntaminen ihmisille tarkoitettuihin kliinisiin sovelluksiin edellyttää tiukkoja kliinisiä tutkimuksia Fisetinin tehon, turvallisuuden ja optimaalisen annostuksen varmistamiseksi. Onneksi joitain kliinisiä tutkimuksia on jo tulossa, ja tuloksia pitäisi saada lähivuosina. (17-18)
kvertsetiini
Kvertsetiini on tärkeä antioksidantti, joka on luokiteltu flavonoliksi. Sitä esiintyy luonnollisesti monissa vihanneksissa, hedelmissä, marjoissa, lehdissä ja jyvissä. Kvertsetiiniä löytyy pääasiassa kaprisista, retiisistä, tillistä, korianterista, kaalista, punasipulista, parsakaalista ja marjoista, kuten karpaloista ja puolukoista. Kvertsetiini on yksi merkittävimmistä ja yleisimmistä luonnossa esiintyvistä flavonoleista.

Tutkimukset osoittavat, että kversetiini toimii antiviraalisena, antimikrobisena ja anti-inflammatorisena aineena. (19) Lisäksi tutkimukset osoittivat kversetiinin antihistamiinivaikutuksia, mikä tarkoittaa, että se voi auttaa allergioiden hoidossa. (20-21) Kversetiinin merkittävin vaikutus ihmiskehoon on sen kyky vähentää hiljaista tulehdusta. (22 )
Kversetiinin potentiaali edistää pitkäikäisyyttä voidaan selittää sen antioksidanttisilla ominaisuuksilla. Antioksidanttina kversetiini poistaa vapaita radikaaleja ja vähentää oksidatiivista stressiä kehossa. Tutkimukset ovat osoittaneet, että kversetiini voi aktivoida sirtuiineja (erityisesti SIRT-1), jotka säätelevät soluprosesseja, kuten DNA:n korjausta, geenien ilmentymistä ja aineenvaihduntaa. Sirtuiinien aktivoituminen liittyy eri organismien eliniän pidentämiseen. (23-24)
Kversetiinin on myös osoitettu aktivoivan Nrf2-reittiä, ja soluytimissä se aktivoi erilaisten antioksidanttivasteelementtien (ARE) ohjaamien geenien transkription. Nämä geenit lisäävät sytoprotektiivisten entsyymien, kuten glutationi-S-transferaasin, NAD(P)H-kinonidehydrogenaasi 1:n ja hemioksygenaasi-1:n, ilmentymistä. (25)
Yleensä kversetiinilisät otetaan annoksella 500 mg kahdesti päivässä. Kversetiinin optimaalista annostusta ei kuitenkaan ole vielä määritetty. Kversetiinin suositeltu ravintomäärä on tyypillisesti 5–40 mg päivässä, mutta sitä voidaan käyttää myös huomattavasti suurempia määriä (> 500 mg).
Mitä tulee kversetiiniin, suosittelemme Purovitalisin sen liposomaalista muotoa.
Apigeniini
Apigeniini (4′,5,7,-trihydroksiflavoni) on luonnossa esiintyvä flavonoidiyhdiste useissa kasveissa, mukaan lukien persilja, selleri ja sitrushedelmät. Sitä on erityisen runsaasti kamomillakasvin kukissa. Apigeniinillä on potentiaalia auttaa ehkäisemään kroonisia sairauksia, kuten diabetes, Alzheimerin tauti, masennus, unettomuus ja syöpä, in vivo -tutkimuksessa (eläin- ja ihmistutkimukset) havaittujen etujen avulla. (26)

Yksi apigeniinin lupaavimmista puolista on sen kyky edistää solujen joustavuutta. Apigeniinin on osoitettu aktivoivan Nrf2-reittiä, joka on ratkaisevan tärkeä kehon suojautumisessa oksidatiivista stressiä ja tulehdusta vastaan. Lisäämällä antioksidanttientsyymien, kuten superoksididismutaasin, katalaasin ja glutationiperoksidaasin, ilmentymistä apigeniini auttaa suojaamaan soluja reaktiivisten happilajien (ROS) aiheuttamilta vaurioilta. (27)
Antioksidanttisten ominaisuuksiensa lisäksi apigeniinillä on osoitettu anti-inflammatorisia vaikutuksia. Sen on havaittu estävän proinflammatoristen sytokiinien, kuten TNF-α:n, IL-1β:n ja IL-6:n, tuotantoa moduloimalla NF-KB-signalointireittiä.( 28) Apigeniiniä on myös tutkittu sen mahdollisen anti-vaikutuksen suhteen . - syövän ominaisuudet. Tutkimukset ovat osoittaneet, että apigeniini voi indusoida apoptoosia (ohjelmoitua solukuolemaa) useissa syöpäsolulinjoissa, mukaan lukien rinta-, eturauhas- ja paksusuolensyöpäsolut. Apigeniini edistää myös autofagiaa, mikä auttaa poistamaan dysfunktionaalisia soluelementtejä. (29-30)
Apigeniiniä on myös tutkittu sen kyvystä muokata ikääntymiseen liittyviä reittejä. Yksi tällainen reitti on insuliini/IGF-1-signalointireitti (IIS), jolla tiedetään olevan rooli eliniän säätelyssä eri lajeissa. Apigeniinin on osoitettu estävän IIS-reittiä, mikä mahdollisesti jäljittelee kalorirajoituksen vaikutuksia, mikä on vakiintunut toimenpide pitkäikäisyyden edistämiseksi. (31-32) Lisäksi apigeniini estää NAD+aasi CD38:aa, joka liittyy metaboliseen oireyhtymään, lisää solunsisäisiä NAD+-tasoja ja vähentää globaalia proteiinin asetylaatiota. (33) Mitä tulee vanhenemiseen, erityisesti pigeniini auttaa estämään jäljellä olevia vanhenevia soluja muodostamasta SASP:tä. (vanhenemiseen liittyvä eritysfenotyyppi; katso aiemmin) solujen ja kudosten terveyden tukemiseksi. (34)
Mitä tulee annostukseen, apigeniinilisälle ei ole yleisesti suositeltua annosta. Eläinmalleissa tutkimuksissa on kuitenkin käytetty annoksia 25-100 mg/kg ruumiinpainoa. (35) Lisäravinteet vaihtelevat tyypillisesti 50-500 mg päivässä. Tehokkainta ja turvallisinta annostusta ei kuitenkaan ole vielä lopullisesti vahvistettu. Apigeniiniä pidetään yleensä turvallisena, mutta suuret annokset voivat olla vuorovaikutuksessa tiettyjen lääkkeiden kanssa.
Johtopäätös
Luonnollisten senolyyttien potentiaalin analyysin päätteeksi on selvää, että yhdisteillä, kuten fisetiinillä, kversetiinillä ja apigeniinillä, on merkittäviä senolyyttisiä ominaisuuksia, jotka voivat vaikuttaa syvästi ikääntymisprosessiin. Nämä aineet kohdistuvat erityisesti ikääntyviin soluihin ja poistavat ne, mikä vaikuttaa perustavanlaatuiseen ikääntymismekanismiin ja siihen liittyviin patologioihin. Näiden bioaktiivisten yhdisteiden sisällyttäminen ruokavalioon – peräisin esimerkiksi mansikoista, sipulista ja kamomillasta – edustaa strategista lähestymistapaa solujen toiminnan tehostamiseen ja soluvaurioiden kertymisen lieventämiseen ajan myötä.
Vaikka prekliiniset tiedot ovat lupaavia, näiden tulosten muuntaminen käytännön kliinisiksi strategioiksi vaatii lisäempiiristä tutkimusta tehon ja turvallisuuden validoimiseksi. Sellaisenaan näiden yhdisteiden jatkuva tutkiminen tiukoissa kliinisissä kokeissa on edelleen ratkaisevan tärkeää.
Tieteelliset viittaukset:
- Sikora, E., Arendt, T., Bennett, M., & Narita, M. (2011). Solujen vanhenemisen vaikutus ikääntymistutkimukseen. Ikääntymistutkimuskatsaukset , 10 (1), 146-152.
- He, S. ja Sharpless, NE (2017). Vanheneminen terveydessä ja sairaudessa. Cell , 169 (6), 1000-1011.
- Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Solujen vanheneminen ikääntymisessä: mekanismeista terapeuttisiin mahdollisuuksiin. Nature Reviews Molecular Cell Biology 22 (2): 75–95.
- Kuilman, T. & Michaloglou, C. & Mooi, W. & Peeper, D. (2010). Vanhenemisen ydin. Genes & Development 24 (22): 2463–2479.
- Kirkland, JL ja Tchkonia, T. (2020). Senolyyttiset lääkkeet: löydöstä kääntämiseen. Journal of sisätauti , 288 (5), 518-536.
- Sengupta, B. & Banerjee, A. & Sengupta, P. (2005). Kasviflavonoidifisetiinin vuorovaikutukset makromolekyylikohteiden kanssa: oivalluksia fluoresenssispektroskooppisista tutkimuksista. Journal of Photochemistry and Photobiology B: Biology 80 (2): 79–86.
- Bag, S. & Ghosal, S. & Karmakar, S. & Pramanik, G. & Bhowmik, S. (2023). Kasviflavonoidien, fisetiinin ja morinin, joilla on sivuhydroksyyliryhmiä (-OH) HRAS1- ja HRAS2 i-Motif DNA -rakenteiden vastakkaisen sitoutumiskäyttäytymisen paljastaminen: Rakenteellisten muutosten ja sijaintivaikutusten dekoodaus. ACS Omega 8 (33): 30315–30329.
- Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetiini: ravinnon antioksidantti terveyden edistämiseen. Antioxidants & Redox Signaling 19 (2): 151–162.
- Yousefzadeh, M. et ai. (2018). Fisetiini on senoterapeuttinen lääke, joka pidentää terveyttä ja elinikää. EBioMedicine 36: 18-28.
- Wyld, L. et ai. (2020). Vanheneminen ja syöpä: katsaus ikääntymisen ja senoterapioiden kliinisistä vaikutuksista. Cancers 12 (8): 2134.
- Wang, Y. & He, Y. & Rayman, M. & Zhang, J. (2021). Flavonoideista johdettujen uusien senolyyttisten aineiden mahdollinen selektiivinen mekanismi. Journal of Agricultural and Food Chemistry 69 (42): 12418–12423.
- Wiciński, M. et ai. (2023). Luonnolliset fytokemikaalit SIRT-aktivaattoreina – keskity mahdollisiin biokemiallisiin mekanismeihin. Nutrients 15 (16): 3578.
- Afroze, N. et ai. (2022). Fisetiini estää solujen lisääntymisen, indusoi apoptoosia, lievittää oksidatiivista stressiä ja tulehdusta ihmisen syöpäsoluissa, HeLa. International Journal of Molecular Sciences 23 (3): 1707.
- Roy, T. et ai. (2023). MTOR/IL-17A:n ja autofagian kaksoiskohdistus fisetiinillä lievittää psoriaasin kaltaista ihotulehdusta. Frontiers in Immunology 13: 1075804.
- Samanta, S. et ai. (2022). Fisetiinin, luonnollisen flavonoidin, hermostoa suojaavat vaikutukset hermoston rappeutumissairauksissa: Keskity oksidatiivisen stressin rooliin. Frontiers in Pharmacology 13: 1015835.
- Singh, S. & Singh, A. & Garg, G. & Rizvi, SI (2018). Fisetiini kalorirajoituksen jäljittelijänä suojaa rotan aivoja ikääntymisen aiheuttamalta oksidatiiviselta stressiltä, apoptoosilta ja neurodegeneraatiolta. Life Sciences 193: 171–179.
- Verdoorn, B. et ai. (2021). Fisetiini COVID-19:lle ammattitaitoisissa hoitolaitoksissa: Senolyyttiset kokeet COVID-aikakaudella. Journal of the American Geriatrics Society 69 (11): 3023–3033.
- Kirkland, J. (2024). Fisetinin toimesta iäkkäiden naisten heikkouden, tulehduksen ja niihin liittyvien toimenpiteiden lievitys (AFFIRM). ClinicalTrials.gov ID: NCT03430037.
- Chirumbolo, S. (2010). Kversetiinin, flavonolien ja flavonien rooli tulehduksellisten solujen toiminnan moduloinnissa. I inflammation & Allergy-Drug Targets 9 (4): 263–285.
- Chirumbolo, S. (2011). Quercetin mahdollisena allergialääkkeenä: mitkä näkökulmat? Iran Journal of Allergy Asthma and Immunology 10 (2): 139–140.
- Sagit, M. et ai. (2017). Kversetiinin tehokkuus allergisen nuhan kokeellisessa rottamallissa. European Archives of Oto-Rhino-Laryngology 274 (8): 3087–3095.
- Li, Y. et ai. (2016). Kvertsetiini, tulehdus ja immuniteetti. Ravinteet 8 (3): 167.
- Costa, L. & Garrick, J. & Roquè, P. & Pellacani, C. (2016). Kvertsetiinin neuroprotektion mekanismit: Oksidatiivisen stressin torjunta ja paljon muuta. Oksidatiivinen lääketiede ja solujen pitkäikäisyys 2016: 2986796.
- Cui, Z. et ai. (2022). Kversetiinin terapeuttinen käyttö ikääntymiseen liittyvissä sairauksissa: SIRT1 mahdollisena mekanismina. Frontiers in Immunology 13 : 943321.
- Suraweera, T. & Rupasinghe, H. & Dellaire, G. & Xu, Z. (2020). Ruokavalion flavonoidit säätelevät Nrf2/ARE-polkua: ystävä vai vihollinen syövän hallinnassa? Antioksidantit 9: 973.
- Salehi, B. et ai. (2019). Apigeniinin terapeuttinen potentiaali. International Journal of Molecular Sciences 20 (6): 1305.
- Paredes-Gonzalez, X. et ai. (2015). NRF2-välitteisen geeniekspression induktio ravinnon fytokemiallisilla flavoneilla apigeniinillä ja luteoliinilla. Biopharmaceutics & Drug Disposition 36 (7): 440–451.
- Ginwala, R. & Bhavsar, R. & Chigbu, D. & Jain, P. & Khan, Z. (2019). Flavonoidien mahdollinen rooli kroonisten tulehdussairauksien hoidossa keskittyen erityisesti apigeniinin anti-inflammatoriseen aktiivisuuteen. Antioksidantit 8 (2): 35.
- Shukla, S. & Gupta, S. (2010). Apigeniini: lupaava molekyyli syövän ehkäisyyn. Pharmaceutical Research 27: 962–978.
- Sung, B. & Chung, H. & Kim, N. (2016). Apigeniinin rooli syövän ehkäisyssä apoptoosin ja autofagian induktion kautta. Journal of Cancer Prevention 21 (4): 216–226.
- Pan, H. & Finkel, T. (2017). Tärkeimmät proteiinit ja reitit, jotka säätelevät elinikää. Journal of Biological Chemistry 292 (16): 6452–6460.
- Shukla, S. & Gupta, S. (2009). Apigeniini estää insuliinin kaltaisen kasvutekijä I -reseptorin signaloinnin ihmisen eturauhassyövässä: In vitro ja in vivo -tutkimus. Molecular Carcinogenesis 48 (3): 243-252.
- Escande, C. et ai. (2013). Flavonoidi apigeniini on NAD+-ase CD38:n estäjä: vaikutukset solun NAD+-aineenvaihduntaan, proteiinien asetylaatioon ja metabolisen oireyhtymän hoitoon. Diabetes 62 (4): 1084-1093.
- Lim, H. & Park, H. & Kim, H. (2015). Flavonoidien vaikutukset vanhenemiseen liittyvään erittyvän fenotyypin muodostumiseen bleomysiinin aiheuttamasta vanhenemisesta BJ-fibroblasteissa. Biochemical Pharmacology 96 (4): 337–348.
- Salehi, B. et ai. (2019). Apigeniinin terapeuttinen potentiaali. International Journal of Molecular Sciences 20 (6): 1305.