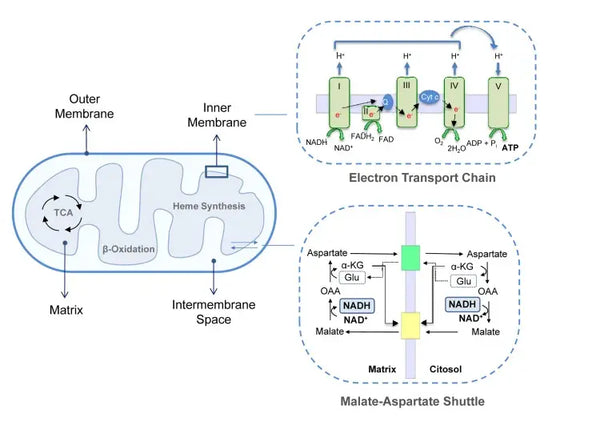
Las mitocondrias son orgánulos vitales ubicados en el citoplasma de las células eucariotas. Con mitocondrias que funcionan bien, cada proceso en el cuerpo, desde el movimiento y el ejercicio hasta la digestión y la recuperación, funciona mejor. Desempeñan un papel esencial en la generación de energía y en muchos otros procesos celulares. Las mitocondrias ofrecen el lugar para la fosforilación oxidativa, que produce ATP, la principal fuente de energía de la célula. Estructuralmente, las mitocondrias se pueden evaluar a través de una membrana externa y una membrana interna altamente plegada que forma compartimentos necesarios para su metabolismo. Junto con la producción de energía, las mitocondrias realizan otras actividades como la señalización de calcio y la regulación del metabolismo celular, además de la apoptosis (muerte programada), lo que las hace vitales para el mantenimiento de la homeostasis celular.
Los fundamentos de la función mitocondrial
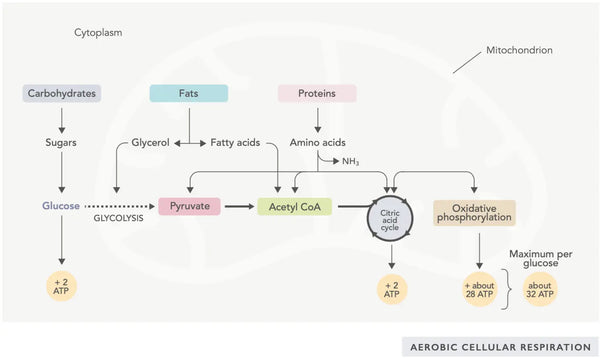
La generación de ATP (la molécula de energía primaria utilizada por las células) es la característica fundamental de la actividad mitocondrial. Este proceso ocurre a través de dos vías bioquímicas principales: el ciclo del ácido cítrico (ciclo TCA o ciclo de Krebs) y la cadena de transporte de electrones (ETC).
Ciclo del ácido cítrico
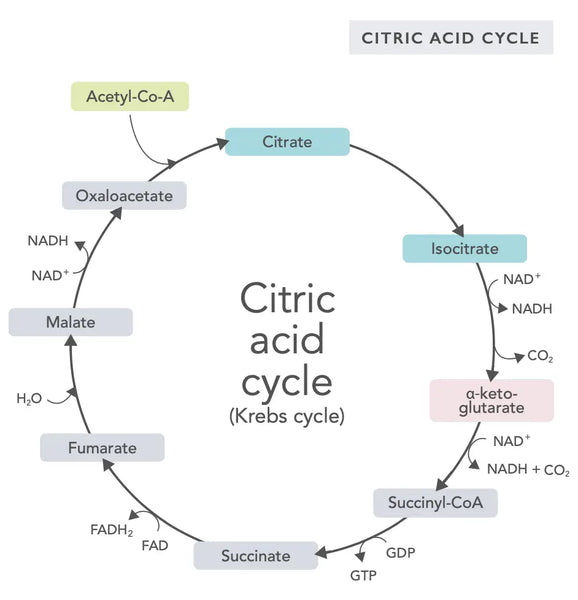
El ciclo del ácido cítrico, o ciclo de Krebs (nombrado así por el ganador del premio Nobel Hans Adolf Krebs, quien lo descubrió), ocurre en las mitocondrias celulares.(1)El compuesto metabólico primario del ciclo del ácido cítrico es el ácido acético (acetil coenzima A) producido a partir de ácidos grasos, carbohidratos y proteínas.(2)
Las diversas reacciones del ciclo del ácido cítrico (ver imagen) forman iones de hidrógeno y electrones que luego se transfieren a la membrana mitocondrial interna para la fosforilación oxidativa (unión de energía a las moléculas de ATP a través de la oxidación) y la cadena de transporte de electrones. La reacción libera NADH y pequeñas cantidades de ATP y dióxido de carbono.
El ciclo del ácido cítrico involucra diez pasos, cada uno afectado por vitaminas del grupo B, ciertos minerales como el magnesio y el hierro, y el principal antioxidante del hígado, el glutatión. Las reacciones son inhibidas por metales pesados como el mercurio, el arsénico y el aluminio.
Las moléculas de NADH ricas en energía capturan la mayor parte de la energía generada durante el ciclo del ácido cítrico. Por cada molécula de acetil coenzima A, se generan tres moléculas de NADH que luego se utilizan para energía en la siguiente reacción (fosforilación oxidativa).
La regulación del ciclo del ácido cítrico está determinada por la disponibilidad de varios aminoácidos y la inhibición por retroalimentación (por ejemplo, si se produce demasiado NADH, varias enzimas del ciclo del ácido cítrico son inhibidas, ralentizando las reacciones).
Oxaloacetato es un compuesto que satisface una necesidad repentina de producir energía (por ejemplo, en el cerebro o los músculos). Tomar un suplemento de oxaloacetato puede ser útil, e incluso puede aumentar la regeneración de mitocondrias en el cerebro, reducir la inflamación silenciosa en el cuerpo y aumentar el número de células nerviosas.(3)
En pocas palabras, el cuerpo incorpora sistemas ingeniosos que convierten los alimentos consumidos en electrones, utilizados como energía para diversas necesidades.
Fosforilación oxidativa
La fosforilación oxidativa consiste en la cadena de transporte de electrones y la ATP sintasa. La fosforilación oxidativa produce la mayor parte de la energía generada en condiciones aeróbicas (ATP). Es una continuación del ciclo del ácido cítrico.
En la cadena de transporte de electrones, se liberan iones de hidrógeno (H+) en el espacio intermembrana mitocondrial. Los iones de hidrógeno liberados del espacio intermembrana se mueven de nuevo al mitocondrio a través de la ATP sintasa. Usando la energía liberada en el proceso, la ATP sintasa convierte el ADP utilizado para energía en ATP nuevamente.
La ubiquinona (coenzima Q10) contribuye a la cadena de transporte de electrones. Ha sido utilizada durante décadas como un suplemento dietético. Los bajos niveles de ubiquinona celular pueden ser un factor predisponente para diversas enfermedades debido a la producción insuficiente de energía aeróbica en las células. Además, el uso de medicamentos para el colesterol (estatinas) es un factor contribuyente a la deficiencia de ubiquinona.(4)
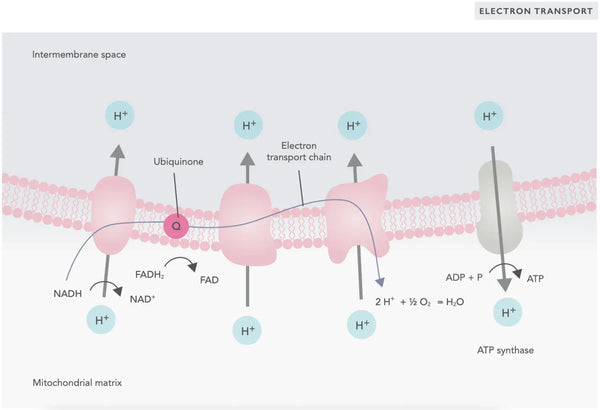
Este conjunto coordinado de reacciones genera ATP y establece un gradiente de protones a través de la membrana mitocondrial interna, un proceso conocido como quimiosmosis. La energía almacenada en este gradiente impulsa la síntesis de ATP, vinculando el flujo de electrones a través de la ETC con la generación de energía celular.(5)
Factores que influyen en la eficiencia mitocondrial
La eficiencia mitocondrial, que es vital para el funcionamiento celular óptimo, está influenciada por varios factores. A continuación se describen los más importantes.
Composición genética
Las mitocondrias poseen un ADN separado e individual (ADN mitocondrial, mtDNA) distinto del ADN nuclear. El ADN mitocondrial (mtDNA) codifica componentes esenciales de la cadena de transporte de electrones y proteínas mitocondriales. Las mutaciones en el mtDNA pueden llevar a proteínas disfuncionales, interrumpiendo la cadena de transporte de electrones y la síntesis de ATP. Esto puede resultar en una producción de energía reducida y un aumento en la generación de especies reactivas de oxígeno (ROS), contribuyendo a la disfunción mitocondrial y celular.(6)
Estrés oxidativo
Las mitocondrias son una fuente significativa de ROS, que son subproductos del metabolismo del oxígeno. Si bien los niveles bajos de ROS funcionan en la señalización celular, un exceso de ROS puede causar daño oxidativo a las proteínas, lípidos y ADN mitocondriales. Este estrés oxidativo compromete la integridad y función mitocondrial, inhibiendo la producción de ATP y llevando a una mayor producción de ROS en un ciclo perjudicial. Las defensas antioxidantes, incluyendo la superóxido dismutasa y la glutatión peroxidasa, juegan un papel crítico en la mitigación de este daño.(7-8)
Disponibilidad de nutrientes
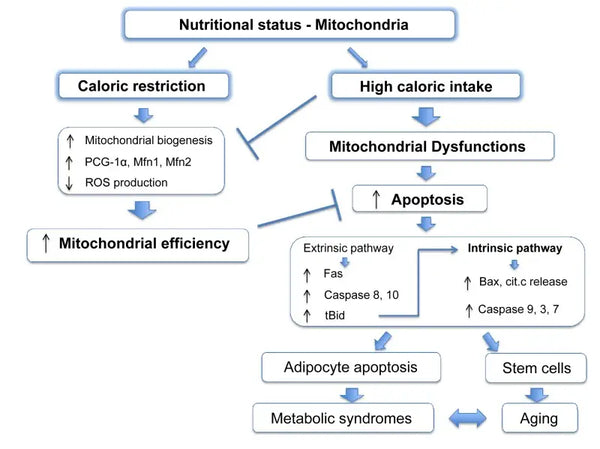
Las mitocondrias requieren sustratos específicos para la producción de energía. La glucosa y los ácidos grasos son fuentes primarias para la generación de ATP a través de la glucólisis y la β-oxidación, respectivamente. La disponibilidad de estos sustratos impacta directamente en la función mitocondrial. Por ejemplo, en condiciones de exceso de nutrientes, como una alta disponibilidad de glucosa, las mitocondrias pueden producir cantidades excesivas de ATP y ROS, lo que puede llevar a alteraciones metabólicas.(9-10)
Por el contrario, la escasez de nutrientes puede limitar la producción de energía mitocondrial, afectando la función y supervivencia celular. A diferencia de algunos informes de estudios en animales sobre los beneficios de la restricción calórica en la biogénesis mitocondrial, parece que no aumenta la biogénesis mitocondrial. Sin embargo, preserva la función mitocondrial al proteger la integridad y función de los componentes celulares existentes.(11-12)
Factores de estilo de vida
Ejercicio
La actividad física influye en la cantidad y calidad de las mitocondrias. El ejercicio estimula la biogénesis mitocondrial, lo que lleva a un aumento en la densidad mitocondrial y la eficiencia en la producción de energía.(13) Especialmente el entrenamiento de resistencia mejora la capacidad oxidativa de las mitocondrias, mejorando su habilidad para utilizar oxígeno para la producción de ATP (lea más en detalle más adelante en el artículo).
Dieta
Los componentes dietéticos afectan significativamente la función mitocondrial. Las proporciones de macronutrientes, la ingesta calórica y nutrientes específicos (como antioxidantes, vitaminas y minerales) influyen en el metabolismo mitocondrial. Las dietas ricas en nutrientes que apoyan la función mitocondrial pueden mejorar la producción de energía y reducir el estrés oxidativo (ver más adelante). Activar la cetosis también puede aumentar la biogénesis mitocondrial y mejorar la eficiencia mitocondrial.(14-15)
Factores ambientales
La exposición a factores estresantes ambientales, como toxinas, contaminantes, metales pesados (por ejemplo, plomo, mercurio, arsénico y cadmio) y radiación, puede afectar negativamente la función mitocondrial. Estos factores estresantes pueden inducir daño oxidativo, interrumpir la actividad de la cadena de transporte de electrones y afectar la dinámica mitocondrial, incluidos los procesos de fusión y fisión.(16)
Intervenciones tecnológicas
Fotobiomodulación (o terapia de luz roja)
La fotobiomodulación es la utilización de energía fotónica no ionizante para desencadenar cambios fotoquímicos dentro de estructuras celulares que son receptivas a los fotones, particularmente en las mitocondrias. Se cree que la terapia de luz roja y la terapia de luz NIR funcionan principalmente a través de aceptores de fotones. Las ondas de luz roja penetran la piel y alcanzan las mitocondrias de la célula, aumentando la producción de energía de las células. Varios eventos conducen a esto, por ejemplo, la aceleración de la respiración mitocondrial a través de la citocromo c oxidasa.(17) Lea sobre los beneficios para la salud de la fotobiomodulación aquí.
Sauna de infrarrojos
Las saunas de infrarrojos utilizan radiación infrarroja, que calienta los tejidos del cuerpo directamente en lugar de calentar el aire. La frecuencia de la radiación emitida por las saunas de infrarrojos es de 3–12 μm, que se encuentra en el rango de infrarrojo lejano (FIR). Se ha encontrado que la luz infrarroja lejana tiene efectos a nivel de tejido, particularmente en la cadena respiratoria mitocondrial en el proceso de producción de energía celular y el suministro de sangre a los tejidos al dilatar los vasos sanguíneos y mejorar la circulación.(18)
Terapia de campo electromagnético pulsado (PEMF)
La terapia PEMF utiliza campos electromagnéticos para promover varios procesos fisiológicos. La investigación sugiere que la terapia PEMF puede mejorar la función mitocondrial al aumentar el consumo de oxígeno celular y mejorar la producción de ATP. La terapia PEMF afecta directamente a las mitocondrias, devolviendo a las células a un estado más saludable de energía y carga eléctrica.(19-20) Lea la guía completa sobre la terapia PEMF aquí.
Terapia de oxígeno hiperbárico (HBOT)
La HBOT implica respirar oxígeno puro en un entorno presurizado. La terapia de oxígeno hiperbárico ha demostrado clínicamente revitalizar las mitocondrias y aumentar la formación de ATP al proporcionar cantidades suprafisiológicas de oxígeno necesarias para la respiración celular. Un estudio reciente informó que la HBO aumentó la biogénesis mitocondrial y la autofagia al aumentar parcialmente la producción de especies reactivas de oxígeno. Este proceso produjo nuevas mitocondrias saludables, y las mitocondrias viejas y disfuncionales fueron destruidas. Este estudio también encontró una mayor activación de la transcripción y replicación del ADN mitocondrial.(21-22) Aprenda más sobre la HBOT aquí.
Soporte nutricional y suplementario para la función mitocondrial
El papel de la nutrición en el mantenimiento de la salud mitocondrial es fundamental, siendo ciertos nutrientes particularmente cruciales para una función mitocondrial óptima. Estos incluyen los siguientes que se enumeran a continuación.
- Coenzima Q10 (CoQ10): La ubiquinona es soluble en grasa y se asemeja a una vitamina. La ubiquinona funciona como un transportador de electrones en la cadena de transferencia de electrones en las mitocondrias (ver figura a la derecha) y promueve la secreción de ATP. Los niveles de ubiquinona disminuyen en varios tejidos con la edad.(23)
- Magnesio: Involucrado en la síntesis de ATP y crucial para mantener la integridad y función mitocondrial.(24)
- Vitaminas B: Incluyendo B1 (tiamina), B2 (riboflavina), B3 (niacina), B5 (ácido pantoténico), B6, B7 (biotina) y B12. Estas vitaminas B son cruciales para varios aspectos del metabolismo energético mitocondrial.(25)
- Ácido alfa-lipoico: ALA es un poderoso antioxidante que también ayuda a regenerar otros antioxidantes. Tiene un papel en el metabolismo energético y puede mejorar la función mitocondrial.(26)
- Carnitina (específicamente Acetil-L-Carnitina): Transporta ácidos grasos a las mitocondrias para la beta-oxidación, lo cual es crucial para la producción de energía, particularmente en las células musculares.(27)
- Creatina: La creatina es un compuesto que ocurre naturalmente en el cuerpo y ayuda a suministrar energía a las células, particularmente a las células musculares, al aumentar la formación de trifosfato de adenosina (ATP). La suplementación con creatina puede mejorar la eficiencia mitocondrial, particularmente en ejercicios de alta intensidad.(28)
- Pyrroloquinolina Quinona (PQQ): La PQQ es un antioxidante que aumenta la biogénesis mitocondrial a través del contenido de proteína PGC-1 y apoya la función mitocondrial.(29)
- Ácidos Grasos Omega-3 (EPA y DHA): Los omega-3 son esenciales para mantener la fluidez y función de la membrana mitocondrial. Estos se encuentran principalmente en el aceite de pescado y en pescados grasos.(30)
- Nicotinamida Ribósido (NR) y Nicotinamida Mononucleótido (NMN): Estos precursores de NAD+ son esenciales para la función mitocondrial y la producción de energía. Suplementar con NR o NMN puede ayudar a aumentar los niveles de NAD+ y, por lo tanto, mejorar la eficiencia mitocondrial.(31) Lea más sobre cómo optimizar NAD+ aquí.
- Cúrcuma: La curcumina es el compuesto activo en la cúrcuma. Se ha demostrado que protege a las mitocondrias del daño oxidativo y mejora su función.(32)
- Selenio: Un elemento traza esencial que juega un papel en la protección de las mitocondrias del estrés oxidativo. El selenio también regula al alza la biogénesis mitocondrial.(33)
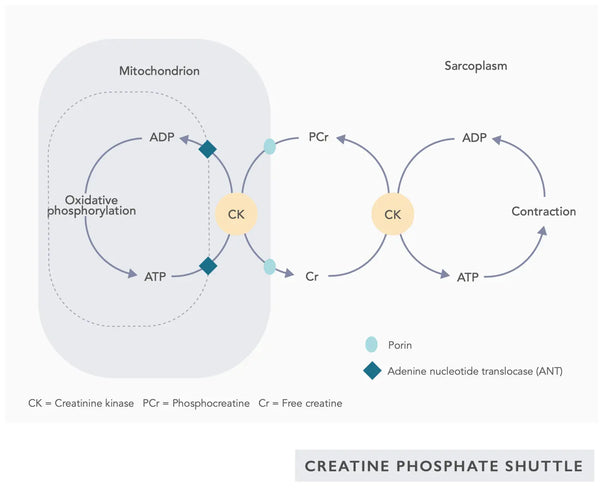
Ejercicio y biogénesis mitocondrial
La actividad física regular es un factor crítico en la promoción de la biogénesis mitocondrial, lo que lleva a la creación de nuevas mitocondrias, aumentando así su cantidad y capacidad funcional en las células. Diferentes formas de ejercicio ejercen efectos distintos sobre la dinámica mitocondrial. Las dos formas más importantes de ejercicio son el entrenamiento aeróbico y el entrenamiento de resistencia.
Ejercicio aeróbico
La densidad mitocondrial en las células musculares esqueléticas aumenta notablemente durante el ejercicio aeróbico (por ejemplo, correr, andar en bicicleta y nadar).
La biogénesis mitocondrial está regulada por PGC-1α (coactivador 1-alfa del receptor gamma activado por proliferadores de peroxisomas), una proteína reguladora esencial, cuya expresión estimula el ejercicio aeróbico. PGC-1α coactiva factores respiratorios nucleares (NRFs) y el factor de transcripción mitocondrial A (TFAM), que son necesarios para transcribir el ADN mitocondrial (mtDNA) y replicar las mitocondrias. Esto lleva a una mayor eficiencia de la fosforilación oxidativa, mejor resistencia y mayor generación de ATP en las células musculares.(34)
El entrenamiento de intervalos de alta intensidad (HIIT) es particularmente efectivo para aumentar el número de mitocondrias y la captación máxima de oxígeno (VO2max).(35-36)
Entrenamiento de resistencia
La función y eficiencia mitocondrial son los objetivos principales del entrenamiento de resistencia (por ejemplo, levantamiento de pesas y ejercicios con el peso corporal). Provoca cambios en la síntesis de proteínas mitocondriales, mejorando la calidad y efectividad de las mitocondrias presentes. El entrenamiento de fuerza también aumenta la producción de enzimas en las cadenas de transporte de electrones y en el ciclo de Krebs, mejorando aún más la capacidad celular para la síntesis de ATP. También puede aumentar el número y tamaño de las mitocondrias en las células musculares, aunque no en la misma medida que el ejercicio aeróbico.(37-38)
El efecto combinado de estas modalidades de ejercicio en la biogénesis y función mitocondrial destaca la importancia de la actividad física en el mantenimiento y mejora de la salud mitocondrial. La participación regular en entrenamiento aeróbico y de resistencia mejora de manera integral la densidad mitocondrial, la eficiencia y el metabolismo energético de las células. Estas adaptaciones son cruciales para el rendimiento atlético y son significativas en el mantenimiento de la salud, la prevención de enfermedades y el manejo de condiciones asociadas con la disfunción mitocondrial.
Sin embargo, se debe tener en cuenta que entrenar tanto para la fuerza como para la resistencia simultáneamente conduce a una menor adaptación, ya que las quinasas de proteínas PKB y AMPK bloquean las señales descendentes de cada una, obstaculizando el efecto del entrenamiento concurrente.(39)
Mitofagia y salud celular
La mitofagia se refiere a un tipo selectivo de autofagia que juega un papel esencial en las condiciones celulares al poder degradar solo las mitocondrias dañadas o no funcionales. Este mecanismo es crucial para la salud de las mitocondrias y de una célula, previniendo la acumulación de ARNm que codifican ensamblajes defectuosos de subunidades, salvando así futuras crisis en las funciones celulares y numerosas patologías.(40)
Eliminar las mitocondrias dañadas a través de la mitofagia ayuda a reducir el estrés oxidativo, la apoptosis y la inflamación (asociadas con diversas patologías). La mitofagia deteriorada facilita la acumulación de mitocondrias disfuncionales en la patogénesis de trastornos neurodegenerativos como la enfermedad de Parkinson y la enfermedad de Alzheimer. De manera similar, en trastornos metabólicos, la pérdida de mitofagia conduce a cambios en el metabolismo mitocondrial, resultando en resistencia a la insulina y diabetes tipo 2.(41-42)
Se ha demostrado que la restricción calórica promueve la mitofagia. Esto se debe en parte a la activación de sirtuinas (SIRT1), la quinasa de proteínas activada por AMP (AMPK) y el factor de transcripción EB que apoyan tanto la respuesta a la crisis energética celular como la iniciación de la mitofagia. Específicamente, las sirtuinas regulan la función de factores en la maquinaria de mitofagia, silenciando las mitocondrias dañadas.(43)
Los efectos moleculares de la restricción calórica son imitados por compuestos como el resveratrol (un polifenol en el vino tinto y algunas bayas) y muchos otros polifenoles. El resveratrol promueve la activación de SIRT1 y AMPK, aumentando la mitofagia responsable de la mejora de la función mitocondrial y la restauración de la salud celular.(44-45)
La mitofagia puede ser mejorada con el ayuno intermitente. Esta mejora probablemente se ve mitigada por el cambio metabólico de energía basada en glucosa a energía basada en cetonas durante el ayuno y este cambio desencadena la mitofagia.(46-47)
Disfunción mitocondrial como un sello distintivo del envejecimiento
Entender cómo las mitocondrias contribuyen al proceso de envejecimiento está en el centro de la investigación en gerontología y biología celular. A medida que los organismos envejecen, la disfunción mitocondrial se vuelve más común, lo que juega un papel en el lado fisiológico del envejecimiento.
Las mitocondrias envejecidas muestran una disminución en la producción de ATP, lo que afecta los procesos impulsados por energía necesarios para el bienestar celular. Además, los cambios estructurales en las mitocondrias asociados con la edad interfieren aún más con esta disminución de la producción energética, como la composición anormal del potencial de membrana mitocondrial y la integridad de la pared interna mitocondrial.(48)
La posición del ADN mitocondrial (mtDNA) cerca de la cadena de transporte de electrones donde ocurren las especies reactivas de oxígeno impacta su vulnerabilidad a mutaciones. Sin embargo, las mutaciones se acumulan con el tiempo, resultando en disfunción mitocondrial. A diferencia del ADN nuclear, que está unido a histonas para protección y tiene una variedad de mecanismos de reparación disponibles, el ADN mitocondrial (mtDNA) carece de recubrimiento protector por histonas y no tiene una amplia gama de métodos de reparación, por lo que puede dañarse fácilmente.(49)
En las células, las mitocondrias producen especies reactivas de oxígeno (ROS). Aunque las ROS sirven como un medio crítico para que la célula se comunique y se ajuste a su entorno, la generación de altos niveles de estas moléculas está limitada por un control estricto. La producción excesiva en diversas condiciones relacionadas con la edad resulta en células que sufren de estrés oxidativo. Destruye diferentes componentes celulares, ya sean proteínas, lípidos o ADN. Las mitocondrias son incluso el principal receptor del daño oxidativo, creando un círculo vicioso ya que las mitocondrias dañadas solo generan más ROS, aumentando así la senescencia celular.(50-52)
La dinámica mitocondrial es crucial para la función mitocondrial que ayuda a mantener el proceso de fusión y fisión. Sin embargo, estas dinámicas se ven interrumpidas con el envejecimiento y las mitocondrias sufren fragmentación en lugar de fusión. Estos cambios afectan la función de las mitocondrias y su posición en las células.(53)
La pérdida de función mitocondrial no es un fenómeno pasivo relacionado con el envejecimiento, sino un participante activo en la patogénesis de enfermedades dependientes de la edad. La disfunción mitocondrial se ha asociado con condiciones como enfermedades neurodegenerativas, enfermedades cardiovasculares y trastornos metabólicos. En estos trastornos, la reducción o generación defectuosa de energía, el aumento del estrés oxidativo y la incapacidad para eliminar mitocondrias dañadas son esenciales en la patogénesis y el curso de la enfermedad.(54)
Conclusión
La optimización de la salud mitocondrial y su declive con el envejecimiento es una tarea desafiante, pero afortunadamente hay mucho que podemos hacer al respecto. Las intervenciones principales involucran el apoyo nutricional de sustratos críticos para la regeneración, incluyendo coenzima Q10, magnesio y vitaminas B; la participación regular en diversas disciplinas de ejercicio para aumentar la biogénesis mitocondrial; y modificaciones en el estilo de vida como la restricción calórica o el ayuno intermitente para influir en los mecanismos de mitofagia.
Reconocer la disfunción mitocondrial como uno de los factores involucrados en el envejecimiento hace que estas estrategias sean esenciales para apoyar la salud celular y luchar contra la degradación relacionada con la edad. Enfoques integradores que utilizan el poder del conocimiento basado en la ciencia en combinación con alteraciones aplicables en el estilo de vida pueden crear condiciones favorables para la prevención y desaceleración del desgaste mitocondrial que en general sirve al bienestar y longevidad del individuo.
Referencias científicas
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900–81), pionero de la medicina moderna, arquitecto del metabolismo intermedio. Revista de Biografía Médica 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Bioquímica. 5ª edición. Capítulo 17, El ciclo del ácido cítrico. Nueva York: W. H. Freeman.
- Wilkins, H. et al. (2014). El oxaloacetato activa la biogénesis mitocondrial cerebral, mejora la vía de la insulina, reduce la inflamación y estimula la neurogénesis. Genética Molecular Humana 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Deficiencia primaria y secundaria de coenzima Q10: el papel de la suplementación terapéutica. Revisiones de Nutrición 71 (3): 180–188. Revisión.
- Saraste, M. (1999). Fosforilación oxidativa al fin de siglo. Science 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). tRNAs mitocondriales humanos: biogénesis, función, aspectos estructurales y enfermedades. Revisión Anual de Genética 45: 299–329.
- Zhang, Y. & Wong, H. (2021). ¿Son las mitocondrias el principal contribuyente de especies reactivas de oxígeno en las células? Revista de Biología Experimental 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Especies reactivas de oxígeno en la señalización celular. Revista Americana de Fisiología-Fisiología Celular y Molecular del Pulmón 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Mecanismos de producción de bioenergía en mitocondrias. Mitocondrias y su papel en la enfermedad cardiovascular 99–121.
- Bottje, W. (2019). El metabolismo oxidativo y la eficiencia: el delicado acto de equilibrio de las mitocondrias. Ciencia Avícola 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). La disponibilidad de nutrientes vincula mitocondrias, apoptosis y obesidad. Envejecimiento (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). La restricción calórica crónica preserva la función mitocondrial en la senescencia sin aumentar la biogénesis mitocondrial. Metabolismo Celular 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Mecanismos moleculares para la adaptación mitocondrial al entrenamiento físico en el músculo esquelético. El Journal FASEB 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Regulación de la biogénesis mitocondrial. Ensayos en Bioquímica 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Terapia metabólica basada en cetonas: ¿es el aumento de NAD+ un mecanismo primario? Frontiers en Neurociencia Molecular 10: 377.
- Fowler, B. (1978). Efectos subcelulares generales del plomo, mercurio, cadmio y arsénico. Perspectivas de Salud Ambiental 22:37-41.
- Hamblin, M. (2018). Mecanismos y señalización redox mitocondrial en la fotobiomodulación. Fotografía y Fotobiología 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Radiación infrarroja lejana (FIR): sus efectos biológicos y aplicaciones médicas. Fotónica y Láseres en Medicina 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). La estimulación electromagnética aumenta la función mitocondrial en células osteogénicas y promueve la reparación de fracturas óseas. Informes Científicos 11 (1): 19114.
- Tai, Y. et al. (2020). Los campos magnéticos modulan el metabolismo y el microbioma intestinal en correlación con la expresión de Pgc-1 alfa: seguimiento de un estudio in vitro de mitohormesis magnética. El Journal FASEB 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). El efecto del oxígeno hiperbárico en el metabolismo energético mitocondrial y glucolítico: el concepto de caloristasis. Estrés Celular y Chaperonas 25 (4): 667-677.
- Chen, W. et al. (2020). El oxígeno hiperbárico protege contra la lesión por isquemia-reperfusión miocárdica al inhibir la disfunción mitocondrial y la autofagia. Informes de Medicina Molecular 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). La complejidad de la producción de ubiquinona. Tendencias en Endocrinología y Metabolismo 30 (12): 929-943.
- Volpe, S. (2013). Magnesio en la prevención de enfermedades y la salud general. Avances en Nutrición 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O’Brien, P. (2006). Función mitocondrial y toxicidad: papel de la familia de vitaminas B en el metabolismo energético mitocondrial. Interacciones Químico-biológicas 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Metabolismo del ácido lipoico y regulación redox mitocondrial. Revista de Química Biológica 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Carnitina en la bioenergética muscular humana: ¿puede la suplementación con carnitina mejorar el ejercicio físico? Moléculas 25 (1): 182.
- Wax, B. et al. (2021). Creatina para el ejercicio y el rendimiento deportivo, con consideraciones de recuperación para poblaciones saludables. Nutrientes 13 (6): 1915.
- Hwang, P. et al. (2020). Efectos de la suplementación con quinona de pirroloquinolina (PQQ) en el rendimiento del ejercicio aeróbico y en los índices de biogénesis mitocondrial en hombres no entrenados. Revista del Colegio Americano de Nutrición 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Influyendo en la composición de la membrana mitocondrial y la bioenergética a través de la suplementación con omega-3. El Journal de Fisiología 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). El ribósido de nicotinamida aumenta el metaboloma de NAD+ en el músculo esquelético humano envejecido e induce firmas transcriptómicas y antiinflamatorias. Informes Celulares 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Curcumina, biogénesis mitocondrial y mitofagia: explorando datos recientes e indicando necesidades futuras. Avances en Biotecnología 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). El selenio, un micronutriente que modula la salud cardiovascular a través de la enzimología redox. Nutrientes 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Regulación de PGC-1α, un regulador nodal de la biogénesis mitocondrial. El Journal Americano de Nutrición Clínica 93 (4): 884S-890S.
- Helgerud, J. et al. (2007). Los intervalos aeróbicos de alta intensidad mejoran el VO2max más que el entrenamiento moderado. Medicina y Ciencia en Deportes y Ejercicio 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Adaptaciones metabólicas similares durante el ejercicio después de intervalos de esprint de bajo volumen y entrenamiento de resistencia tradicional en humanos. Journal de Fisiología 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Efectos diferenciales del ejercicio de resistencia y de resistencia en estado alimentado sobre la fosforilación de moléculas de señalización y la síntesis de proteínas en el músculo humano. El Journal de Fisiología 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). El entrenamiento de ejercicio de resistencia altera la función mitocondrial en el músculo esquelético humano. Medicina y Ciencia en Deportes y Ejercicio 47 (9): 1922-1931.
- Baar, K. (2006). Entrenamiento para resistencia y fuerza: lecciones de la señalización celular. Medicina y Ciencia en Deportes y Ejercicio 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Las vías de la mitofagia para el control de calidad y la eliminación de mitocondrias. Muerte Celular y Diferenciación 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitocondrias y el eje de autofagia–inflamación–muerte celular en el envejecimiento del organismo. Ciencia 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitofagia: un objetivo terapéutico prometedor para la neuroprotección durante el envejecimiento y enfermedades relacionadas con la edad. Revista Británica de Farmacología180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Restricción calórica: ¿es AMPK un sensor y efector clave? Fisiología 26 (4): 214-224.
- Um, J. et al. (2010). Los ratones deficientes en quinasa de proteínas activada por AMP son resistentes a los efectos metabólicos del resveratrol. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Las propiedades antiaging de un antioxidante derivado de la uva están reguladas por el equilibrio mitocondrial de fusión y fisión, lo que lleva a la mitofagia desencadenada por una red de señalización de Sirt1-Sirt3-Foxo3-PINK1-PARKIN. Medicina Oxidativa y Longevidad Celular 2014: 345105.
- Longo, V. & Panda, S. (2016). Ayuno, ritmos circadianos y alimentación restringida en el tiempo en la longevidad saludable. Metabolismo Celular 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I& Sahebkar, A. (2020). El efecto del ayuno o la restricción calórica en la inducción de mitofagia: una revisión de la literatura. Revista de Caquexia, Sarcopenia y Músculo 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Estrés oxidativo, mutación del ADN mitocondrial y deterioro de las enzimas antioxidantes en el envejecimiento. Biología Experimental y Medicina 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). Mutaciones de ADNmt y su papel en el envejecimiento, enfermedades y ciencias forenses. Envejecimiento y Enfermedad 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Generación de especies reactivas de oxígeno por mitocondrias. Antioxidantes 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Especies reactivas de oxígeno y mitocondrias: un nexo de homeostasis celular. Biología Redox 6: 472-485.
- Correia‐Melo, C. et al. (2016). Las mitocondrias son necesarias para las características pro-envejecimiento del fenotipo senescente. El Journal de EMBO 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Proteínas de fusión y fisión mitocondrial como nuevos objetivos terapéuticos para el tratamiento de enfermedades cardiovasculares. Revista Europea de Farmacología 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitofagia: un papel emergente en el envejecimiento y enfermedades asociadas con la edad. Frontiers en Biología Celular y del Desarrollo 8: 200.