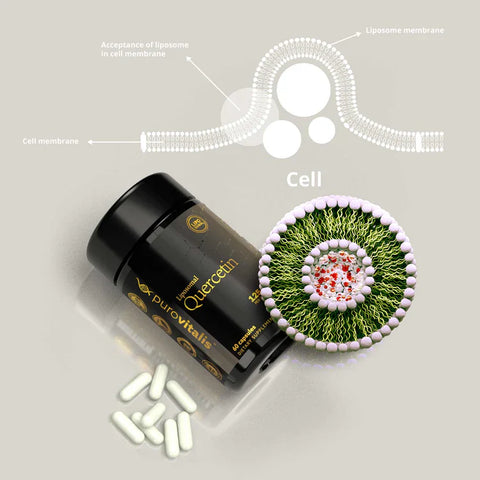
Osvojte si základní dovednosti v oblasti doplňků stravy s naším průvodcem o třech nejlepších přírodních senolytikách, která mohou omladit buňky a posílit zdraví. S přibývajícím věkem může buněčná senescence - kdy se buňky přestávají dělit a hromadí se v našem těle - vést k různým onemocněním souvisejícím s věkem. Některé přírodní sloučeniny však byly identifikovány jako silné senolytika schopné selektivně odstraňovat tyto stárnoucí buňky. V tomto článku se podíváme hlouběji na vědecké základy těchto pozoruhodných látek a na to, jak je zařadit do každodenní rutiny, abyste dosáhli zdravotních účinků, které pomáhají snižovat stárnutí.
Úvod
Stárnutí je komplexní biologický proces, který se vyznačuje postupným poklesem fyziologických funkcí a zvýšenou náchylností k nemocem. Zatímco stárnutí bylo dlouho považováno za nevyhnutelný aspekt života, nedávné pokroky v oblasti výzkumu a vývoje biogerontologie odhalily buněčné a molekulární mechanismy, které jsou jeho základem. Mezi těmito mechanismy se jako významný faktor přispívající k patologickým stavům souvisejícím s věkem ukázala buněčná senescence. Jedná se o nevratnou zástavu růstu vyvolanou různými stresory.(1)
Vzhledem k tomu, že se stárnutím roste počet senescentních buněk, předpokládá se, že senescence přispívá ke stárnutí. Senescence je potřebná k tomu, aby se zabránilo distribuci a proliferaci poškozených buněk, což vyvolává reakci imunitního systému. Tento buněčný kontrolní bod vyžaduje účinný systém buněčné substituce, který zahrnuje jak odstranění senescentních buněk, tak mobilizaci progenitorových buněk k obnovení optimálního počtu buněk.(2)
Poškození jaderné DNA je často uváděno jako běžná základní příčina senescence, především ve formě dvouřetězcových zlomů DNA (DSB), které aktivují dráhu odpovědi na poškození DNA (DDR). Dlouhodobá aktivace DDR aktivuje senescenci. Ke spuštění replikační buněčné senescence stačí jedna nebo několik DDR signalizujících telomer (konců chromozomů). Silným spouštěčem senescence je také aktivace onkogenů.(3)
Senescentní buňky exprimují podstatné změny ve svém sekretomu, který je obohacen zejména o prozánětlivé cytokiny a matrixové metaloproteinázy. Proto se označuje jako sekreční fenotyp spojený se senescencí (SASP).. Senescentní buňky vykazují výrazné fenotypové změny, jako je zploštělá morfologie, změněná exprese genů a sekrece prozánětlivých molekul. Zatímco zpočátku slouží senescence jako mechanismus potlačující vznik nádorů tím, že zastavuje proliferaci poškozených buněk, hromadění senescentních buněk v průběhu času přispívá k dysfunkci tkání a podporuje nemoci související se stárnutím. (4)
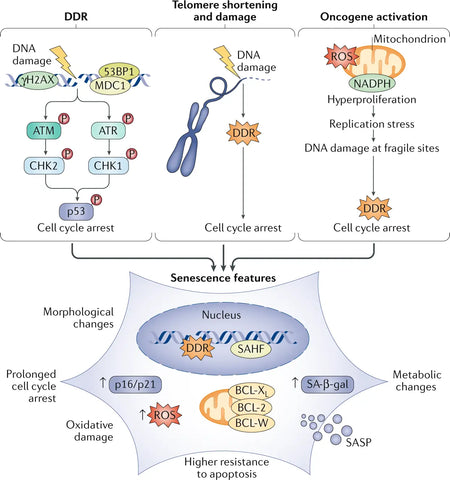
Obrázek: Faktory a fenotypy senescence.
Zdroj:: Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Buněčná senescence při stárnutí: od mechanismů k terapeutickým možnostem. Nature Reviews Molecular Cell Biology. 22 (2): 75–95.
Vzhledem ke škodlivým účinkům senescentních buněk na homeostázu tkání a rozpětí zdraví se cílené působení na tyto buňky jeví jako slibná terapeutická strategie. Senolytika jsou sloučeniny určené k vyvolání apoptózy v senescentních buňkách a zároveň selektivně šetřící zdravé buňky. Mají potenciál zmírnit zánět, posílit regeneraci tkání. a oddálit nástup patologických stavů souvisejících s věkem.(5)
Senolytické sloučeniny
Řada přírodních a syntetických sloučenin byla identifikována jako potenciální senolytika, přičemž kvercetin (přírodní sloučenina) a dasatinib (syntetické léčivo) představují první kandidáty v této třídě. Kromě kvercetinu a dasatinibu se objevilo několik dalších sloučenin, včetně fisetinu, navitoklaxu a dalších. a ABT-263, prokázaly v preklinických modelech slibné senolytické vlastnosti. Tento článek se zabývá třemi nejvýznamnějšími potenciálními a slibnými přírodními senolytiky, která jsou dnes k dispozici.
Fisetin
Fisetin je bioaktivní flavonol (polyfenol), který je významně zkoumán pro svůj potenciál podporovat zdraví a dlouhověkost, zejména zmírňováním buněčné senescence. Nachází se především v jahodách, jablkách, persimonech, cibuli, hroznech a v malém množství v okurce (viz obrázek). Fisetin má řadu biologických aktivit, které lze přičíst jeho jedinečné molekulární struktuře (planární struktura a několik uhlíkových kruhů).(6-7)
Prvotní zkoumání vlastností fisetinu odhalilo jeho silnou antioxidační kapacitu, která vyplývá z jeho schopnosti vychytávat reaktivní formy kyslíku (ROS). Hraje tak klíčovou roli v buněčné obraně proti oxidačnímu stresu.(8)

Obrázek: Zdroje fisetinu ve stravě.
Zdroj:: Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetin: dietní antioxidant pro podporu zdraví. Antioxidanty a redoxní signalizace 19 (2): 151–162.
Senolytická aktivita Fisetinu představuje hlavní pozornost ve výzkumu dlouhověkosti. Buněčná senescence je stav, kdy se buňky přestávají množit a v průběhu času se hromadí - podílí se na různých onemocněních souvisejících s věkem (podrobněji viz dříve). Bylo zjištěno, že fisetin selektivně indukuje apoptózu v těchto senescentních buňkách. Předpokládá se, že tato selektivní likvidace zmírňuje fenotypy spojené se senescencí, a tím přispívá k oddálení nebo prevenci patologických stavů souvisejících s věkem. Ve srovnání s jinou možnou senolytickou sloučeninou je fisetin asi dvakrát účinnější než kvercetin (viz dále v článku).(9-10)
Prooxidační aktivita flavonoidů (jako je fisetin) je důležitým faktorem při vyhledávání senolytik. Senescentní buňky akumulují vysoké hladiny mědi a železa. Selektivní mechanismus kvercetinu nebo fisetinu je spojen jednoznačně s oxidačním poškozením podporovaným mědí/železem v senescentních buňkách, čímž dochází k usmrcení buněk odolných vůči apoptóze.(11)
Fisetin také ovlivňuje klíčové buněčné signální dráhy, které jsou nedílnou součástí procesu stárnutí. Moduluje funkci sirtuinů (zejména SIRT1), mTOR (inhibice) a JAK-STAT/NF-κB, které jsou klíčové pro regulaci buněčného přežití, apoptózy a autofagie. Modulací těchto drah může fisetin teoreticky zlepšit buněčné funkce, snížit zánět a udržet homeostázu tkání.(12-14)
Bylo také prokázáno, že fisetin má neuroprotektivní vlastnosti. Zmírňuje poškození neuronů a zlepšuje kognitivní funkce, především díky svému antioxidačnímu působení a modulaci neuronálních signálních drah.(15-16)
Navzdory těmto slibným preklinickým zjištěním je nutné si uvědomit, že většina výzkumu fisetinu byla omezena na in vitro a zvířecí modely. Převedení těchto výsledků do klinických aplikací u lidí vyžaduje důkladné klinické studie, které by zjistily účinnost, bezpečnost a optimální dávkování Fisetinu. Některé klinické studie již naštěstí probíhají a jejich výsledky bychom měli mít k dispozici v příštích několika letech.(17-18)
Kvercetin
Kvercetin je důležitý antioxidant, který je řazen mezi flavonoly. Přirozeně se vyskytuje v mnoha druzích zeleniny, ovoce, bobulovinách, listech a obilovinách. Kvercetin se nachází především v kapii, ředkvičkách, kopru, koriandru, zelí, červené cibuli, brokolici a bobulovitém ovoci, jako jsou brusinky a borůvky. Kvercetin je jedním z nejvýznamnějších a nejběžnějších flavonolů vyskytujících se v přírodě.

Výzkumy ukazují, že kvercetin působí jako antivirový, antimikrobiální a protizánětlivý prostředek.(19) Studie navíc prokázaly antihistaminové účinky kvercetinu, což znamená, že může pomáhat při léčbě alergií.(20-21) Nejvýznamnějším vlivem kvercetinu na lidský organismus je jeho schopnost snižovat tichý zánět.(22)
Potenciál kvercetinu podporovat dlouhověkost lze přičíst jeho antioxidačním vlastnostem. Kvercetin jako antioxidant odstraňuje volné radikály a snižuje tak oxidační stres v těle. Výzkum naznačil, že kvercetin může aktivovat sirtuiny (zejména SIRT-1), které regulují buněčné procesy, jako je oprava DNA, genová exprese a metabolismus. Aktivace sirtuinů souvisí s prodloužením délky života u různých organismů.(23-24)
Bylo také prokázáno, že kvercetin aktivuje dráhu Nrf2 a v buněčných jádrech aktivuje transkripci různých genů řízených antioxidačními prvky odpovědi (ARE). Tyto geny zvyšují expresi cytoprotektivních enzymů, jako je glutathion S-transferáza, NAD(P)H chinon dehydrogenáza 1 a hem oxygenáza-1.(25)
Obvykle se doplňky stravy s kvercetinem užívají v dávce 500 mg dvakrát denně. Optimální dávkování kvercetinu však dosud nebylo stanoveno. Doporučená denní dávka kvercetinu je obvykle 5 až 40 mg, ale lze ho konzumovat i v podstatně větším množství (> 500 mg).
Pokud jde o kvercetin, naším doporučením je jeho lipozomální forma od společnosti Purovitalis.
Apigenin
Apigenin (4′,5,7,-trihydroxyflavon) je přirozeně se vyskytující flavonoidní sloučenina v různých rostlinách, včetně petržele, celeru a citrusových plodů. Zvláště hojně se vyskytuje v květech heřmánku. Apigenin má potenciál pomáhat v prevenci chronických onemocnění, jako je cukrovka, Alzheimerova choroba, deprese, nespavost a rakovina, přičemž jeho účinky byly pozorovány ve výzkumu in vivo (studie na zvířatech a lidech).(26)

Jedním z nejslibnějších aspektů apigeninu je jeho schopnost podporovat odolnost buněk. Bylo prokázáno, že apigenin aktivuje dráhu Nrf2, která má zásadní význam pro obranu organismu proti oxidačnímu stresu a zánětu. Zvýšením exprese antioxidačních enzymů, jako je superoxiddismutáza, kataláza a glutathionperoxidáza, pomáhá apigenin chránit buňky před poškozením způsobeným reaktivními formami kyslíku (ROS).(27)
Kromě antioxidačních vlastností má apigenin také prokazatelné protizánětlivé účinky. Bylo zjištěno, že inhibuje produkci prozánětlivých cytokinů, jako jsou TNF-α, IL-1β a IL-6, a to prostřednictvím modulace signální dráhy NF-κB.(28) Apigenin byl také zkoumán pro své potenciální protirakovinné vlastnosti. Studie ukázaly, že apigenin může vyvolat apoptózu (programovanou buněčnou smrt) u různých nádorových buněčných linií, včetně buněk rakoviny prsu, prostaty a tlustého střeva. Apigenin také podporuje autofagii, čímž napomáhá odstraňovat nefunkční buněčné elementy.(29-30)
Apigenin byl také zkoumán pro svou schopnost modulovat dráhy spojené se stárnutím. Jednou z takových drah je signální dráha inzulinu/IGF-1 (IIS), o níž je známo, že hraje roli v regulaci délky života u různých živočišných druhů. Bylo prokázáno, že apigenin inhibuje dráhu IIS, čímž potenciálně napodobuje účinky omezení příjmu kalorií, což je dobře zavedený zásah na podporu dlouhověkosti.(31-32) Kromě toho apigenin inhibuje NAD+ázu CD38, která je spojována s metabolickým syndromem, zvyšuje intracelulární hladiny NAD+ a snižuje globální acetylaci proteinů.(33) Pokud jde o senescenci, zejména apigenin pomáhá inhibovat zbývající senescentní buňky v tvorbě SASP (senescence associated secretory phenotype; viz dříve) a podporuje tak zdraví buněk a tkání.(34)
Pokud jde o dávkování, neexistuje žádná univerzálně doporučená dávka pro suplementaci apigeninem. Studie však na zvířecích modelech používaly dávky v rozmezí 25 až 100 mg/kg tělesné hmotnosti.(35) Doplňky stravy se obvykle pohybují v rozmezí 50 až 500 mg denně. Nejúčinnější a nejbezpečnější dávkování však dosud nebylo jednoznačně stanoveno. Apigenin je obecně považován za bezpečný, ale vysoké dávky mohou interagovat s některými léky.
Závěr
Na závěr analýzy potenciálu přírodních senolytik je zřejmé, že sloučeniny jako fisetin, kvercetin a apigenin vykazují významné senolytické schopnosti, které mohou zásadně ovlivnit proces stárnutí. Tyto látky se specificky zaměřují na senescentní buňky a eliminují je, čímž se zabývají základním mechanismem stárnutí a souvisejícími patologiemi. Zařazení těchto bioaktivních látek do stravy - pocházejících ze zdrojů, jako jsou jahody, cibule a heřmánek - představuje strategický přístup ke zlepšení buněčných funkcí a zmírnění hromadění buněčného poškození v průběhu času.
Přestože jsou však předklinické údaje slibné, převedení těchto poznatků do praktických klinických strategií vyžaduje další empirický výzkum k ověření účinnosti a bezpečnosti. Proto je i nadále zásadní pokračovat ve zkoumání těchto sloučenin v rámci přísných klinických studií.
Vědecké odkazy:
- Sikora, E., Arendt, T., Bennett, M., & Narita, M. (2011). Dopad signatury buněčné senescence na výzkum stárnutí. Přehledy výzkumu stárnutí, 10(1), 146-152.
- He, S., & Sharpless, N. E. (2017). Senescence ve zdraví a nemoci. Cell, 169(6), 1000-1011.
- Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Buněčná senescence ve stárnutí: od mechanismů k terapeutickým možnostem. Nature Reviews Molecular Cell Biology. 22 (2): 75–95.
- Kuilman, T. & Michaloglou, C. & Mooi, W. & Peeper, D. (2010). Podstata senescence. Genes & Development 24 (22): 2463–2479.
- Kirkland, J. L., & Tchkonia, T. (2020). Senolytická léčiva: od objevu k překladu. Journal of internal medicine, 288(5), 518-536.
- Sengupta, B. & Banerjee, A. & Sengupta, P. (2005). Interakce rostlinného flavonoidu fisetinu s makromolekulárními cíli: poznatky z fluorescenčních spektroskopických studií. Journal of Photochemistry and Photobiology B: Biology. 80 (2): 79–86.
- Bag, S. & Ghosal, S. & Karmakar, S. & Pramanik, G. & Bhowmik, S. (2023). Uncovering the Contrasting Bhavior of Plant Flavonoids Fisetin and Morin Having Subsidiary Hydroxyl Groups (- OH) with HRAS1 and HRAS2 i-Motif DNA Structures [Odhalení kontrastního vazebného chování rostlinných flavonoidů Fisetin a Morin s vedlejšími hydroxylovými skupinami (- OH) se strukturami i-motivu HRAS1 a HRAS2]: Dekódování strukturních změn a pozičních vlivů. ACS Omega 8 (33): 30315–30329.
- Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetin: dietní antioxidant pro podporu zdraví. Antioxidanty a redoxní signalizace 19 (2): 151–162.
- Yousefzadeh, M. et al. (2018). Fisetin je senoterapeutikum, které prodlužuje zdraví a délku života. EBioMedicine 36: 18-28.
- Wyld, L. et al. (2020). Senescence a rakovina: přehled klinických důsledků senescence a senoterapie. Cancers 12 (8): 2134.
- Wang, Y. & He, Y. & Rayman, M. & Zhang, J. (2021). Prospective selective mechanism of emerging senolytic agents derived from flavonoids [Perspektivní selektivní mechanismus nových senolytických látek odvozených od flavonoidů]. Journal of Agricultural and Food Chemistry. 69 (42): 12418–12423.
- Wiciński, M. et al. (2023). Natural Phytochemicals as SIRT Activators-Focus on Potential Biochemical Mechanisms [Přírodní fytochemikálie jako aktivátory SIRT - zaměření na potenciální biochemické mechanismy]. Nutrients 15 (16): 3578.
- Afroze, N. et al. (2022). Fisetin zadržuje buněčnou proliferaci, indukuje apoptózu, zmírňuje oxidační stres a zánět v lidských nádorových buňkách HeLa. International Journal of Molecular Sciences 23 (3): 1707.
- Roy, T. et al. (2023). Dual targeting of mTOR/IL-17A and autophagy by fisetin alleviates psoriasis-like skin inflammation (Duální cílení na mTOR/IL-17A a autofagii pomocí fisetinu zmírňuje zánět kůže podobný psoriáze). Frontiers in Immunology 13: 1075804.
- Samanta, S. et al. (2022). Neuroprotektivní účinky fisetinu, přírodního flavonoidu u neurodegenerativních onemocnění: Zaměření na roli oxidačního stresu. Frontiers in Pharmacology 13: 1015835.
- Singh, S. & Singh, A. & Garg, G. & Rizvi, S. I. (2018). Fisetin jako mimetikum kalorické restrikce chrání mozek potkanů před oxidativním stresem, apoptózou a neurodegenerací vyvolanou stárnutím. Life Sciences 193: 171–179.
- Verdoorn, B. et al. (2021). Fisetin pro COVID-19 v zařízeních pro kvalifikovanou péči: Senolytické studie v éře COVID. Journal of the American Geriatrics Society 69 (11): 3023–3033.
- Kirkland, J. (2024). Alleviation by Fisetin of Frailty, Inflammation, and Related Measures in Older Women (AFFIRM) (Zmírnění křehkosti, zánětu a souvisejících opatření u starších žen pomocí fisetinu). ClinicalTrials.gov ID: NCT03430037.
- Chirumbolo, S. (2010). Úloha kvercetinu, flavonolů a flavonů při modulaci zánětlivých funkcí buněk. Inflammation & Allergy-Drug Targets 9 (4): 263–285.
- Chirumbolo, S. (2011). Kvercetin jako potenciální protialergické léčivo: jaké perspektivy? Iran Journal of Allergy Asthma and Immunology (Časopis pro alergie, astma a imunologii). 10 (2): 139–140.
- Sagit, M. et al. (2017). Účinnost kvercetinu v experimentálním modelu alergické rýmy u potkanů. European Archives of Oto-Rhino-Laryngology. 274 (8): 3087–3095.
- Li, Y. et al. (2016). Quercetin, Inflammation and Immunity (Kvercetin, zánět a imunita). Nutrients 8 (3): 167.
- Costa, L. & Garrick, J. & Roquè, P. & Pellacani, C. (2016). Mechanismy neuroprotekce pomocí kvercetinu: Kercetin: proti oxidačnímu stresu a další. Oxidativní medicína a buněčná dlouhověkost. 2016: 2986796.
- Cui, Z. et al. (2022). Terapeutické využití kvercetinu u onemocnění souvisejících se stárnutím: SIRT1 jako potenciální mechanismus. Frontiers in Immunology 13: 943321.
- Suraweera, T. & Rupasinghe, H. & Dellaire, G. & Xu, Z. (2020). Regulation of Nrf2/ARE Pathway by Dietary Flavonoids [Regulace dráhy Nrf2/ARE pomocí flavonoidů v potravě]: A Friend or Foe for Cancer Management? Antioxidanty 9: 973.
- Salehi, B. et al. (2019). Terapeutický potenciál apigeninu. International Journal of Molecular Sciences 20 (6): 1305.
- Paredes-Gonzalez, X. et al. (2015). Indukce genové exprese zprostředkované NRF2 fytochemickými flavony apigeninem a luteolinem ve stravě. Biopharmaceutics & Drug Disposition 36 (7): 440–451.
- Ginwala, R. & Bhavsar, R. & Chigbu, D. & Jain, P. & Khan, Z. (2019). Potenciální role flavonoidů v léčbě chronických zánětlivých onemocnění se zvláštním zaměřením na protizánětlivou aktivitu apigeninu. Antioxidanty 8 (2): 35.
- Shukla, S. & Gupta, S. (2010). Apigenin: slibná molekula pro prevenci rakoviny. Pharmaceutical Research 27: 962–978.
- Sung, B. & Chung, H. & Kim, N. (2016). Úloha apigeninu v prevenci rakoviny prostřednictvím indukce apoptózy a autofagie. Journal of Cancer Prevention 21 (4): 216-226.
- Pan, H. & Finkel, T. (2017). Klíčové proteiny a dráhy regulující délku života. Journal of Biological Chemistry 292 (16): 6452–6460.
- Shukla, S. & Gupta, S. (2009). Apigenin potlačuje signalizaci receptoru pro inzulinu podobný růstový faktor I u lidského karcinomu prostaty: In vitro a in vivo studie. Molecular Carcinogenesis 48 (3): 243–252.
- Escande, C. et al. (2013). Flavonoid apigenin je inhibitorem NAD+ ase CD38: důsledky pro buněčný metabolismus NAD+, acetylaci proteinů a léčbu metabolického syndromu. Diabetes 62 (4): 1084–1093.
- Lim, H. & Park, H. & Kim, H. (2015). Účinky flavonoidů na tvorbu sekrečního fenotypu spojeného se senescencí z bleomycinem indukované senescence u BJ fibroblastů. Biochemická farmakologie 96 (4): 337–348.
- Salehi, B. et al. (2019). Terapeutický potenciál apigeninu. International Journal of Molecular Sciences 20 (6): 1305.