Mitochondrie jsou životně důležité organely umístěné v cytoplazmě eukaryotických buněk. Díky dobře fungujícím mitochondriím fungují všechny procesy v těle, od pohybu a cvičení až po trávení a regeneraci, lépe. Hrají zásadní roli při tvorbě energie a mnoha dalších buněčných procesech. V mitochondriích probíhá oxidativní fosforylace, při níž vzniká ATP, primární zdroj energie buňky. Strukturálně lze mitochondrie hodnotit prostřednictvím vnější membrány a vysoce skládané vnitřní membrány, která tvoří oddíly nezbytné pro jejich metabolismus. Vedle produkce energie vykonávají mitochondrie kromě apoptózy (programované smrti) i další činnosti, jako je signalizace vápníku a regulace buněčného metabolismu, což je činí nezbytnými pro udržení buněčné homeostázy.
Základy funkce mitochondrií
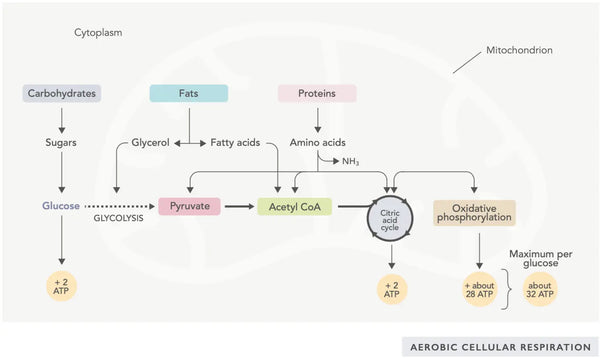
Tvorba ATP (primární energetické molekuly využívané buňkami) je základním rysem činnosti mitochondrií. Tento proces probíhá prostřednictvím dvou hlavních biochemických drah: cyklu kyseliny citronové (TCA cyklus nebo Krebsův cyklus) a elektronového transportního řetězce (ETC).
Cyklus kyseliny citronové
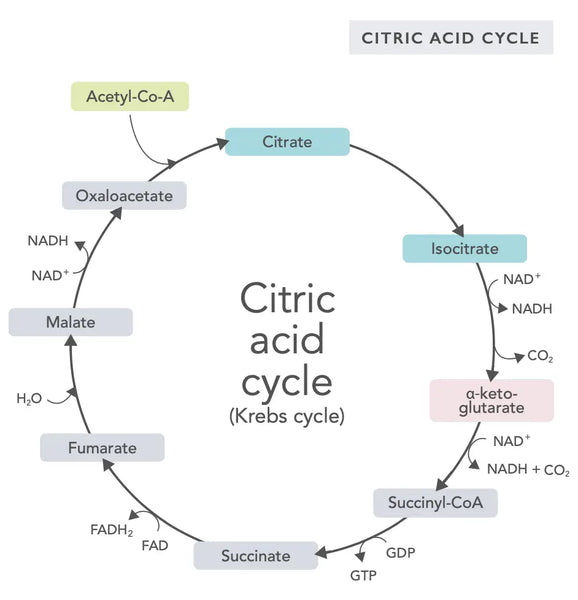
Cyklus kyseliny citronové neboli Krebsův cyklus (pojmenovaný podle nositele Nobelovy ceny Hanse Adolfa Krebse, který jej objevil) probíhá v buněčných mitochondriích.(1)Základní metabolickou složkou cyklu kyseliny citronové je kyselina octová (acetylkoenzym A) vznikající z mastných kyselin, sacharidů a bílkovin.(2)
Při různých reakcích cyklu kyseliny citronové (viz obrázek) vznikají vodíkové ionty a elektrony, které jsou následně přenášeny do vnitřní mitochondriální membrány pro oxidativní fosforylaci (vázání energie na molekuly ATP oxidací) a elektronový transportní řetězec. Při reakci se uvolňuje NADH a malé množství ATP a oxidu uhličitého.
Cyklus kyseliny citronové zahrnuje deset kroků, z nichž každý je ovlivněn vitaminy skupiny B, některými minerály, jako je hořčík a železo, a hlavním jaterním antioxidantem, glutathionem. Reakce jsou inhibovány těžkými kovy, jako je rtuť, arsen a hliník.
Energeticky bohaté molekuly NADH zachycují většinu energie vzniklé během cyklu kyseliny citronové. Na každou molekulu acetylkoenzymu A připadají tři molekuly NADH, které jsou pak využity jako energie v následující reakci (oxidativní fosforylace).
Regulace cyklu kyseliny citronové je dána dostupností různých aminokyselin a zpětnovazebnou inhibicí (například pokud vzniká příliš mnoho NADH, dochází k inhibici několika enzymů cyklu kyseliny citronové, což zpomaluje reakce).
Oxaloacetát je sloučenina, která uspokojuje náhlou potřebu výroby energie (například v mozku nebo ve svalech). Užívání doplňku stravy s oxaloacetátem může být užitečné a může dokonce podpořit regeneraci mitochondrií v mozku, snížit tichý zánět v těle a zvýšit počet nervových buněk.(3)
Jednoduše řečeno, tělo obsahuje důmyslné systémy, které přeměňují zkonzumovanou potravu na elektrony, používané jako energie pro různé potřeby.
Oxidační fosforylace
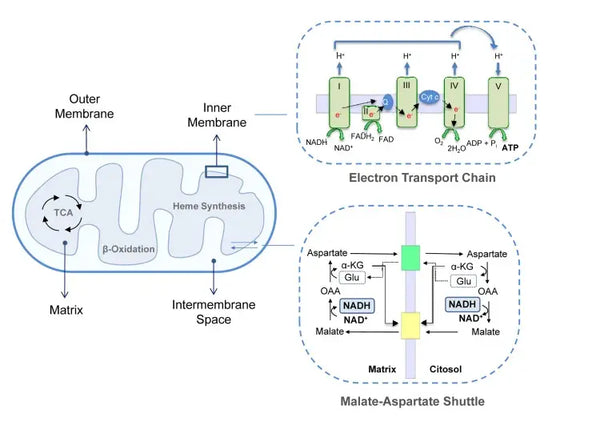
Oxidační fosforylace se skládá z elektronového transportního řetězce a ATP syntázy. Oxidační fosforylace produkuje nejvíce energie vznikající v aerobních podmínkách (ATP). Je pokračováním cyklu kyseliny citronové.
V elektronovém transportním řetězci se do mitochondriálního mezimembránového prostoru uvolňují vodíkové ionty (H+). Vodíkové ionty uvolněné z mezimembránového prostoru se přes ATP syntázu přesouvají zpět do mitochondrie. Pomocí energie uvolněné při tomto procesu ATP syntáza přemění ADP použitý na energii opět na ATP.
Ubichinon (koenzym Q10) se podílí na elektronovém transportním řetězci. Již desítky let se používá jako doplněk stravy. Nízká hladina ubichinonu v buňkách může být predispozičním faktorem různých onemocnění v důsledku nedostatečné aerobní produkce energie v buňkách. K nedostatku ubichinonu navíc přispívá užívání léků na cholesterol (statinů).(4)
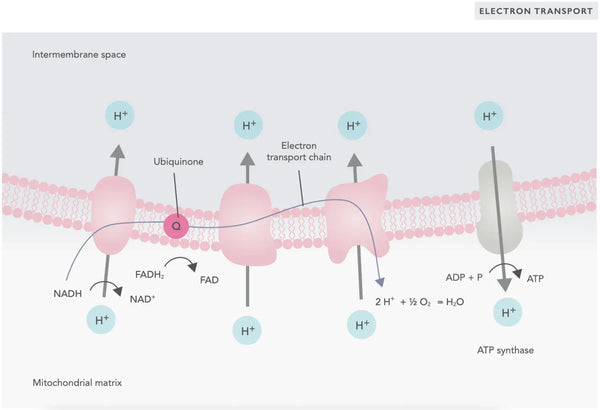
Tento koordinovaný soubor reakcí vytváří ATP a vytváří protonový gradient přes vnitřní mitochondriální membránu, což je proces známý jako tzv. chemiosmóza. Energie uložená v tomto gradientu pohání syntézu ATP a spojuje tok elektronů přes ETC s tvorbou buněčné energie.(5)
Faktory ovlivňující účinnost mitochondrií
Účinnost mitochondrií, která je samozřejmě nezbytná pro optimální funkci buněk, je ovlivňována různými faktory. Níže jsou popsány ty nejdůležitější.
Genetická výbava
Mitochondrie mají samostatnou a individuální DNA (mitochondriální DNA, mtDNA) odlišnou od jaderné DNA. MtDNA kóduje základní složky elektronového transportního řetězce a mitochondriální proteiny. Mutace v mtDNA mohou vést k nefunkčním proteinům, které narušují elektronový transportní řetězec a syntézu ATP. To může mít za následek sníženou produkci energie a zvýšenou tvorbu reaktivních forem kyslíku (ROS), což přispívá k mitochondriální a buněčné dysfunkci.(6)
Oxidační stres
Mitochondrie jsou významným zdrojem ROS, které jsou vedlejšími produkty metabolismu kyslíku. Zatímco nízké hladiny ROS fungují v buněčné signalizaci, nadměrné množství ROS může způsobit oxidační poškození mitochondriálních proteinů, lipidů a DNA. Tento oxidační stres narušuje integritu a funkci mitochondrií, inhibuje produkci ATP a vede k další produkci ROS ve škodlivém cyklu. Při zmírňování tohoto poškození hrají klíčovou roli antioxidační obranné látky, včetně superoxiddismutázy a glutathionperoxidázy.(7-8)
Dostupnost živin
Mitochondrie vyžadují k produkci energie specifické substráty. Glukóza a mastné kyseliny jsou primárními zdroji pro tvorbu ATP prostřednictvím glykolýzy, respektive β-oxidace. Dostupnost těchto substrátů přímo ovlivňuje funkci mitochondrií. Například v podmínkách nadbytku živin, jako je vysoká dostupnost glukózy, mohou mitochondrie produkovat nadměrné množství ATP a ROS, což může vést k metabolickým poruchám.(9-10)
Naopak nedostatek živin může omezit produkci energie v mitochondriích, což ovlivňuje funkci a přežití buněk. Na rozdíl od některých zpráv ze studií na zvířatech o přínosech kalorické restrikce pro biogenezi mitochondrií se zdá, že biogenezi mitochondrií nezvyšuje. Zachovává však mitochondriální funkci tím, že chrání integritu a funkci stávajících buněčných složek.(11-12)
Faktory životního stylu
Cvičení
Fyzická aktivita ovlivňuje množství a kvalitu mitochondrií. Cvičení stimuluje mitochondriální biogenezi, což vede ke zvýšení hustoty mitochondrií a účinnosti produkce energie.(13) Zejména vytrvalostní trénink zvyšuje oxidační kapacitu mitochondrií a zlepšuje jejich schopnost využívat kyslík k produkci ATP (podrobněji se dočtete dále v článku).
Strava
Složky stravy významně ovlivňují funkci mitochondrií. Poměr makroživin, kalorický příjem a specifické živiny (jako jsou antioxidanty, vitaminy a minerály) ovlivňují mitochondriální metabolismus. Strava bohatá na živiny, které podporují funkci mitochondrií, může zvýšit produkci energie a snížit oxidační stres (viz dále). Aktivace ketózy může také zvýšit mitochondriální biogenezi a zlepšit účinnost mitochondrií.(14-15)
Faktory životního prostředí
Vystavení environmentálním stresorům, jako jsou toxiny, znečišťující látky, těžké kovy (např. olovo, rtuť, arsen a kadmium) a záření, může negativně ovlivnit funkci mitochondrií. Tyto stresory mohou vyvolat oxidační poškození, narušit aktivitu elektronového transportního řetězce a narušit dynamiku mitochondrií, včetně fúzních a štěpných procesů.(16)
Technologické zásahy
Fotobiomodulace (nebo terapie červeným světlem)
Fotobiomodulace je využití neionizující fotonové energie k vyvolání fotochemických změn v buněčných strukturách, které jsou citlivé na fotony, zejména v mitochondriích. Předpokládá se, že terapie červeným světlem a NIR světlem působí především prostřednictvím fotoakceptorů. Vlny červeného světla pronikají kůží a dostávají se do buněčných mitochondrií, čímž zvyšují produkci energie v buňkách. K tomu vedou různé děje, například zrychlení mitochondriálního dýchání prostřednictvím cytochrom c oxidázy(17). O zdravotních přínosech fotobiomodulace si přečtěte zde.
Infračervená sauna
Infračervené sauny využívají infračervené záření, které ohřívá tělesné tkáně přímo namísto vzduchu. Frekvence záření vyzařovaného infrasaunami je 3-12 μm, což spadá do oblasti dalekého infračerveného záření (FIR). Bylo zjištěno, že daleké infračervené záření má účinky na úrovni tkání, zejména na dýchací řetězec mitochondrií v procesu výroby energie v buňkách a na prokrvení tkání rozšířením cév a zlepšením krevního oběhu.(18)
Terapie pulzním elektromagnetickým polem (PEMF)
Terapie PEMF využívá elektromagnetické pole k podpoře různých fyziologických procesů. Výzkum naznačuje, že PEMF může zlepšit funkci mitochondrií zvýšením spotřeby kyslíku v buňkách a zvýšením produkce ATP. Terapie PEMF přímo ovlivňuje mitochondrie a navrací buňky do zdravějšího stavu energie a elektrického náboje.(19-20) Přečtěte si komplexního průvodce terapií PEMF zde.
Hyperbarická oxygenoterapie (HBOT)
HBOT zahrnuje dýchání čistého kyslíku v prostředí pod tlakem. Bylo klinicky prokázáno, že hyperbarická oxygenoterapie revitalizuje mitochondrie a zvyšuje tvorbu ATP tím, že poskytuje nadfyziologické množství kyslíku nezbytné pro buněčné dýchání. Nedávná studie uvádí, že HBO zvýšila biogenezi mitochondrií a autofagii částečným zvýšením produkce reaktivních forem kyslíku. Při tomto procesu vznikaly nové zdravé mitochondrie a staré dysfunkční mitochondrie byly zničeny. Tato studie také zjistila zvýšenou aktivaci transkripce a replikace DNA mitochondrií.(21-22) Více informací o HBOT naleznete zde.
Výživa a doplňková podpora funkce mitochondrií
Úloha výživy při udržování zdraví mitochondrií je klíčová, přičemž některé živiny jsou pro optimální funkci mitochondrií obzvláště důležité. Patří mezi ně níže uvedené.
- Koenzym Q10 (CoQ10): Ubiquinon je rozpustný v tucích a podobá se vitaminu. Ubichinon funguje jako přenašeč elektronů v řetězci přenosu elektronů v mitochondriích (viz obrázek vpravo) a podporuje vylučování ATP. Hladiny ubichinonu se stárnutím snižují v různých tkáních.(23)
- Hořčík: Podílí se na syntéze ATP a má zásadní význam pro udržení integrity a funkce mitochondrií.(24)
- Vitaminy skupiny B: Obsahují vitaminy B1 (thiamin), B2 (riboflavin), B3 (niacin), B5 (kyselina pantotenová), B6, B7 (biotin) a B12. Tyto vitaminy skupiny B mají zásadní význam pro různé aspekty mitochondriálního energetického metabolismu.(25)
- Kyselina alfa-lipoová: ALA je silný antioxidant, který také pomáhá regenerovat ostatní antioxidanty. Má význam pro energetický metabolismus a může zlepšovat funkci mitochondrií.(26)
- Karnitin (konkrétně acetyl-L-karnitin): Přenáší mastné kyseliny do mitochondrií k beta-oxidaci, která je klíčová pro produkci energie, zejména ve svalových buňkách.(27)
- Kreatin: Kreatin je přirozeně se vyskytující sloučenina v těle, která pomáhá dodávat energii buňkám, zejména svalovým, tím, že zvyšuje tvorbu adenosintrifosfátu (ATP). Suplementace kreatinem může zvýšit účinnost mitochondrií, zejména při vysoce intenzivním cvičení.(28)
- Pyrrochinolin chinon (PQQ): PQQ je antioxidant, který zvyšuje biogenezi mitochondrií prostřednictvím obsahu proteinu PGC-1 a podporuje funkci mitochondrií.(29)
- Omega-3 mastné kyseliny (EPA a DHA): Omega-3 jsou nezbytné pro udržení tekutosti a funkce mitochondriální membrány. Nacházejí se především v rybím tuku a tučných rybách.(30)
- Nikotinamid ribosid (NR) a nikotinamidmononukleotid (NMN).: Tyto prekurzory NAD+ jsou nezbytné pro funkci mitochondrií a produkci energie. Doplnění NR nebo NMN může pomoci zvýšit hladinu NAD+, a tím zlepšit účinnost mitochondrií.(31) Více informací o optimalizaci NAD+ naleznete zde.
- Kurkumin: Kurkumin je účinnou látkou kurkumy. Bylo prokázáno, že chrání mitochondrie před oxidačním poškozením a zlepšuje jejich funkci.(32)
- Selen: Selen: základní stopový prvek, který se podílí na ochraně mitochondrií před oxidativním stresem. Selen také reguluje biogenezi mitochondrií.(33)
Cvičení a biogeneze mitochondrií
Pravidelná fyzická aktivita je rozhodujícím faktorem při podpoře biogeneze mitochondrií, která vede k tvorbě nových mitochondrií, čímž se zvyšuje jejich množství a funkční kapacita v buňkách. Různé formy cvičení mají na dynamiku mitochondrií odlišné účinky. Dvě nejdůležitější formy nebo cvičení jsou aerobní trénink a odporový trénink.
Aerobní cvičení
Mitochondriální hustota v buňkách kosterního svalstva se znatelně zvyšuje při aerobním cvičení (např. běh, jízda na kole a plavání).
Mitochondriální biogenezi reguluje PGC-1α (koaktivátor 1-alfa peroxizomového proliferátorem aktivovaného receptoru gama), základní regulační protein, jehož expresi aerobní cvičení stimuluje. PGC-1α koaktivuje jaderné respirační faktory (NRF) a mitochondriální transkripční faktor A (TFAM), které jsou nezbytné pro přepis mtDNA a replikaci mitochondrií. To vede ke zvýšení účinnosti oxidativní fosforylace, lepší vytrvalosti a větší tvorbě ATP ve svalových buňkách.(34)
Vysoce intenzivní intervalový trénink (HIIT) je obzvláště účinný pro zvýšení počtu mitochondrií a maximálního příjmu kyslíku (VO2max).(35-36)
Odporový trénink
Funkce a účinnost mitochondrií jsou hlavním cílem odporového tréninku (např. posilování s vlastní vahou a cvičení s tělesnou hmotností). Vyvolává změny v syntéze mitochondriálních bílkovin, čímž zvyšuje kvalitu a účinnost přítomných mitochondrií. Silový trénink také zvyšuje produkci enzymů v elektronových transportních řetězcích a Krebsově cyklu, což dále zlepšuje kapacitu buněk pro syntézu ATP. Může také zvýšit počet a velikost mitochondrií ve svalových buňkách, i když ne v takové míře jako aerobní cvičení.(37-38)
Kombinovaný účinek těchto způsobů cvičení na biogenezi a funkci mitochondrií zdůrazňuje význam fyzické aktivity pro udržení a zlepšení zdraví mitochondrií. Pravidelné zapojení aerobního a odporového tréninku komplexně zvyšuje hustotu, účinnost a energetický metabolismus mitochondrií v buňkách. Tyto adaptace mají zásadní význam pro sportovní výkon a jsou významné pro udržení zdraví, prevenci nemocí a zvládání stavů spojených s mitochondriální dysfunkcí.
Je však třeba si uvědomit, že souběžný silový a vytrvalostní trénink vede k menší adaptaci, protože proteinkinázy PKB a AMPK si navzájem blokují navazující signalizaci, což brání současnému tréninkovému efektu.(39)
Mitofágie a buněčné zdraví
Mitofagie označuje selektivní typ autofagie, který hraje zásadní roli v buněčných podmínkách tím, že dokáže degradovat pouze poškozené nebo nefunkční mitochondrie. Tento mechanismus má zásadní význam pro zdraví mitochondrií a buňky, protože zabraňuje vzniku mRNA, které kódují defektní sestavu podjednotek, a tím zabraňuje dalším krizím buněčných funkcí a četným patologickým stavům.(40)
Eliminace poškozených mitochondrií prostřednictvím mitofágie pomáhá snižovat oxidační stres, apoptózu a zánět (související s různými patologiemi). Narušená mitofagie usnadňuje hromadění dysfunkčních mitochondrií v patogenezi neurodegenerativních poruch, jako je Parkinsonova a Alzheimerova choroba. Podobně u metabolických poruch vede ztráta mitofagie ke změnám mitochondriálního metabolismu, což má za následek inzulinovou rezistenci a diabetes 2. typu.(41-42)
Bylo prokázáno, že omezení příjmu kalorií podporuje mitofágii. Důvodem je částečně aktivace sirtuinů (SIRT1), AMP-aktivované proteinkinázy (AMPK) a transkripčního faktoru EB, které podporují jak odpověď na energetickou krizi buňky, tak iniciaci mitofagie. Konkrétně sirtuiny regulují funkci faktorů v mechanismu mitofagie, čímž umlčují poškozené mitochondrie.(43)
Molekulární účinky kalorické restrikce napodobují sloučeniny, jako je resveratrol (polyfenol v červeném víně a některých bobulovinách) a mnoho dalších polyfenolů. Resveratrol podporuje aktivaci SIRT1 a AMPK, čímž zvyšuje mitofagii zodpovědnou za zlepšení funkce mitochondrií a obnovu zdraví buněk.(44-45)
Mitofagii lze posílit přerušovaným hladověním. Toto zlepšení je pravděpodobně zmírněno metabolickým přechodem z energie založené na glukóze na energii založenou na ketonech během půstu a tento přechod spouští mitofagii.(.46-47)
Mitochondriální dysfunkce jako znak stárnutí
Pochopení toho, jak mitochondrie přispívají k procesu stárnutí, je v centru pozornosti gerontologického výzkumu a výzkumu buněčné biologie. S přibývajícím věkem organismů se stále častěji vyskytuje mitochondriální dysfunkce, která hraje roli ve fyziologické stránce stárnutí.
Stárnoucí mitochondrie vykazují sníženou produkci ATP, což má vliv na procesy poháněné energií, které jsou nezbytné pro dobrý stav buněk. Do tohoto poklesu energetické produkce navíc ještě více zasahují strukturální změny mitochondrií spojené s věkem, jako je abnormální složení membránového potenciálu mitochondrií a integrita stěny vnitřní mitochondrie.(48)
Postavení mitochondriální DNA (mtDNA) v blízkosti elektronového transportního řetězce, kde dochází k reaktivním formám kyslíku, ovlivňuje její zranitelnost vůči mutacím. Mutace se však časem hromadí, což vede k mitochondriální dysfunkci. Na rozdíl od jaderné DNA, která je kvůli ochraně vázána na histony a má k dispozici řadu opravných mechanismů, mtDNA postrádá ochranný obal histony a nemá širokou škálu opravných metod, takže může být snadno poškozena.(49)
V buňkách mitochondrie produkují reaktivní kyslíkové spektrum (ROS). Přestože ROS slouží buňce jako kritický prostředek pro komunikaci s okolím a jeho přizpůsobení, je tvorba vysokých hladin těchto molekul omezena přísnou kontrolou. Nadměrná produkce při různých stavech souvisejících s věkem vede k tomu, že buňky trpí oxidačním stresem. Ten ničí různé buněčné složky, ať už proteiny, lipidy nebo DNA. Mitochondrie jsou dokonce hlavním příjemcem oxidačního poškození, což vytváří začarovaný kruh, protože poškozené mitochondrie pouze generují další ROS, čímž se zvyšuje buněčná stárnutí.(50-52)
Pro funkci mitochondrií je klíčová jejich dynamika, která pomáhá udržovat proces fúze a dělení. Tato dynamika se však stárnutím narušuje a mitochondrie místo fúze podléhají fragmentaci. Tyto změny ovlivňují funkci mitochondrií a jejich postavení v buňkách.(53)
Ztráta mitochondriální funkce není pasivním jevem souvisejícím se stárnutím, ale aktivním účastníkem patogeneze nemocí závislých na věku. Mitochondriální dysfunkce je spojována se stavy, jako jsou neurodegenerativní onemocnění, kardiovaskulární choroby a metabolické poruchy. U těchto poruch mají v patogenezi a průběhu onemocnění zásadní význam snížená nebo defektní tvorba energie, zvýšený oxidační stres a neschopnost odstranit poškozené mitochondrie.(54)
Závěr
Optimalizace zdraví mitochondrií a jeho zhoršování se stárnutím je náročný úkol, ale naštěstí pro něj můžeme mnohé udělat. Hlavní intervence zahrnují nutriční podporu kritických substrátů pro regeneraci, včetně koenzymu Q10, hořčíku a vitaminů skupiny B, pravidelnou účast na různých pohybových disciplínách, které zvyšují biogenezi mitochondrií, a úpravy životního stylu, jako je omezení příjmu kalorií nebo přerušované hladovění, které ovlivňují mechanismy mitofágie.
Vzhledem k tomu, že mitochondriální dysfunkce je jedním z faktorů stárnutí, jsou tyto strategie nezbytné pro podporu buněčného zdraví a boj proti degradaci související s věkem. Integrativní přístupy využívající sílu vědecky podložených poznatků v kombinaci s použitelnými změnami životního stylu mohou vytvořit příznivé podmínky pro prevenci a zpomalení opotřebení mitochondrií, které celkově slouží blahu a dlouhověkosti jedince.
Vědecké odkazy
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900-1981), průkopník moderní medicíny, architekt intermediárního metabolismu. Journal of Medical Biography 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biochemie. Vydání páté. Kapitola 17, Cyklus kyseliny citronové. New York: W. H. Freeman.
- Wilkins, H. et al. (2014). Oxaloacetát aktivuje biogenezi mozkových mitochondrií, posiluje inzulínovou dráhu, snižuje zánět a stimuluje neurogenezi. Human Molecular Genetics 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Primární a sekundární nedostatek koenzymu Q10: role terapeutické suplementace. Nutrition Reviews 71 (3): 180–188. Recenze.
- Saraste, M. (1999). Oxidativní fosforylace na konci století. Science 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Lidské mitochondriální tRNA: biogeneze, funkce, strukturální aspekty a nemoci. Annual Review of Genetics. 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Jsou mitochondrie hlavním přispěvatelem reaktivních forem kyslíku v buňkách? Journal of Experimental Biology 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Reaktivní formy kyslíku v buněčné signalizaci. American Journal of Physiology-Lung Cellular and Molecular Physiology. 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Mechanismy produkce bioenergie v mitochondriích. Mitochondrie a jejich role v kardiovaskulárních onemocněních. 99–121.
- Bottje, W. (2019). Oxidační metabolismus a účinnost: křehké vyvažování mitochondrií. Poultry science 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Dostupnost živin spojuje mitochondrie, apoptózu a obezitu. Aging (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). Chronická kalorická restrikce zachovává mitochondriální funkce v senescenci bez zvýšení mitochondriální biogeneze. Cell Metabolism 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Molekulární mechanismy mitochondriální adaptace na cvičební trénink v kosterním svalu. The FASEB Journal 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Regulace mitochondriální biogeneze. Essays in Biochemistry 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Metabolická terapie založená na ketonech: je zvýšení NAD+ primárním mechanismem? Frontiers in Molecular Neuroscience 10: 377.
- Fowler, B. (1978). Obecné subcelulární účinky olova, rtuti, kadmia a arsenu. Environmental Health Perspectives 22:37-41.
- Hamblin, M. (2018). Mechanismy a mitochondriální redoxní signalizace ve fotobiomodulaci. Photochemistry and Photobiology 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Dálkové infračervené záření (FIR): jeho biologické účinky a lékařské aplikace. Photonics and Lasers in Medicine (Fotonika a lasery v medicíně). 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). Elektromagnetická stimulace zvyšuje mitochondriální funkci v osteogenních buňkách a podporuje opravu kostních zlomenin. Scientific Reports 11 (1): 19114.
- Tai, Y. et al. (2020). Magnetická pole modulují metabolismus a střevní mikrobiom v korelaci s expresíPgc-1 alfa: V návaznosti na magnetickou mitohormetickou studii in vitro. The FASEB Journal 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). The effect of hyperbaric oxygen on mitochondrial and glycolytic energy metabolism: the caloristasis concept [Vliv hyperbarického kyslíku na mitochondriální a glykolytický energetický metabolismus: koncept kaloristázy]. Buněčný stres a chaperony 25 (4): 667-677.
- Chen, W. et al. (2020). Hyperbarický kyslík chrání před ischemicko-reperfuzním poškozením myokardu prostřednictvím inhibice dysfunkce mitochondrií a autofagie. Molecular Medicine Reports 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). Složitost tvorby ubichinonu. Trendy v endokrinologii a metabolismu. 30 (12): 929-943.
- Volpe, S. (2013). Hořčík v prevenci nemocí a celkovém zdraví. Pokroky ve výživě 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O'Brien, P. (2006). Mitochondriální funkce a toxicita: úloha rodiny vitaminů B na mitochondriální energetický metabolismus. Chemicko-biologické interakce 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Metabolismus kyseliny lipoové a mitochondriální redoxní regulace. Journal of Biological Chemistry 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Carnitine in human muscle bioenergetics: can carnitine supplementation improve physical exercise? Molecules 25 (1): 182.
- Wax, B. et al. (2021). Creatine for exercise and sports performance, with recovery considerations for healthy populations (Kreatin pro cvičení a sportovní výkon s ohledem na regeneraci u zdravé populace). Nutrients 13 (6): 1915.
- Hwang, P. et al. (2020). Účinky suplementace pyrrochinolinchinonem (PQQ) na aerobní výkon a ukazatele mitochondriální biogeneze u netrénovaných mužů. Journal of the American College of Nutrition. 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014): "Mírné zvýšení kvality metabolismu v tělesných buňkách. Ovlivnění složení mitochondriální membrány a bioenergetiky prostřednictvím suplementace omega-3. The Journal of Physiology 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). Nikotinamid ribosid zvyšuje metabolom NAD+ stárnoucích lidských kosterních svalů a indukuje transkriptomické a protizánětlivé podpisy. Cell Reports 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Curcumin, mitochondrial biogenesis, and mitophagy: Exploring recent data and indicating future needs (Kurkumin, mitochondriální biogeneze a mitofágie: Zkoumání nejnovějších údajů a naznačení budoucích potřeb). Biotechnologické pokroky 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Selen, mikronutrient, který moduluje kardiovaskulární zdraví prostřednictvím redoxní enzymologie. Nutrients 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Regulace PGC-1α, uzlového regulátoru mitochondriální biogeneze. The American Journal of Clinical Nutrition 93 (4): 884S-890S.
- Helgerud, J. et al. (2007). Aerobní intervaly vysoké intenzity zlepšují VO2max více než mírný trénink. Medicine and Science in Sports and Exercise 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Podobné metabolické adaptace během cvičení po nízkoobjemovém sprintovém intervalovém a tradičním vytrvalostním tréninku u lidí. Journal of Physiology 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Differential effects of resistance and endurance exercise in the fed state on signalling molecule phosphorylation and protein synthesis in human muscle [Rozdílné účinky odporového a vytrvalostního cvičení ve stavu nasycení na fosforylaci signálních molekul a syntézu proteinů v lidském svalu]. The Journal of Physiology 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Resistance exercise training alters mitochondrial function in human skeletal muscle (Odporový trénink mění mitochondriální funkce v lidském kosterním svalu). Medicine and Science in Sports and Exercise 47 (9): 1922-1931.
- Baar, K. (2006). Trénink vytrvalosti a síly: poučení z buněčné signalizace. Medicine & Science in Sports & Exercise 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Dráhy mitofágie pro kontrolu kvality a odstraňování mitochondrií. Buněčná smrt a diferenciace 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitochondrie a osa autofagie - zánět - buněčná smrt v procesu stárnutí organismu. Science 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitophagy: A promising therapeutic target for neuroprotection during ageing and age-related diseases (Mitofágie: slibný terapeutický cíl pro neuroprotekci během stárnutí a nemocí souvisejících s věkem). British Journal of Pharmacology 180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Kalorická restrikce: je AMPK klíčovým senzorem a efektorem? Physiology 26 (4): 214-224.
- Um, J. et al. (2010). Myši s deficitem AMP-aktivované proteinkinázy jsou odolné vůči metabolickým účinkům resveratrolu. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Antiaging vlastnosti antioxidantu získaného z hroznů jsou regulovány mitochondriální rovnováhou fúze a dělení vedoucí k mitofagii spouštěné signální sítí Sirt1-Sirt3-Foxo3-PINK1-PARKIN. Oxidační medicína a buněčná dlouhověkost 2014: 345105.
- Longo, V. & Panda, S. (2016). Hladovění, cirkadiánní rytmy a časově omezené krmení ve zdravé délce života. Cell Metabolism 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I& Sahebkar, A. (2020). The effect of fasting or calorie restriction on mitophagy induction: a literature review [Vliv hladovění nebo kalorické restrikce na indukci mitofágie: přehled literatury]. Journal of Cachexia, Sarcopenia and Muscle (Časopis o kachexii, sarkopenii a svalové tkáni). 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Oxidativní stres, mutace mitochondriální DNA a poškození antioxidačních enzymů při stárnutí. Experimental Biology and Medicine 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). mtDNA Mutations and Their Role in Aging, Diseases and Forensic Sciences (Mutace mtDNA a jejich role ve stárnutí, nemocech a forenzních vědách). Stárnutí a nemoci 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Generace reaktivních forem kyslíku mitochondriemi. Antioxidanty 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Reaktivní formy kyslíku a mitochondrie: Mitochondrie: mitochondrie a mitochondrie: spojnice buněčné homeostázy. Redox Biology 6: 472-485.
- Correia-Melo, C. et al. (2016). Mitochondrie jsou nezbytné pro pro-stárnoucí rysy senescentního fenotypu. The EMBO Journal 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Mitochondriální fúzní a štěpné proteiny jako nové terapeutické cíle pro léčbu kardiovaskulárních onemocnění. European Journal of Pharmacology 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitophagy: an emerging role in aging and age-associated diseases (Mitofágie: nová role ve stárnutí a nemocech spojených s věkem). Frontiers in Cell and Developmental Biology. 8: 200.