Studium odolnosti z pohledu genetiky je stále se rozšiřující oblastí zájmu, která se často prolíná s obory psychologie, neurobiologie a genomiky. Ačkoli je koncept odolnosti - schopnosti zotavit se z nepříznivých událostí nebo stresu nebo se jim přizpůsobit - mnohostranný a ovlivněný složitou souhrou genetických, environmentálních a psychologických faktorů, byly vyvinuty specifické testy DNA, které osvětlují genetické složky této vlastnosti.
Úvod
Geny jsou úseky DNA, které obsahují instrukce, jež tělo potřebuje k výrobě každého z mnoha tisíc proteinů potřebných pro život. Každý gen se skládá z tisíců kombinací "písmen" (tzv. bází), které tvoří váš genetický kód. Tento kód dává instrukce pro tvorbu bílkovin potřebných pro správný vývoj a funkci.(1)
Genetické odchylky mohou ovlivnit expresi genu, a tím ovlivnit metabolické procesy, které jsou důležité pro udržení zdraví buněk a pro to, jak reagujeme na zásahy prostředí, jako je strava, životní styl, doplňky stravy a léky.
Znalost těchto genetických variací nabízí jedinečný vhled do biologických systémů a umožňuje zdravotníkům doporučit přesné zásahy zaměřené na pomoc při dosahování cílů a optimálního zdraví.
Porozumění genetickým markerům odolnosti
Resilience-schopnost zotavit se z nepříznivé situace nebo změny nebo se jim snadno přizpůsobit - je stále více vnímána prostřednictvím genetiky. Zkoumáním genetických markerů se vědci a lékaři snaží odhalit biologické základy, které by mohly vysvětlit, proč se někteří jedinci vzpamatovávají ze stresu a traumat lépe než jiní.(2) Tato rozvíjející se oblast zkoumání se zaměřuje na testy DNA související s odolností, které zkoumají genetické markery potenciálně zodpovědné za rozdíly v individuálních reakcích na stres.
Jádrem tohoto výzkumu je endokrinní a nervový systém. (zejména autonomní nervový systém), který je ústředním prvkem reakce organismu na stres. Ústřední oblastí zájmu je zejména osa hypotalamus-hypofýza-nadledvinky (HPA), která hraje klíčovou roli v regulaci mechanismu reakce organismu na stres. Tato složitá síť interakcí mezi hypotalamem, hypofýzou a nadledvinami řídí produkci a regulaci klíčových stresových hormonů, jako je kortizol.
Kortizol má dalekosáhlé účinky na mnoho tělesných funkcí a uvolňuje se v reakci na stres a nízkou koncentraci glukózy v krvi. Za normálních okolností pomáhá kortizol obnovit homeostázu po stresových událostech. Genové odchylky, které ovlivňují osu HPA, však mohou vést k rozdílům ve způsobu tvorby, regulace a odstraňování kortizolu z těla. Tyto genetické odchylky mohou ovlivnit fyziologickou odolnost jedince - jeho schopnost udržet si nebo se rychle vrátit k psychickému a fyzickému zdraví po těžkostech.(3)
Testy DNA na odolnost zkoumají varianty genů spojené s receptory pro stresové hormony, bílkoviny zapojené do dráhy stresových hormonů a enzymy, které tyto hormony metabolizují. Například varianta genu FKBP5, který se podílí na regulaci citlivosti glukokortikoidního receptoru, jehož prostřednictvím působí kortizol, by mohla modifikovat reakci jedince na stres a potenciálně i jeho náchylnost k poruchám souvisejícím se stresem. V centru pozornosti jsou také geny, které kódují neurotransmitery - chemické posly mozku, kteří přispívají k regulaci nálady a poznávání. Patří mezi ně geny jako COMT, který se podílí na odbourávání dopaminu, neurotransmiteru spojeného se systémem potěšení a odměny.(4)
Kromě toho, zánět je biologický proces, který úzce souvisí se stresem a poruchami nálady. Chronický zánět, který mohou ovlivnit genetické odchylky, může mít vliv na funkci mozku a chování.(5) Genetické testy se tedy mohou snažit identifikovat také varianty v genech prozánětlivých cytokinů, jako jsou IL-6 a TNF, které by mohly jedince předurčovat k dlouhodobým zánětlivým reakcím a ovlivňovat jejich psychickou odolnost.
Pochopení těchto genetických markerů je základním kamenem pro personalizované intervence. Díky identifikaci genetických predispozic mohou jednotlivci podniknout proaktivní kroky k posílení své odolnosti prostřednictvím úprav životního stylu, psychologických strategií a léčby přizpůsobené jejich jedinečné genetické výbavě. Tento přístup je příkladem posunu směrem k precizní medicíně, kdy univerzální model ustupuje individualizované péči.
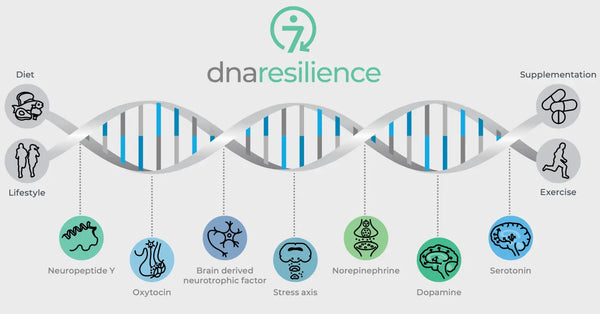
Obrázek: Sedm molekulárních cest odolnosti.
Typy testů DNA na odolnost
1) Geny pro reakci na stres
Geny stresové reakce jsou kritickými složkami systému našeho těla pro zvládání stresorů a reakci na ně. Kódují bílkoviny, které regulují různé fyziologické procesy, včetně uvolňování a působení kortizolu, hormonu, který je pro stresovou reakci klíčový.
CRHR1 (Corticotropin-Releasing Hormone Receptor 1)
CRHR1 kóduje receptor pro kortikotropin uvolňující hormon (CRH), ústřední hormon iniciující stresovou reakci. Když se CRH naváže na CRHR1, stimuluje produkci a uvolňování adrenokortikotropního hormonu (ACTH), který podněcuje nadledviny k produkci kortizolu. Varianty v genu CRHR1 mohou ovlivnit citlivost tohoto receptoru na CRH, což může změnit celkovou reakci na stres. Některé polymorfismy mohou například vést ke zvýšené reakci na stres, což může přispívat ke vzniku úzkosti nebo deprese. Jiné naopak mohou reakci tlumit, což ovlivňuje schopnost zvládat akutní stres.(6-7)
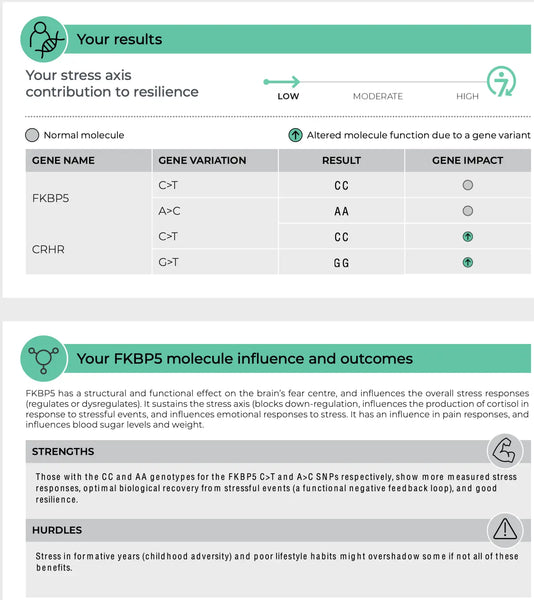
FKBP5 (FK506 Binding Protein 5)
Gen FKBP5 hraje roli v regulaci citlivosti glukokortikoidního receptoru, což je receptor, přes který kortizol uplatňuje své účinky. Specifické polymorfismy v genu FKBP5 jsou spojeny se změněnou zpětnovazebnou inhibicí osy HPA a rozdílnou odpovědí na glukokortikoidy. Některé varianty FKBP5 mohou například snižovat afinitu glukokortikoidního receptoru ke kortizolu, což může vést ke zhoršené reakci na stres a zvýšenému riziku psychiatrických poruch souvisejících se stresem, jako je posttraumatická stresová porucha nebo závažná deprese.(8-9)
Obrázek: Ukázka stránky Test odolnosti DNA.
NR3C1 (Nukleární receptory podrodiny 3, skupina C, člen 1)
NR3C1 kóduje samotný glukokortikoidní receptor. Změny v tomto genu mohou ovlivnit způsob, jakým tělo reaguje na kortizol. Specifické polymorfismy v NR3C1 mohou ovlivňovat citlivost nebo hustotu glukokortikoidních receptorů, což má vliv na to, jak účinně může kortizol plnit své funkce. To může vést k různým reakcím, od tlumené reakce na stres, která může jedinci bránit v adekvátní reakci na stresory, až po přehnanou reakci, která může vyústit v chronické stresové příznaky a dokonce v depresi.(10-12)
Výsledky testování genů stresové reakce mohou poskytnout informace o predispozicích jedince ke zdravotním problémům souvisejícím se stresem. Např:
-
Zvýšená reakce na stres: Jedinci se specifickými variantami mohou být reaktivnější na stres a během stresových událostí mohou mít vyšší hladinu kortizolu.
-
Snížená reakce na stres: Naopak někteří jedinci mohou mít otupenou stresovou reakci, která může být ochranou v akutních stresových situacích, ale může také bránit aktivaci potřebných fyziologických mechanismů v reakci na výzvy.
2) Vysvětlení funkčních testů neurotransmiterů
Testy funkce neurotransmiterů jsou určeny ke zkoumání genetických faktorů, které ovlivňují syntézu, uvolňování a odbourávání neurotransmiterů v mozku. Protože neurotransmitery jsou chemickými posly, kteří regulují náladu, poznávání a reakce na stres, mohou mít odchylky v genech souvisejících s těmito látkami významný vliv na psychickou odolnost a celkové duševní zdraví jedince.
Zkoumání funkce neurotransmiterů v souvislosti s odolností a reakcí na stres přesahuje rámec pouze katecholaminů, jako je dopamin. Zahrnuje širší spektrum neurotransmiterových systémů, které se podílejí na regulaci nálady, bdělosti a kognitivních funkcích. Na syntéze, signalizaci a odbourávání těchto neurotransmiterů se podílí několik genů, včetně dopamin beta-hydroxylázy (DBH), dopaminových receptorů (DRD2, DRD4) a různých genů souvisejících se serotoninem.(13)
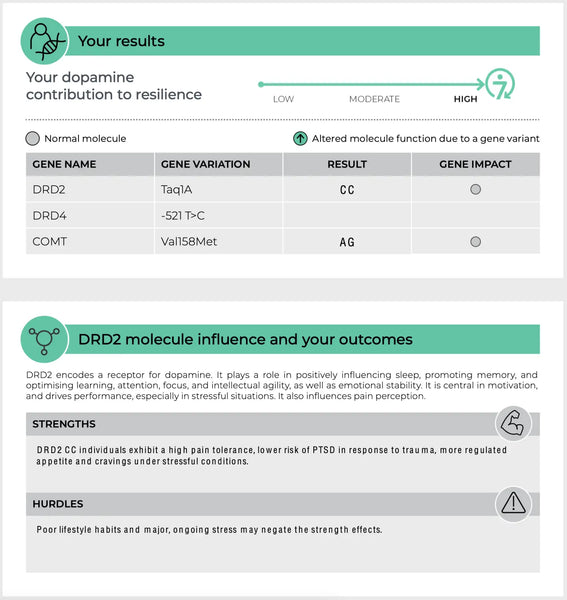
COMT (katechol-O-metyltransferáza)
Gen COMT je jedním z nejrozsáhleji studovaných genů týkajících se funkce neurotransmiterů. Kóduje enzym, který rozkládá katecholaminy - jako jsou dopamin, adrenalin a noradrenalin - neurotransmitery důležité pro reakci na stres, poznávání a regulaci emocí.
V genu COMT existují známé polymorfismy, například varianta Val158Met. Tato varianta může různými způsoby ovlivňovat úroveň aktivity enzymu:(14-15)
- Forma s vysokou aktivitou (varianta Val): Tato forma enzymu odbourává dopamin rychleji, což může vést ke snížení hladiny dopaminu v prefrontální kůře, což je oblast mozku, která se podílí na výkonných funkcích a rozhodování. Jedinci s touto variantou mohou lépe plnit úkoly za stabilních podmínek, ale mohou být náchylnější k poklesu kognitivních funkcí při stresu v důsledku nižší dostupnosti dopaminu.
- Forma s nízkou aktivitou (varianta Met): Tato forma enzymu COMT naopak metabolizuje dopamin pomaleji, což vede k vyšší hladině dopaminu v mozku. To může zlepšit kognitivní funkce při stresu, ale může to také zvýšit riziko psychopatologií souvisejících se stresem, jako jsou úzkostné poruchy, protože mozek je potenciálně nadměrně stimulován nadbytkem dopaminu.
Dopamin beta-hydroxyláza (DBH)
DBH je enzym, který přeměňuje dopamin na noradrenalin, neurotransmiter podílející se na reakci bojuj nebo uteč. Genetické odchylky v genu DBH mohou ovlivňovat aktivitu enzymu, což má vliv na hladinu dopaminu a noradrenalinu v mozku a periferním nervovém systému.(16-18)
- Nízká aktivita: Varianty spojené s nižší aktivitou DBH mohou vést k vyšší hladině dopaminu a nižší hladině noradrenalinu, což může ovlivnit kognitivní funkce, jako je pozornost a rozhodování, a ovlivnit způsob, jakým jedinec reaguje na stres.
- Vysoká aktivita: Varianty, které vedou k vyšší aktivitě DBH, mohou naopak snižovat hladinu dopaminu a zároveň zvyšovat hladinu noradrenalinu, což může mít vliv na reaktivitu na stres a úzkost.
Dopaminové receptory (DRD2 a DRD4)
DRD2 a DRD4 jsou geny, které kódují dopaminové receptory D2, respektive D4. Tyto receptory jsou součástí dopaminového systému, který reguluje řadu funkcí, včetně nálady, odměny a řízení motoriky.(19-20)
- DRD2: Varianty v genu DRD2 mohou ovlivnit hustotu a vazebnou afinitu receptorů D2. To může ovlivnit zranitelnost vůči stresu a účinnost signálů souvisejících s odměnou, což může mít potenciální důsledky pro stavy, jako je závislost a deprese.
- DRD4: Gen DRD4 je známý variabilním počtem tandemových opakování (VNTR) v kódující oblasti. Specifické repetice jsou spojeny s vlastnostmi, jako je vyhledávání novinek a riziko poruch pozornosti. Tento polymorfismus může ovlivňovat účinnost synaptické dopaminové signalizace a byl studován v souvislosti s behaviorální a psychologickou odolností.
Obrázek: Příklad stránky Test odolnosti DNA.
Varianty genu pro serotonin
Serotonin je dalším klíčovým neurotransmiterem v regulaci nálady, chuti k jídlu a spánku, které mohou být ovlivněny stresem. Zajímavých je několik genů, které se podílejí na signalizaci serotoninu:
- 5-HTT (SLC6A4): Tento gen kóduje serotoninový transportér, který je zodpovědný za zpětné vychytávání serotoninu ze synaptické štěrbiny. Polymorfismus 5-HTTLPR v promotorové oblasti tohoto genu byl studován pro jeho souvislost s citlivostí na stres a poruchami nálady.(21)
- MAOA: Gen pro monoaminooxidázu A je zodpovědný za odbourávání serotoninu. Variace v tomto genu mohou ovlivňovat hladinu serotoninu a byly spojeny s rysy chování a náchylností ke stresu.(22)
- TPH2: Tryptofanhydroxyláza-2 je enzym, který je rozhodující pro syntézu serotoninu v mozku. Genetické odchylky v TPH2 mohou ovlivňovat produkci serotoninu, což může mít vliv na emoční regulaci a reakci na stres.(23)
Interpretace výsledků těchto testů může být složitá. Například varianta spojená s vyšším rizikem stavů souvisejících se stresem nemusí nutně znamenat, že se u jedince tyto stavy vyvinou, ale může naznačovat zvýšenou zranitelnost. Stejně tak vlastnictví varianty "odolnosti" nezaručuje nezpochybnitelnou odolnost vůči stresu, protože podstatnou roli hrají faktory prostředí a volba životního stylu.
3) Zánět a jeho vliv na mozek
Chronický zánět může být škodlivý pro zdraví mozku. Předpokládá se, že přispívá k rozvoji a progresi neurodegenerativních onemocnění a může ovlivňovat reakci mozku na stres, která je úzce spojena s odolností. Prozánětlivé cytokiny, jako je interleukin-6 (IL-6) a tumor nekrotizující faktor (TNF), mohou procházet hematoencefalickou bariérou a zasahovat do drah, které regulují náladu, motivaci a bdělost.(24)
Genové varianty spojené se zánětem
IL-6 (interleukin-6)
IL-6 je cytokin, který hraje roli v zánětlivé reakci a podílí se na různých biologických funkcích, včetně imunitní odpovědi, krvetvorby a metabolismu kostí. V souvislosti se stresem a odolností souvisí IL-6 s následujícími faktory:(25-26)
- Zvýšené hladiny IL-6 jsou spojeny s vyšším rizikem vzniku deprese a dalších poruch nálady.
- Specifické genetické varianty genu pro IL-6 mohou vést ke zvýšené expresi IL-6, což potenciálně zhoršuje zánětlivou reakci a mění schopnost mozku vyrovnat se se stresem.
TNF (tumor nekrotizující faktor)
TNF je další cytokin, který se podílí na systémovém zánětu. Má různé role, včetně regulace imunitních buněk a indukce horečky, apoptózy a zánětu.(27)
- Nadměrná exprese TNF je spojována s různými chronickými onemocněními, včetně revmatoidní artritidy, zánětlivých střevních onemocnění a lupénky, a také s psychickým stresem a depresí.
- Varianty v genu TNF mohou ovlivňovat úroveň produkce TNF, což může mít přímý vliv na zánětlivé procesy v celém těle a mozku.
4) Neurobiologické regulátory a faktory odolnosti
Genetické odchylky v klíčových neurobiologických regulátorech také řídí odolnost vůči stresu. Mezi ně patří oxytocin, neurotrofický faktor odvozený od mozku (BDNF) a neuropeptid Y (NPY). Oxytocin hraje roli v regulaci sociálního chování a reakcí na stres. BDNF je klíčový pro udržení neuroplasticity a kognitivních funkcí při stresu a NPY moduluje úzkost a fyziologickou reakci na stres. Tyto molekuly společně ovlivňují naše nervové obvody a psychickou odolnost, což poskytuje vhled do individuálních rozdílů v odolnosti vůči stresu a potenciální možnosti pro personalizované biohackingové strategie.
Oxytocin
Oxytocin je často nazýván "hormonem lásky", protože hraje roli v sociální vazbě, mateřském chování a intimitě. Má také anxiolytické účinky a ovlivňuje sociální poznávání a chování.
- Genetický vliv: Změny v genu pro oxytocinový receptor (OXTR) jsou spojeny s regulací emocí, sociálním chováním a reakcí na stres. Specifické polymorfismy v genu OXTR mohou ovlivňovat vazebnou účinnost a úroveň exprese oxytocinových receptorů, což může mít vliv na schopnost jedince zvládat stres a navazovat sociální vztahy.(28)
- Důsledky: V kontextu testování odolnosti může posouzení variant OXTR poskytnout náhled na predispozici jedince k sociální úzkosti, úroveň empatie a potenciální odolnost vůči stresu, zejména tomu, který zahrnuje sociální dynamiku.(29)
Neurotrofický faktor odvozený od mozku (BDNF)
BDNF je klíčový protein, který se podílí na neuroplasticitě, schopnosti mozku reorganizovat a vytvářet nová nervová spojení v průběhu života. Má zásadní význam pro učení, paměť a regeneraci neuronů.(30)
- Genetické odchylky: Varianta genu BDNF Val66Met je jedním z nejvíce studovaných polymorfismů. Alela Met je spojena se sníženou sekrecí BDNF v závislosti na aktivitě, což může mít vliv na kognitivní funkce a odolnost vůči neurologickým a psychiatrickým poruchám.(31)
- Důsledky: Testování variant genu BDNF by mohlo pomoci předpovědět schopnost neuroplasticity jedince v reakci na stres a mohlo by mít vliv na zotavení po neurologických poraněních nebo traumatech.(32)
Obrázek: Ukázka stránky Analýza testu odolnosti DNA.
Neuropeptid Y (NPY)
NPY je jedním z nejrozšířenějších peptidů v mozku a podílí se na regulaci reakcí na stres, úzkosti a příjmu potravy. Je považován za endogenní anxiolytickou látku.
- Genetické asociace: Polymorfismy v genu NPY mohou vést k rozdílům v expresi a sekreci NPY, což může mít vliv na odolnost jedince vůči stresu. Vyšší hladiny NPY obecně chrání před účinky stresu.
- Důsledky Genetické testování variant genu NPY může potenciálně ukázat základní odolnost jedince vůči stresu a může předpovědět jeho psychologickou reakci na chronický stres a trauma.(33)
Úloha epigenetiky při modulaci odolnosti vůči stresu
V oblasti epigenetiky se zabývá vrstvou složitosti, která přesahuje statickou sekvenci DNA. Epigenetické modifikace spočívají v chemických změnách struktury DNA, jako je metylace a modifikace histonů, které mohou ovlivnit způsob exprese genů, aniž by se změnil základní genetický kód. Tyto změny jsou dynamické a reagují na podněty z prostředí, včetně chronického stresu. Vystavení dlouhodobému stresu může vést k epigenetickým změnám, které ovlivňují fungování genů zapojených do reakce na stres, což může jedinci ztížit účinné zvládání nových stresorů.(34-35)
Společnosti, které stojí v čele personalizované medicíny, se nyní pouštějí do epigenetiky a snaží se odhalit, jak tyto změny mohou přispět ke schopnosti jedince odolávat stresu a zotavit se z něj. Analýzou epigenetických markerů mohou vědci získat přehled o aktuálním stavu genových expresních profilů, které jsou výsledkem jak genetických predispozic, tak vlivů prostředí. Takové testy mohou identifikovat epigenetické změny v reakci na chronický stres a poskytnout tak přehled o molekulárních mechanismech, které přispívají k reakci jedince na stres nebo k jejímu nedostatku.
Porozumění těmto epigenetickým změnám navíc otevírá dveře k personalizovaným intervencím. Ke zvrácení nepříznivých epigenetických modifikací lze doporučit specifické změny životního stylu, úpravy stravy a terapeutické strategie. Tento personalizovaný přístup nejen zvyšuje odolnost jednotlivce, ale také přispívá k širšímu pochopení toho, jak stres ovlivňuje naše biologické systémy na epigenetické úrovni, což by mohlo vést k novým léčebným postupům a preventivním strategiím poruch souvisejících se stresem. Zmapováním epigenetického prostředí reakce na stres můžeme začít vytvářet komplexnější obraz faktorů, které přispívají k naší jedinečné schopnosti zvládat životní výzvy.
Přínosy a omezení testů DNA odolnosti
Tyto testy mohou jednotlivcům nabídnout lepší pochopení jejich vrozené odolnosti a reakce na stres. Tyto poznatky by mohly sloužit jako podklad pro personalizované strategie zvládání stresu a zlepšování duševního zdraví. Je však nezbytné přistupovat k těmto testům s opatrností:
- Komplexní rys: Odolnost není dána jediným genem, ale jedná se o komplexní vlastnost ovlivněnou mnoha geny a faktory prostředí.
- Vliv prostředí: Genetika nepůsobí izolovaně. Významný vliv na odolnost mají životní zkušenosti, podpůrné systémy a volba životního stylu.
- Prediktivní síla: Přestože tyto testy mohou poskytnout poznatky, nejsou definitivním prediktorem schopnosti jedince zvládat životní výzvy.
Závěr:
Testy DNA týkající se odolnosti představují zajímavou hranici v pochopení toho, jak může naše genetická výbava ovlivňovat schopnost zvládat stres a zotavit se z nepříznivých situací. Přestože mohou poskytnout cenné poznatky, měly by být vnímány jako jeden z dílků obrovské skládačky, která tvoří odolnost jedince. Každému, kdo se o tyto testy zajímá, doporučujeme poradit se s poskytovatelem zdravotní péče nebo genetickým poradcem, aby výsledky interpretoval v širším kontextu jeho zdraví a životního stylu.
- Integrální test DNA si můžete nechat udělat zde!
- Objednejte si konzultaci k interpretaci laboratorních a genových testů u Dr. Sovijärviho zde.
Vědecké reference:
- Bobrow, M., & Grimbaldeston, A. H. (2000). Lékařská genetika, projekt lidského genomu a veřejné zdraví: Předneseno na Liverpoolské univerzitě 9. prosince 1996 a přijato k publikaci 17. února 2000. Journal of Epidemiology & Community Health, 54(9), 645-649.
- Cicchetti, D. (2010). Resilience under conditions of extreme stress: a multilevel perspective (Odolnost v podmínkách extrémního stresu: víceúrovňová perspektiva). Světová psychiatrie, 9(3), 145.
- Luecken, L. J., & Gallo, L. C. (Eds.). (2008). Handbook of physiological research methods in health psychology [Příručka fyziologických výzkumných metod v psychologii zdraví]. Sage.
- Southwick, S. M., Vythilingam, M., & Charney, D. S. (2005). The psychobiology of depression and resilience to stress: implications for prevention and treatment (Psychobiologie deprese a odolnost vůči stresu: důsledky pro prevenci a léčbu). Annu. Rev. Clin. Psychol., 1, 255-291.
- Michaud, M., Balardy, L., Moulis, G., Gaudin, C., Peyrot, C., Vellas, B., ... & Nourhashemi, F. (2013). Proinflammatory cytokines, aging, and age-related diseases (Prozánětlivé cytokiny, stárnutí a nemoci související s věkem). Journal of the American Medical Directors Association, 14(12), 877-882.
- Aguilera, G., Nikodemova, M., Wynn, P. C., & Catt, K. J. (2004). Receptory pro hormon uvolňující kortikotropin: o dvě desetiletí později. Peptides, 25(3), 319-329.
- Subbannayya, T., Balakrishnan, L., Sudarshan, G., Advani, J., Kumar, S., Mahmood, R., ... & Prasad, T. K. (2013). Integrovaná mapa signální dráhy kortikotropin uvolňujícího hormonu. Journal of cell communication and signaling, 7, 295-300.
- Binder, E. B. (2009). Úloha FKBP5, ko-chaperonu glukokortikoidního receptoru v patogenezi a terapii afektivních a úzkostných poruch. Psychoneuroendocrinology, 34, S186-S195.
- Ising, M., Depping, A. M., Siebertz, A., Lucae, S., Unschuld, P. G., Kloiber, S., ... & Holsboer, F. (2008). Polymorfismy v oblasti genu FKBP5 modulují zotavení z psychosociálního stresu u zdravých kontrol. European Journal of Neuroscience, 28(2), 389-398.
- Vitellius, G., Trabado, S., Bouligand, J., Delemer, B., & Lombès, M. (2018, červen). Patofyziologie glukokortikoidní signalizace. In Annales d'endocrinologie (Vol. 79, No. 3, pp. 98-106). Elsevier Masson.
- Van West, D., Van Den Eede, F., Del-Favero, J., Souery, D., Norrback, K. F., Van Duijn, C., ... & Claes, S. (2006). Analýza genů SNP pro glukokortikoidní receptory u pacientů s rekurentní velkou depresí. Neuropsychopharmacology, 31(3), 620-627.
- Schneider, K. K., Frings, C., Meyer, J., & Schote, A. B. (2016). Úloha genu pro glukokortikoidní receptor (NR3C1) pro zpracování averzivních podnětů. Neuroscience Research, 107, 8-13.
- Azadmarzabadi, E., Haghighatfard, A., & Mohammadi, A. (2018). Nízká odolnost vůči stresu je spojena se změnami exprese kandidátních genů v dopaminergní signální dráze. Psychogeriatrics, 18(3), 190-201.
- Heinz, A., & Smolka, M. N. (2006). Vliv genotypu katechol O-methyltransferázy na aktivaci mozku vyvolanou afektivními podněty a kognitivními úkoly. Reviews in the Neurosciences, 17(3), 359-368.
- Mier, D., Kirsch, P., & Meyer-Lindenberg, A. (2010). Neurální substráty pleiotropního působení genetické variability v COMT: metaanalýza. Molecular psychiatry, 15(9), 918-927.
- Mustapic, M., Maihofer, A. X., Mahata, M., Chen, Y., Baker, D. G., O'Connor, D. T., & Nievergelt, C. M. (2014). Biosyntetický enzym katecholamin dopamin β-hydroxyláza (DBH): první pozice pro hledání variant určujících znaky v celém genomu působící aditivně v proximálním promotoru. Human molecular genetics, 23(23), 6375-6384.
- Vincent, S., & Robertson, D. (2002). Širší pohled: katecholaminové abnormality. Clinical Autonomic Research, 12, I44-I49.
- Hoenicka, J., Aragüés, M., Ponce, G., Rodríguez-Jiménez, R., Jiménez-Arriero, M. A., & Palomo, T. (2007). Od dopaminergních genů k psychiatrickým poruchám. Neurotoxicity research, 11, 61-71.
- Hill, S. Y., Hoffman, E. K., Zezza, N., Thalamuthu, A., Weeks, D. E., Matthews, A. G., & Mukhopadhyay, I. (2008). Dopaminergní mutace: V rámci rodiny asociace a vazba v rodinách s mnohočetnou závislostí na alkoholu. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 147(4), 517-526.
- He, Y., Martin, N., Zhu, G., & Liu, Y. (2018). Kandidátské geny pro vyhledávání novinek: metaanalýza asociačních studií: DRD4: exon III a: COMT: Val158Met. Psychiatric genetics, 28(6), 97-109.
- Avula, R., Rand, A., Black, J. L., & O'kane, D. J. (2011). Současné genotypování více polymorfismů v genu pro lidský serotoninový transportér a detekce nových alelických variant. Translational psychiatry, 1(8), e32-e32.
- Tivol, E. A., Shalish, C., Schuback, D. E., Hsu, Y. P., & Breakefield, X. O. (1996). Mutační analýza lidského genu MAOA. American journal of medical genetics, 67(1), 92-97.
- Waider, J., Araragi, N., Gutknecht, L., & Lesch, K. P. (2011). Tryptofanhydroxyláza-2 (TPH2) v poruchách kognitivní kontroly a regulace emocí: perspektiva. Psychoneuroendokrinologie, 36(3), 393-405.
- Bauer, M. E., & Teixeira, A. L. (2021). Neurozánět u poruch nálady: role regulačních imunitních buněk. Neuroimmunomodulation, 28(3), 99-107.
- Anderson, G., Kubera, M., Duda, W., Lasoń, W., Berk, M., & Maes, M. (2013). Zvýšená trans-signalizace IL-6 u deprese: zaměření na dráhu katabolitu tryptofanu, melatoninu a neuroprogrese. Pharmacological Reports, 65(6), 1647-1654.
- Perry, B. I., Upthegrove, R., Kappelmann, N., Jones, P. B., Burgess, S., & Khandaker, G. M. (2021). Asociace imunologických proteinů/znaků se schizofrenií, velkou depresí a bipolární poruchou: obousměrná dvouvýběrová mendelovská randomizační studie. Brain, behavior, and immunity (Mozek, chování a imunita), 97, 176-185.
- Bradley, J. (2008). Zánětlivé onemocnění zprostředkované TNF. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 214(2), 149-160.
- Loth, E., Poline, J. B., Thyreau, B., Jia, T., Tao, C., Lourdusamy, A., ... & IMAGEN Consortium. (2014). Genotyp oxytocinového receptoru moduluje ventrální striatální aktivitu na sociální narážky a reakci na stresové životní události. Biological psychiatry, 76(5), 367-376.
- Myers, A. J., Williams, L., Gatt, J. M., McAuley-Clark, E. Z., Dobson-Stone, C., Schofield, P. R., & Nemeroff, C. B. (2014). Variace v genu pro oxytocinový receptor je spojena se zvýšeným rizikem úzkosti, stresu a deprese u jedinců s anamnézou vystavení stresu v raném věku. Journal of psychiatric research, 59, 93-100.
- Cowansage, K. K., LeDoux, J. E., & Monfils, M. H. (2010). Brain-derived neurotrophic factor: a dynamic gatekeeper of neural plasticity (Neurotrofický faktor odvozený z mozku: dynamický strážce nervové plasticity). Current molecular pharmacology, 3(1), 12-29.
- Chen, Z. Y., Jing, D., Bath, K. G., Ieraci, A., Khan, T., Siao, C. J., ... & Lee, F. S. (2006). Genetická varianta polymorfismu BDNF (Val66Met) mění chování související s úzkostí. science, 314(5796), 140-143.
- Phillips, C. (2017). Brain-derived neurotrophic factor, deprese a fyzická aktivita: navázání neuroplastického spojení. Neural plasticity, 2017.
- Schmeltzer, S. N., Herman, J. P., & Sah, R. (2016). Neuropeptid Y (NPY) a posttraumatická stresová porucha (PTSD): translační aktualizace. Experimental neurology, 284, 196-210.
- Lux, V. (2016, březen). Epigenetické programování v psychobiologickém vývoji: Důkazy pro teorii dvojí aktivace a zprostředkující roli stresu v raném životě. In Sborník z výroční vědecké konference Qatar Foundation Volume 2016 Issue 1 (Vol. 2016, No. 1, p. HBOP3415). Hamad bin Khalifa University Press (HBKU Press).
- Chukwuma Sr, C. (2022). Epigenetika a její podstata v pochopení lidského růstu, vývoje a nemoci. J Med Res, 8(5), 165-172.