Vše, co potřebujete vědět o stárnutí a procesech proti stárnutí. Jak zvrátit stárnutí? Jakých je 9 charakteristických znaků stárnutí? Přečtěte si více a dozvíte se to!
V roce 2013 publikoval Carlos López-Otín se svými kolegy průlomovou práci, ve které se pokusili identifikovat a kategorizovat buněčné a molekulární znaky stárnutí.. Navrhli devět kandidátních charakteristických znaků, o nichž se obecně soudí, že přispívají k procesu stárnutí a společně určují fenotyp stárnutí. López-Otín a kol. definovali, že by daný znak měl v ideálním případě splňovat následující tři kritéria: měl by se projevit během normálního stárnutí, jeho experimentální zhoršení by mělo urychlit stárnutí a jeho experimentální zlepšení by mělo zpomalit normální proces stárnutí, a tedy prodloužit délku zdravého života.
Původních devět znaků stárnutí
Klíč ke zpomalení nebo dokonce zvrácení stárnutí není založen na myšlence pouhého prodloužení délky života, ale Zdravotní rozpětí (doba života strávená v dobrém zdraví, bez chronických onemocnění a postižení způsobených stárnutím). Dosud nedošlo k tak velkému stlačení nemocnosti, protože jsme více snížili úmrtnost než zabránili nemocnosti. Zdravotní rozpětí (mít zdravá léta života) se zvýší, když se sníží morbidita (stav, kdy člověk trpí nějakou nemocí nebo zdravotním stavem), a to nejúčinněji zvýšením věku nástupu nemoci.
Úspěšné a zdravé stárnutí lze definovat takto:
- Nízká pravděpodobnost onemocnění nebo postižení
- Vysoká schopnost kognitivních a fyzických funkcí
- Aktivní zapojení do života
Navrhovaných devět charakteristických znaků stárnutí je rozděleno do tří kategorií:
- 1. Primární znaky (příčiny poškození)
- Iniciační spouštěče, jejichž škodlivé následky se s časem postupně kumulují. Všechny jednoznačně negativní.
- 2. Antagonistické znaky (reakce na poškození)
- Protichůdné účinky k primárním znakům. Při nízkých hladinách zprostředkovávají příznivé účinky, ale při vysokých hladinách se stávají škodlivými (např. senescence).
- 3. Integrační znaky (Viníci fenotypu)
- Konečný výsledek předchozích dvou skupin charakteristických znaků a nahromaděné poškození, které nelze kompenzovat tkáňovými homeostatickými mechanismy. Ty jsou v konečném důsledku zodpovědné za funkční pokles spojený se stárnutím.
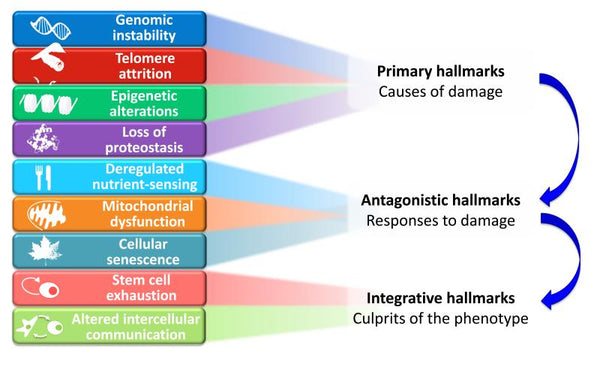
Obrázek: Funkční propojení mezi charakteristickými znaky stárnutí.
Zdroj:: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Charakteristické znaky stárnutí. Cell . 153 (6): 1194–1217.
1. Genomová nestabilita
Integrita a stabilita DNA jsou neustále ohrožovány vnějšími fyzikálními, chemickými a biologickými činiteli i vnitřními hrozbami, mezi něž patří chyby při replikaci DNA, spontánní hydrolytické reakce a produkce reaktivních forem kyslíku. Ty nakonec vedou k k hromadění genetických poškození po celý život.
Způsoby, jak zlepšit genomickou stabilitu (znak č. 1):
- Antioxidační mikroživiny (selen, zinek, vitamín C, vitamín E). omezují poškození DNA
- Odstraňuje i mírný nedostatek kyseliny listové, vitaminu B12, niacinu a zinku -> významně ovlivňují míru spontánního poškození chromozomů
- Ganoderma lucidum (reishi) glukany
- Polyfenoly -> odstraňují volné radikály
- Mírné a "autoregulované" cvičení
- Vyhýbejte se následujícím činnostem:
- vystavení záření a chemickým látkám
- expozici těžkým kovům
- Nikl, kadmium a arsen, zejména
- Kouření cigaret
- příliš dlouhé sezení
- Nadměrné užívání alkoholu, energetických nápojů a mléka
2. Úbytek telomer
Telomery jsou obzvláště náchylné k poškození v souvislosti s věkem. Během normálního stárnutí dochází ke zkracování telomer. jak u lidí, tak u myší. Telomery jsou vázány na multiproteinový komplex, který se nazývá shelterin, který brání přístupu opravných proteinů DNA k telomerám (bez něj by se telomery "opravovaly" jako zlomy DNA vedoucí k fúzi chromozomů). Poškození DNA na telomerách je pozoruhodně stálé a vysoce účinné při vyvolávání senescence.
Způsoby, jak snížit zkracování telomer (Znak č. 2):
- Zvyšte příjem antioxidantů ve stravě
- Vysoký příjem omega-3 mastných kyselin, zejména
- Optimalizujte vitaminu D, vitaminu B12 a folát v krvi
- Středomořská strava
- Vyhýbejte se následujícím potravinám:
- Kouření
- Obezita
- Vystavení toxinům a znečištění
- Vyrovnání hladiny stresu
- Vyvážení cvičebního režimu a intenzivního cvičení
- Meditace láskyplné laskavosti & meditace všímavosti praxe (a meditace obecně)
- Hyperbarická oxygenoterapie (HBOT)
- Gynostemma, gotu kola a astragalus (pravděpodobně účinné)
- Co nefunguje: dlouhodobé omezování kalorií
3. Epigenetické změny
Mnoho druhů epigenetických změn ovlivňuje všechny buňky a tkáně po celý život. (způsobené například stravou, chemickými látkami, léky, slunečním zářením, teplem/chladem, cvičením atd.). Epigenetické změny předpokládají změny v oblasti DNA, posttranslační modifikace histonů a remodelace chromatinu.Členové rodiny sirtuinů, NAD-dependentních proteinových deacetyláz a ADP ribozyltransferáz. jsou intenzivně studovány jako potenciální faktory proti stárnutí - u lidí přispívají ke zdravému stárnutí nejméně tři členové rodiny sirtuinů, SIRT1, SIRT3 a SIRT6.
Způsoby jak řídit epigenetické změny (Hallmark #3):
- Optimalizujte metylační cesty (folát, B12, B6, TMG).
- Aktivátory sirtuinových drah (SIRT1, SIRT3, SIRT6):
- Spermidin (inhibuje histonové deacetylázy)
- Přerušované omezování kalorií a přerušované hladovění
- Pravidelné (intenzivní) cvičení
- Optimalizace spánku (ztráta spánku způsobuje škodlivé epigenetické změny)
- Metformin (vedlejší účinky jsou varováním); nejlépe (dihydro)berberin
- Alfa-ketoglutarát (CaAKG)
- Získávejte pravidelně hormetické dávky tepla, chladu, slunečního světla atd. ("jed je v dávce").
- Epigenetické léky ve vývoji které se zaměřují na DNA metyltransferázu, histon deacetylázu, histon metyltransferázu a chromatin.
Doporučené doplňky:
Purovitalis Liposomální kvercetin
Purovitalis Liposomální resveratrol
4. Ztráta proteostázy
Proteostáza zahrnuje mechanismy stabilizace správně složených proteinů (zejména rodiny heat-shock proteinů) a mechanismy stabilizace správně složených proteinů (zejména rodiny heat-shock proteinů) a mechanismy pro degradaci proteinů proteazomem nebo lyzozomem.. Četné studie prokázaly, že se proteostáza se stárnutím mění což vede k chronické expresi nesložených, nesprávně složených nebo agregovaných proteinů. Ty přispívají k rozvoji některých degenerativních onemocnění souvisejících s věkem, jako je Alzheimerova choroba.
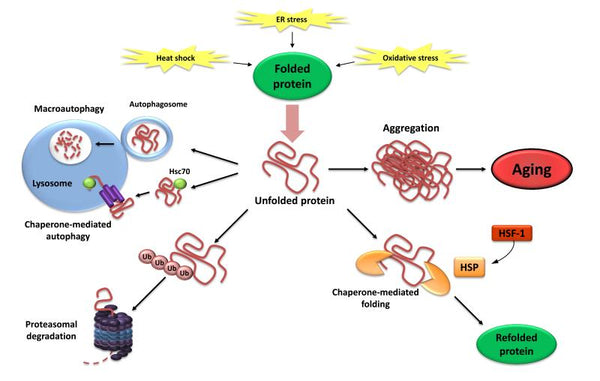
Obrázek: Ztráta proteostázy. Neschopnost přeložit nebo odbourat nesložené proteiny může vést k jejich hromadění a agregaci, což má za následek proteotoxické účinky.
Zdroj:: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Charakteristické znaky stárnutí. Cell . 153 (6): 1194–1217.
Způsoby, jak zlepšit stabilitu proteostázy (Hallmark #4):
Obecně lze říci, že nejlepším způsobem, jak chránit tělo před ztrátou proteostázy, je aktivací autofagie.
- Půst, přerušované omezování kalorií (dlouhodobé není vhodné!), ketóza, cvičení (nejlépe nalačno), odporový trénink., studené & vystavení teplu, hluboký spánek (a melatonin)
- Sulforafan, káva, kurkumin, polyfenoly, EVOO, resveratrol, zelený čaj, spermidin.
- Senolytické živiny a doplňky stravy:
- Kvercetin, fisetin, luteolin, kurkumin, piperlongumin, molekulární vodík (H2) atd.
- Aktivátory AMPK:
- Berberin (DHB ještě lépe), resveratrol (a pterostilben), hesperidin, ginsenosidy, kvercetin, kurkumin, naringenin, gynostemma, krocin (v šafránu), kyselina salvianolová B, kyselina alfa-lipoová atd.
- Metformin a rapamycin (Nb. posmožné nežádoucí účinky)
- Induktory Hsp70 (heat-shock protein 70):
- Saunování a vystavení teplu
- Šikonin (z kořenů rostliny šikonin)
- Specifické senolytické léky (např. Dasatinib a Navitoclax)
5. Deregulované vnímání živin
Signalizace IGF-1 a inzulínu je tzv. IIS dráha, která je v evoluci nejkonzervativnější dráhou řídící stárnutí. Kromě dráhy IIS, která se podílí na snímání glukózy, existují ještě další dráhy tři další příbuzné a vzájemně propojené systémy vnímání živin: mTOR (snímání vysokých koncentrací aminokyselin), AMPK (snímání nízkoenergetických stavů detekcí vysokých hladin AMP) a sirtuiny (snímání nízkoenergetických stavů detekcí vysokých hladin NAD+). Souhrnně lze říci, že existují silné důkazy o tom, že anabolická signalizace (mTOR, vysoká hladina inzulínu) urychluje stárnutí a snížená nutriční signalizace (AMPK, nízká hladina inzulínu) prodlužuje dlouhověkost.
Způsoby, jak zvládnout deregulované vnímání živin (znak č. 5):
Prakticky všechny předchozí způsoby zvládání charakteristických znaků 1-4 jsou zahrnuty v senzibilizaci a opětovné regulaci vnímání živin. Patří mezi ně např:
- omezení stravy
- aktivace AMPK
- aktivace sirtuinu
- hormeze
- snížení oxidačního stresu a zánětu
- zvýšení autofagie
6. Mitochondriální dysfunkce
Bylo zjištěno, že mitochondriální dysfunkce zvyšuje proces stárnutí. Když organismus stárne, snižuje se účinnost dýchacího řetězce buněk, což vede k úniku elektronů a snížené tvorbě ATP.. Na stránkách Snížená účinnost mitochondriální bioenergetiky se stárnutím může být důsledkem více vzájemně se prolínajících mechanismů, včetně snížené biogeneze mitochondrií, akumulace mutací a delecí v mtDNA, oxidačního stresu v mitochondriálních proteinech, destabilizace dýchacího řetězce, změn v lipidovém složení mitochondriálních membrán a změn v dynamice mitochondrií.
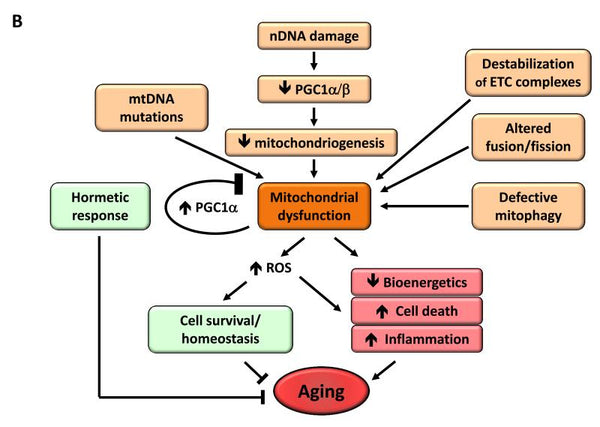
Obrázek: Mitochondriální dysfunkce a její vliv na stárnutí.
Zdroj:: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Charakteristické znaky stárnutí. Cell . 153 (6): 1194–1217.
Způsoby zvládání mitochondriální dysfunkce. (Poznávací znamení č. 6):
- Aktivace mitohormózy pomocí:
- Přerušované omezování kalorií
- přerušovaným půstem
- Cvičení
- Vystavení chladu
- Fytonutrienty (např. flavonoidy)
- Zaměřují se na dráhu Nrf2 (homeostáza a strukturální integrita) pomocí:
- vystavení teplu a chladu
- Fyzické cvičení
- Přerušovaný půst a ketóza
- Sulforafan, polyfenoly, kvercetin, kurkumin atd.
- Molekulární vodík (H2) -> Doporučení k výrobku
- Zlepšení biogeneze a opravy mitochondrií (aktivace PGC-1α):
- Fyzické cvičení
- Ketóza a ketolátky
- Acetyl-L-karnitin
- Polyfenoly, kvercetin
- Rhodiola rosea (salidrosidy)
- Koenzym Q10, pyrrochinolinový chinon (PQQ), nikotinamidový mononukleotid (NMN), kyselina alfa-lipoová (ALA)
7. Buněčná senescence
Vzhledem k tomu, že se stárnutím se zvyšuje počet senescentních buněk, předpokládá se, že senescence přispívá ke stárnutí. Senescence je však nutná k tomu, aby se zabránilo distribuci a proliferaci poškozených buněk vyvolávajících reakci imunitního systému. Tento buněčný kontrolní bod vyžaduje účinný systém buněčné substituce, který zahrnuje jak odstranění senescentních buněk, tak mobilizaci progenitorových buněk k obnovení optimálního počtu buněk. Senescentní buňky vyjadřují podstatné změny ve svém sekretu, který je obohacen zejména o prozánětlivé cytokiny a matrixové metaloproteinázy. Proto se označuje jako "sekreční fenotyp spojený se senescencí".
Způsoby boje proti buněčné senescenci (znak č. 7):
Senescentní buňky se nakonec přestanou množit, ale neodumřou, kdy by měly, jako to dělají běžné buňky. Místo toho zůstávají a nadále uvolňují chemické látky, které mohou vyvolat zánět a imunitní reakci.
Senolytické sloučeniny které selektivně cílí na senescentní buňky zahrnují:
- Fisetin (nazývaný také "nejlepší senolytikum")
- Kvercetin
- Theaflaviny
- Apigenin
- Tocotrienoly (forma vitaminu E)
- Piperlongumine
- Molekulární vodík (H2)
8. Vyčerpání kmenových buněk
Dospělé kmenové buňky jsou schopny sebeobnovy a diferenciace na více typů buněk v rámci tkáně. Ačkoli se fenotypy a mechanismy značně liší, funkce všech populací kmenových buněk s věkem klesá. Vyčerpání kmenových buněk je jednotícím důsledkem různých poškození souvisejících se stárnutím a pravděpodobně představuje jednoho z konečných viníků buněčného stárnutí.. Studie na stárnoucích myších odhalily celkové snížení aktivity buněčného cyklu hematopoetických kmenových buněk (HSC), což koreluje s akumulací poškození DNA a poškozením buněk. nadměrnou expresí proteinů inhibujících buněčný cyklus. (např. p16INK4a). Zkracování telomer bylo rovněž shledáno jako důležitá příčina úbytku kmenových buněk při stárnutí.
Způsoby, jak působit proti vyčerpání kmenových buněk (Poznávací znamení č. 8):
- Terapie kmenovými buňkami (autologní vs. alogenní a různé typy buněk)
- Terapie kmenovými buňkami je stále "divokým západem" - existují potenciální vedlejší účinky a rizika, jako je růst nádorů a rakoviny.
- Fotobiomodulace ("terapie červeným světlem")
- PBM stimuluje různé typy kmenových buněk ke zvýšení jejich migrace, proliferace a diferenciace in vitro i in vivo.
- Obnovuje stárnoucí kmenové buňky tím, že se zaměřuje na toxické metabolity:
- Aktivace sirtuinů - SIRT1 a SIRT 3 (viz č. 3 a 4).
- N-acetyl cystein (NAC)
- Zlepšuje stabilitu proteostázy (viz #4)
- Zlepšení funkce mitochondrií (viz #6)
- Použijte senolytika (viz #7)
- Obnovte epigenetickou paměť (viz č. 3)
- Optimalizujte hladinu vitaminu D
- Spirulina (studie in vitro)
9. Změněná mezibuněčná komunikace
Buněčné stárnutí probíhá také na úrovni mezibuněčné komunikace. Patří sem neurohormonální signalizace (zvýšené zánětlivé reakce), imunosurveillance (patogeny a premaligní buňky) a změny extracelulárního prostředí. Stárnutí v důsledku zánětu se nazývá inflammaging. Může být důsledkem více příčin, například hromadění prozánětlivého poškození tkání, selhání dysfunkčního imunitního systému účinně odstraňovat patogeny a dysfunkční hostitelské buňky a výskyt nedostatečné autofagické reakce. Změny stárnutí v jedné tkáni mohou vést ke stárnutí specifickému zhoršování stavu sousední tkáně: senescentní buňky indukují senescenci ve svých sousedních buňkách prostřednictvím kontaktů mezi buňkami zprostředkovaných mezerami mezi spoji a procesy zahrnujícími reaktivní formy kyslíku. Tento jev se také nazývá efekt senescentních buněk jako vedlejších účastníků.
Způsoby zlepšení imezibuněčné komunikace (charakteristický znak č. 9):
- Snížení celkového zánětu v těle
- Celkový protizánětlivý přístup k životnímu stylu
- Použití molekulárního vodíku (H2)
- Vícenásobné účinky proti stárnutí v těle (včetně omezení zánětů)
- Snížení oxidačního stresu v těle a snížení reaktivních forem kyslíku (ROS)
- Zvýšení autofagie v těle (viz dříve)
- Léčba střevní dysbiózy a zlepšení rozmanitosti a celkového zdraví střevní mikroflóry
- Léčba možného syndromu děravého střeva
10. Tuhost extracelulární matrix (ECM)
Kromě těchto devíti znaků stárnutí definovaných v roce 2013 se objevuje ještě desátý znak. Dva vědci, Alexander Fedintsev a Alexej Moskalev, publikovali v roce 2021 článek, který se blíže zabývá tuhnutím extracelulární matrix (ECM): vytvářením příčných vazeb mezi dlouho žijícími molekulami, jako je kolagen a elastin. Naznačují, že tuhnutí ECM je způsobeno neenzymatickými chemickými reakcemi glykace, karbamylace a karbonylace a že by dokonce mohlo být prvotní příčinou několika uznávaných znaků stárnutí, jako je buněčná senescence.. Tyto změny vedou k tvorbě aduktů a příčných vazeb, které následně způsobují zánět, fibrózu, poruchy tkáňových cirkadiánních hodin, stárnutí kmenových buněk atd. Již dříve bylo zjištěno, že konečné produkty pokročilé glykace (AGEs) mají patogenní význam pro různé tkáně a dráhy v těle. Organismy s mimořádně dlouhou dobou života (např. velryby grónské) mají výjimečně nízkou míru akumulace AGEs.
Potenciální terapeutika pro tuhost extracelulární matrix (ECM) (Hallmark #10):
U lidských kosterních svalů je funkční porucha související s věkem způsobena zvýšenou tuhostí ECM, která je způsobena především hromaděním kolagenu.
- Manuální terapie a mechanický tlak
- Osteopatická terapie, akupunktura, myofasciální uvolňování
- Kombinace syntetických a přírodních inhibitorů AGE působí synergicky v různých fázích tvorby
- Mezi přírodní produkty patří karnosin, kyselina alfa-lipoová, taurin, vitamin C, benfotiamin a pyridoxamin -> doporučení produktů
- Polyfenoly, terpenoidy a polysacharidy
- Snižte také příjem konečných produktů pokročilé glykace z potravin.
- Stimulace elastogeneze (nové léky?)
- Antagonisté RAGE (receptor pro konečné produkty pokročilé glykace) [různé peptidy].
///








