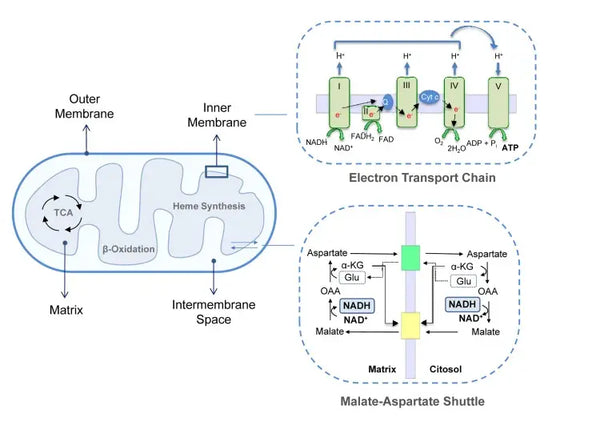
Mitochondriën zijn vitale organellen die zich in het cytoplasma van eukaryote cellen bevinden. Met goed functionerende mitochondriën werkt elk proces in het lichaam, van beweging en lichaamsbeweging tot spijsvertering en herstel, beter. Ze spelen een essentiële rol bij energieproductie en vele andere cellulaire processen. Mitochondriën bieden de locatie voor oxidatieve fosforylering, die ATP produceert, de primaire energiebron van de cel. Structureel kunnen mitochondriën worden geëvalueerd aan de hand van een buitenmembraan en een sterk gevouwen binnenmembraan die compartimenten vormt die noodzakelijk zijn voor hun metabolisme. Naast energieproductie voeren mitochondriën andere activiteiten uit, zoals calciumsignalisatie en regulatie van de cellulaire stofwisseling, naast apoptose (geprogrammeerde celdood), wat hen essentieel maakt voor het behoud van de cellulaire homeostase.
De basisprincipes van mitochondriale functie
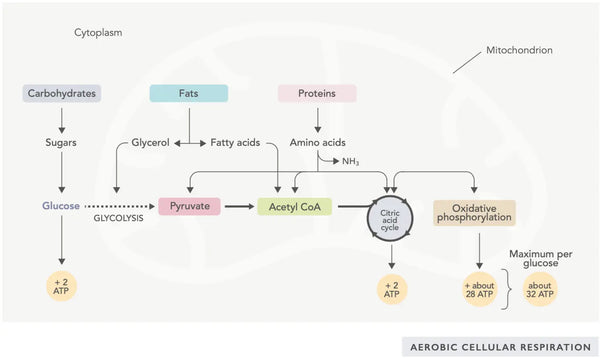
ATP-generatie (de primaire energiemolecuul die door cellen wordt gebruikt) is de fundamentele eigenschap van mitochondriale activiteit. Dit proces vindt plaats via twee belangrijke biochemische paden: de citroenzuurcyclus (TCA-cyclus of Krebs-cyclus) en de elektronentransportketen (ETC).
Citroenzuurcyclus
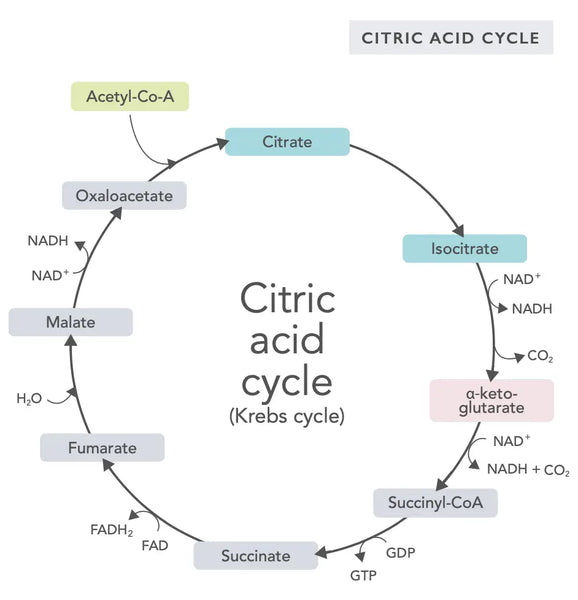
De citroenzuurcyclus, of Krebs-cyclus (genoemd naar de Nobelprijswinnaar Hans Adolf Krebs, die deze ontdekte), vindt plaats in de mitochondriën van de cel.(1)De primaire metabolische verbinding van de citroenzuurcyclus is azijnzuur (acetylen co-enzym A) geproduceerd uit vetzuren, koolhydraten en eiwitten.(2)
De verschillende reacties van de citroenzuurcyclus (zie afbeelding) vormen waterstofionen en elektronen die vervolgens worden overgedragen aan het binnenste mitochondriale membraan voor oxidatieve fosforylering (binding van energie aan ATP-moleculen door oxidatie) en de elektronentransportketen. De reactie geeft NADH en kleine hoeveelheden ATP en kooldioxide vrij.
De citroenzuurcyclus omvat tien stappen, die allemaal worden beïnvloed door B-vitamines, bepaalde mineralen zoals magnesium en ijzer, en de belangrijkste antioxidant van de lever, glutathion. De reacties worden geremd door zware metalen zoals kwik, arseen en aluminium.
De energierijke NADH-moleculen vangen de meeste energie die tijdens de citroenzuurcyclus wordt gegenereerd. Voor elk acetylen co-enzym A-molecuul worden drie NADH-moleculen gegenereerd en vervolgens gebruikt voor energie in de volgende reactie (oxidatieve fosforylering).
De regulatie van de citroenzuurcyclus wordt bepaald door de beschikbaarheid van verschillende aminozuren en feedbackremming (bijvoorbeeld, als er te veel NADH wordt geproduceerd, worden verschillende enzymen van de citroenzuurcyclus geremd, wat de reacties vertraagt).
Oxaloacetaat is een verbinding die een plotselinge behoefte aan energieproductie vervult (bijvoorbeeld in de hersenen of spieren). Het innemen van een oxaloacetaat-supplement kan nuttig zijn, en het kan zelfs de regeneratie van mitochondriën in de hersenen stimuleren, stille ontsteking in het lichaam verminderen en het aantal zenuwcellen verhogen.(3)
Eenvoudig gezegd, het lichaam omvat ingenieuze systemen die geconsumeerd voedsel omzetten in elektronen, die als energie voor verschillende behoeften worden gebruikt.
Oxidatieve fosforylering
Oxidatieve fosforylering bestaat uit de elektronentransportketen en ATP-synthase. Oxidatieve fosforylering produceert de meeste energie die wordt gegenereerd onder aerobe omstandigheden (ATP). Het is een voortzetting van de citroenzuurcyclus.
In de elektronentransportketen worden waterstofionen (H+) vrijgegeven in de mitochondriale intermembranaire ruimte. De waterstofionen die uit de intermembranaire ruimte zijn vrijgegeven, bewegen terug de mitochondriën in via ATP-synthase. Met de energie die in het proces vrijkomt, zet ATP-synthase de ADP die voor energie is gebruikt weer om in ATP.
Ubiquinon (co-enzym Q10) draagt bij aan de elektronentransportketen. Het wordt al tientallen jaren gebruikt als voedingssupplement. Lage niveaus van ubiquinon in cellen kunnen een predisponerende factor zijn voor verschillende ziekten als gevolg van onvoldoende aerobe energieproductie in de cellen. Bovendien is het gebruik van cholesterolmedicatie (statines) een bijdragende factor voor ubiquinon-tekort.(4)
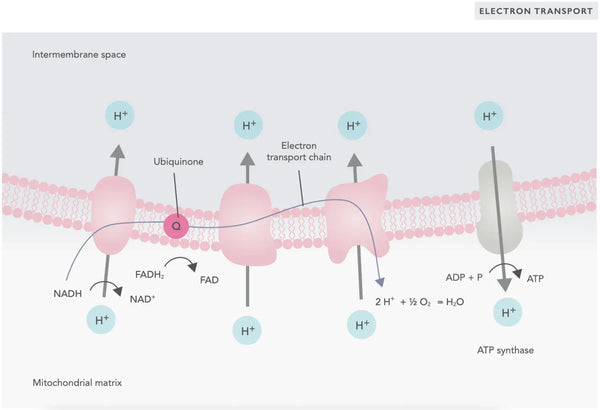
Deze gecoördineerde set van reacties genereert ATP en stelt een protonengradient vast over het binnenste mitochondriale membraan, een proces dat bekend staat als chemiosmose. De energie die in deze gradient is opgeslagen drijft de synthese van ATP aan, waardoor de stroom van elektronen door de ETC wordt gekoppeld aan de generatie van cellulaire energie.(5)
Factoren die de mitochondriale efficiëntie beïnvloeden
Mitochondriale efficiëntie, die uiteraard van vitaal belang is voor optimale cellulaire functie, wordt beïnvloed door verschillende factoren. Hieronder worden de belangrijkste beschreven.
Genetische samenstelling
Mitochondriën bezitten een aparte en individuele DNA (mitochondriaal DNA, mtDNA) dat verschilt van het nucleaire DNA. MtDNA codeert voor essentiële componenten van de elektronentransportketen en mitochondriale eiwitten. Mutaties in mtDNA kunnen leiden tot disfunctionele eiwitten, waardoor de elektronentransportketen en ATP-synthese worden verstoord. Deze kunnen resulteren in verminderde energieproductie en verhoogde generatie van reactieve zuurstofsoorten (ROS), wat bijdraagt aan mitochondriale en cellulaire disfunctie.(6)
Oxidatieve Stress
Mitochondriën zijn een belangrijke bron van ROS, die bijproducten zijn van zuurstofmetabolisme. Hoewel lage niveaus van ROS functioneren in cellulaire signalering, kunnen overmatige ROS oxidatieve schade aan mitochondriale eiwitten, lipiden en DNA veroorzaken. Deze oxidatieve stress compromitteert de integriteit en functie van mitochondriën, remt de ATP-productie en leidt tot verdere ROS-productie in een schadelijke cyclus. Antioxidante verdedigingsmechanismen, waaronder superoxide dismutase en glutathionperoxidase, spelen een cruciale rol bij het verminderen van deze schade.(7-8)
Beschikbaarheid van Voedingsstoffen
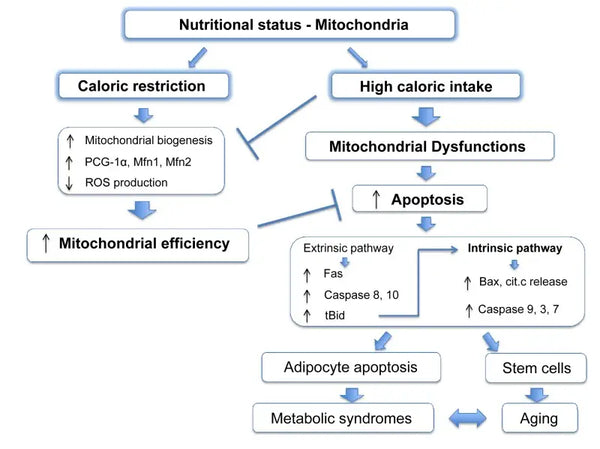
Mitochondriën hebben specifieke substraten nodig voor energieproductie. Glucose en vetzuren zijn primaire bronnen voor ATP-generatie via glycolyse en β-oxidatie, respectievelijk. De beschikbaarheid van deze substraten heeft directe invloed op de mitochondriale functie. Bijvoorbeeld, in omstandigheden van voedingsoverschot, zoals hoge glucosebeschikbaarheid, kunnen mitochondriën overmatige hoeveelheden ATP en ROS produceren, wat mogelijk leidt tot metabolische verstoringen.(9-10)
Omgekeerd kan voedingsschaarste de mitochondriale energieproductie beperken, wat invloed heeft op de cel functie en overleving. In tegenstelling tot sommige rapporten uit dierstudies over de voordelen van caloriebeperking op mitochondriale biogenese, lijkt het erop dat het de mitochondriale biogenese niet verhoogt. Het behoudt echter de mitochondriale functie door de integriteit en functie van bestaande cellulaire componenten te beschermen.(11-12)
Levensstijlfactoren
Lichaamsbeweging
Fysieke activiteit beïnvloedt de hoeveelheid en kwaliteit van mitochondriën. Lichaamsbeweging stimuleert mitochondriale biogenese, wat leidt tot een toename van de mitochondriale dichtheid en efficiëntie in energieproductie.(13) Vooral uithoudingsvermogentraining verbetert de oxidatieve capaciteit van mitochondriën, waardoor hun vermogen om zuurstof te gebruiken voor ATP-productie verbetert (lees later in het artikel meer in detail).
Dieet
Voedingscomponenten hebben een significante invloed op de mitochondriale functie. Verhoudingen van macronutriënten, calorie-inname en specifieke voedingsstoffen (zoals antioxidanten, vitamines en mineralen) beïnvloeden het mitochondriale metabolisme. Dieeten die rijk zijn aan voedingsstoffen die de mitochondriale functie ondersteunen, kunnen de energieproductie verbeteren en oxidatieve stress verminderen (zie later). Het activeren van ketose kan ook de mitochondriale biogenese verhogen en de mitochondriale efficiëntie verbeteren.(14-15)
Omgevingsfactoren
Blootstelling aan omgevingsstressoren, zoals toxines, verontreinigende stoffen, zware metalen (bijv. lood, kwik, arseen en cadmium) en straling, kan een nadelige invloed hebben op de mitochondriale functie. Deze stressoren kunnen oxidatieve schade veroorzaken, de activiteit van de elektronentransportketen verstoren en de mitochondriale dynamiek, inclusief fusie- en splitsingsprocessen, aantasten.(16)
Technologische interventies
Fotobiomodulatie (of rode lichttherapie)
Fotobiomodulatie is het gebruik van niet-ioniserende fotonenergie om fotochemische veranderingen binnen cellulaire structuren te triggeren die ontvankelijk zijn voor fotonen, met name in mitochondriën. Rode licht- en NIR-lichttherapie worden verondersteld voornamelijk te werken via foto-acceptoren. Rode lichtgolven dringen door de huid en bereiken de mitochondriën van de cel, waardoor de energieproductie van de cellen toeneemt. Verschillende gebeurtenissen leiden hiertoe, bijvoorbeeld de versnelling van de mitochondriale ademhaling via cytochroom c oxidase.(17) Lees hier over de gezondheidsvoordelen van fotobiomodulatie.
Infraroodsauna
Infraroodsauna's gebruiken infraroodstraling, die lichaamweefsels direct verwarmt in plaats van de lucht. De frequentie van de straling die door infraroodsauna's wordt uitgezonden, is 3–12 μm, wat valt onder ver-infrarood (FIR). Ver-infrarood licht heeft weefselniveau-effecten aangetoond, met name op de mitochondriale ademhalingsketen in het proces van energieproductie in de cel en de bloedtoevoer naar weefsels door het verwijden van bloedvaten en het verbeteren van de circulatie.(18)
Pulsed Electromagnetic Field (PEMF) Therapie
PEMF-therapie gebruikt elektromagnetische velden om verschillende fysiologische processen te bevorderen. Onderzoek suggereert dat PEMF de mitochondriale functie kan verbeteren door de zuurstofconsumptie in de cellen te verhogen en de productie van ATP te versterken. PEMF-therapie heeft directe invloed op de mitochondriën, waardoor cellen terugkeren naar een gezondere energie- en elektrische laadstatus.(19-20) Lees hier de uitgebreide gids over PEMF-therapie.
Hyperbare zuurstoftherapie (HBOT)
HBOT houdt in dat men pure zuurstof inademt in een geperste omgeving. Hyperbare zuurstoftherapie is klinisch bewezen om de mitochondriën te revitaliseren en de ATP-vorming te verhogen door suprafysiologische hoeveelheden zuurstof te bieden die nodig zijn voor cellulaire ademhaling. Een recente studie meldde dat HBO de mitochondriale biogenese en autofagie verhoogde door gedeeltelijk de productie van reactieve zuurstofsoorten te verhogen. Dit proces produceerde nieuwe gezonde mitochondriën, en oude disfunctionele mitochondriën werden vernietigd. Deze studie vond ook een verhoogde activatie van de transcriptie en replicatie van mitochondriaal DNA.(21-22) Leer hier meer over HBOT.
Voedings- en supplementsteun voor mitochondriale functie
De rol van voeding bij het behouden van mitochondriale gezondheid is cruciaal, waarbij bepaalde voedingsstoffen bijzonder belangrijk zijn voor optimale mitochondriale functie. Deze omvatten de volgende hieronder vermelde.
- Co-enzym Q10 (CoQ10): Ubiquinon is vetoplosbaar en lijkt op een vitamine. Ubiquinon functioneert als een elektronendrager in de elektronentransferketen in mitochondriën (zie figuur aan de rechterkant) en bevordert de afscheiding van ATP. Ubiquinon-niveaus nemen af in verschillende weefsels met veroudering.(23)
- Magnesium: Betrokken bij ATP-synthese en cruciaal voor het behoud van mitochondriale integriteit en functie.(24)
- B-vitamines: Inclusief B1 (thiamine), B2 (riboflavine), B3 (niacine), B5 (pantotheenzuur), B6, B7 (biotine) en B12. Deze B-vitamines zijn cruciaal voor verschillende aspecten van het mitochondriale energiemetabolisme.(25)
- Alfa-liponzuur: ALA is een krachtige antioxidant die ook helpt andere antioxidanten te regenereren. Het speelt een rol in het energiemetabolisme en kan de mitochondriale functie verbeteren.(26)
- Carnitine (specifiek Acetyl-L-Carnitine): Vervoert vetzuren naar mitochondriën voor β-oxidatie, wat cruciaal is voor energieproductie, met name in spiercellen.(27)
- Creatine: Creatine is een van nature voorkomend verbinding in het lichaam die helpt energie aan cellen te leveren, met name spiercellen, door de vorming van adenosinetrifosfaat (ATP) te verhogen. Creatine-suppletie kan de mitochondriale efficiëntie verbeteren, vooral bij intensieve oefeningen.(28)
- Pyrroloquinoline Quinone (PQQ): PQQ is een antioxidant die de mitochondriale biogenese verhoogt via PGC-1 eiwitinhoud en de mitochondriale functie ondersteunt.(29)
- Omega-3-vetzuren (EPA en DHA): Omega-3's zijn essentieel voor het behoud van de vloeibaarheid en functie van het mitochondriale membraan. Deze worden voornamelijk aangetroffen in visolie en vette vis.(30)
- Nicotinamide Riboside (NR) en Nicotinamide Mononucleotide (NMN): Deze NAD+-precursors zijn essentieel voor mitochondriale functie en energieproductie. Suppletie met NR of NMN kan helpen de NAD+-niveaus te verhogen en zo de mitochondriale efficiëntie te verbeteren.(31) Lees hier meer over het optimaliseren van NAD+.
- Curcumine: Curcumine is de actieve verbinding in kurkuma. Het is aangetoond dat het mitochondriën beschermt tegen oxidatieve schade en hun functie verbetert.(32)
- Selenium: Een essentieel spoorelement dat een rol speelt bij het beschermen van mitochondriën tegen oxidatieve stress. Selenium reguleert ook de mitochondriale biogenese omhoog.(33)
Lichaamsbeweging en mitochondriale biogenese
Regelmatige fysieke activiteit is een cruciale factor in het bevorderen van mitochondriale biogenese, wat leidt tot de creatie van nieuwe mitochondriën, waardoor hun hoeveelheid en functionele capaciteit in cellen toeneemt. Verschillende vormen van lichaamsbeweging hebben verschillende effecten op mitochondriale dynamiek. De twee belangrijkste vormen van lichaamsbeweging zijn aerobe training en weerstandstraining.
Aerobe oefening
De mitochondriale dichtheid in skeletspiercellen neemt merkbaar toe tijdens aerobe oefeningen (bijv. hardlopen, fietsen en zwemmen).
Mitochondriale biogenese wordt gereguleerd door PGC-1α (peroxisoomproliferator-geactiveerde receptor gamma coactivator 1-alpha), een essentiële regulerende eiwit, waarvan de expressie door aerobe oefeningen wordt gestimuleerd. PGC-1α coactiveert nucleaire respiratoire factoren (NRFs) en mitochondriale transcriptiefactor A (TFAM), die nodig zijn om mtDNA te transcriberen en mitochondriën te repliceren. Dit leidt tot een verhoogde efficiëntie van oxidatieve fosforylering, betere uithoudingsvermogen en grotere ATP-generatie in spiercellen.(34)
Hoge-intensiteit intervaltraining (HIIT) is bijzonder effectief voor het verhogen van het aantal mitochondriën en de maximale zuurstofopname (VO2max).(35-36)
Krachttraining
Mitochondriale functie en efficiëntie zijn de primaire doelstellingen van krachttraining (bijv. gewichtheffen en lichaamsgewichtsoefeningen). Het triggert veranderingen in de mitochondriale eiwitsynthese, waardoor de kwaliteit en effectiviteit van de aanwezige mitochondriën worden verbeterd. Krachttraining verhoogt ook de productie van enzymen in elektronentransportketens en de Krebs-cyclus, wat de capaciteit van de cel voor ATP-synthese verder verbetert. Het kan ook het aantal en de grootte van mitochondriën in spiercellen verhogen, hoewel niet in dezelfde mate als aerobe oefeningen.(37-38)
Het gecombineerde effect van deze oefenmodaliteiten op mitochondriale biogenese en functie benadrukt het belang van fysieke activiteit bij het behouden en verbeteren van mitochondriale gezondheid. Regelmatige betrokkenheid bij aerobe en krachttraining verbetert de mitochondriale dichtheid, efficiëntie en energiemetabolisme van cellen op een uitgebreide manier. Deze aanpassingen zijn cruciaal voor atletische prestaties en zijn significant voor het behoud van gezondheid, ziektepreventie en het beheersen van aandoeningen die verband houden met mitochondriale disfunctie.
Echter, men moet opmerken dat training voor zowel kracht als uithoudingsvermogen tegelijkertijd leidt tot minder aanpassing, aangezien de eiwitkinasen PKB en AMPK elkaars downstream signalering blokkeren, wat het gelijktijdige trainingseffect belemmert.(39)
Mitofagie en cellulaire gezondheid
Mitofagie verwijst naar een selectieve vorm van autofagie die een essentiële rol speelt in cellulaire omstandigheden door alleen de beschadigde of niet-functionerende mitochondriën af te breken. Dit mechanisme is cruciaal voor de gezondheid van mitochondriën en een cel, waardoor mRNA's die defecte subeenheidassemblage coderen, worden voorkomen, waardoor verdere crises in cellulaire functies en talrijke pathologieën worden bespaard.(40)
Het elimineren van de beschadigde mitochondriën door mitofagie helpt oxidatieve stress, apoptose en ontsteking (geassocieerd met verschillende pathologieën) te verminderen. Verstoorde mitofagie vergemakkelijkt de accumulatie van disfunctionele mitochondriën in de pathogenese van neurodegeneratieve aandoeningen zoals de ziekte van Parkinson en de ziekte van Alzheimer. Evenzo leidt het verlies van mitofagie bij metabole aandoeningen tot veranderingen in het mitochondriale metabolisme, wat resulteert in insulineresistentie en type 2 diabetes.(41-42)
Het is aangetoond dat caloriebeperking mitofagie bevordert. Dit is deels te wijten aan de activatie van sirtuïnes (SIRT1), AMP-geactiveerde proteïnekinase (AMPK) en transcriptiefactor EB die zowel de respons op cellulaire energiecrisis als de initiatie van mitofagie ondersteunen. Specifiek reguleren sirtuïnes de functie van factoren in het mitofagie-mechanisme, waardoor beschadigde mitochondriën worden stilgelegd.(43)
De moleculaire effecten van caloriebeperking worden nagebootst door verbindingen zoals resveratrol (een polyfenol in rode wijn en sommige bessen) en vele andere polyfenolen. Resveratrol bevordert de activatie van SIRT1 en AMPK, waardoor mitofagie toeneemt die verantwoordelijk is voor de verbetering van mitochondriale functie en het herstel van cellulaire gezondheid.(44-45)
Mitofagie kan worden verbeterd met intermitterend vasten. Deze verbetering wordt waarschijnlijk gemitigeerd door de metabolische switch van glucose-gebaseerde naar keton-gebaseerde energie tijdens het vasten en deze verschuiving triggert mitofagie.(46-47)
Mitochondriale disfunctie als een kenmerk van veroudering
Begrijpen hoe mitochondriën bijdragen aan het verouderingsproces staat centraal in het onderzoek naar gerontologie en cellulaire biologie. Naarmate organismen verouderen, wordt mitochondriale disfunctie steeds gebruikelijker, wat een rol speelt in de fysiologische kant van veroudering.
De verouderende mitochondriën vertonen een verminderde productie van ATP, wat de energiegedreven processen die noodzakelijk zijn voor het welzijn van de cel beïnvloedt. Bovendien verstoren de structurele veranderingen in mitochondriën die met de leeftijd gepaard gaan deze afname van energetische output nog verder, zoals een abnormale samenstelling van het mitochondriale membraanpotentieel en de integriteit van de binnen-mitochondriale wand.(48)
De positie van mitochondriaal DNA (mtDNA) dicht bij de elektronentransportketen waar reactieve zuurstofsoorten ontstaan, beïnvloedt de kwetsbaarheid voor mutatie. Echter, de mutaties stapelen zich op met de tijd, wat resulteert in mitochondriale disfunctie. In tegenstelling tot nucleair DNA, dat aan histonen is gebonden ter bescherming en een verscheidenheid aan reparatiemechanismen beschikbaar heeft, mist mtDNA de beschermende coating door histonen en heeft het geen breed scala aan reparatiemethoden, waardoor het gemakkelijk beschadigd kan raken.(49)
In cellen produceren mitochondriën reactieve zuurstofsoorten (ROS). Hoewel ROS dient als een cruciaal middel voor de cel om te communiceren met en zich aan te passen aan zijn omgeving, wordt de generatie van hoge niveaus van deze moleculen beperkt door strikte controle. Overmatige productie in verschillende leeftijdsgerelateerde aandoeningen resulteert in cellen die lijden aan oxidatieve stress. Het vernietigt verschillende cellulaire componenten, of het nu eiwitten, lipiden of DNA zijn. De mitochondriën zijn zelfs de belangrijkste ontvanger van oxidatieve schade, wat een vicieuze cirkel creëert, aangezien beschadigde mitochondriën alleen maar meer ROS genereren, waardoor de cellulaire senescente.(50-52)
Mitochondriale dynamiek is cruciaal voor de mitochondriale functie die helpt om het fusie- en splitsingsproces te behouden. Echter, deze dynamiek wordt verstoord met veroudering en ondergaan de mitochondriën fragmentatie in plaats van fusie. Deze veranderingen beïnvloeden de functie van mitochondriën en hun positie in cellen.(53)
Het verlies van mitochondriale functie is geen passief verouderingsgerelateerd fenomeen, maar een actieve deelnemer aan de pathogenese van leeftijdsafhankelijke ziekten. Mitochondriale disfunctie is geassocieerd met aandoeningen zoals neurodegeneratieve ziekten, hart- en vaatziekten en metabole stoornissen. In deze aandoeningen zijn verminderde of defecte energieproductie, verhoogde oxidatieve stress en het onvermogen om beschadigde mitochondriën te verwijderen essentieel in de pathogenese en het verloop van de ziekte.(54)
Conclusie
Optimalisatie van mitochondriale gezondheid en de achteruitgang ervan met veroudering is een uitdagende taak, maar gelukkig is er veel dat we eraan kunnen doen. Belangrijke interventies omvatten voedingsondersteuning van kritische substraten voor regeneratie, waaronder Co-enzym Q10, magnesium en B-vitamines; regelmatige deelname aan diverse oefendisiplines om mitochondriale biogenese te vergroten; en levensstijlveranderingen zoals caloriebeperking of intermitterend vasten om de mitofagie-mechanismen te beïnvloeden.
Het erkennen van mitochondriale disfunctie als een van de factoren die betrokken zijn bij veroudering maakt deze strategieën essentieel voor het ondersteunen van cellulaire gezondheid en het bestrijden van leeftijdsgerelateerde degradatie. Integratieve benaderingen die gebruik maken van de kracht van op wetenschap gebaseerde kennis in combinatie met toepasbare levensstijlveranderingen kunnen gunstige voorwaarden creëren voor preventie en het vertragen van mitochondriale slijtage, wat in het algemeen het welzijn en de levensduur van een individu ten goede komt.
Wetenschappelijke referenties
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900–81), pionier van de moderne geneeskunde, architect van het intermediaire metabolisme. Journal of Medical Biography 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biochemie. 5e editie. Hoofdstuk 17, De citroenzuurcyclus. New York: W. H. Freeman.
- Wilkins, H. et al. (2014). Oxaloacetaat activeert de mitochondriale biogenese in de hersenen, verbetert het insulinepad, vermindert ontsteking en stimuleert neurogenese. Human Molecular Genetics 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Primaire en secundaire co-enzym Q10-tekort: de rol van therapeutische suppletie. Voedingsreviews 71 (3): 180–188. Review.
- Saraste, M. (1999). Oxidatieve fosforylering aan het eind van de eeuw. Wetenschap 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Menselijke mitochondriale tRNA's: biogenese, functie, structurele aspecten en ziekten. Jaarlijkse review van genetica 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Zijn mitochondriën de belangrijkste bijdragers van reactieve zuurstofsoorten in cellen? Journal of Experimental Biology 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Reactieve zuurstofsoorten in cellulaire signalering. American Journal of Physiology-Lung Cellular and Molecular Physiology 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Mechanismen van bio-energieproductie in mitochondriën. Mitochondriën en hun rol in hart- en vaatziekten 99–121.
- Bottje, W. (2019). Oxidatieve metabolisme en efficiëntie: de delicate balans van mitochondriën. Poultry science 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Beschikbaarheid van voedingsstoffen verbindt mitochondriën, apoptose en obesitas. Aging (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). Chronische caloriebeperking behoudt mitochondriale functie in senescente zonder mitochondriale biogenese te verhogen. Cell Metabolism 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Moleculaire mechanismen voor mitochondriale aanpassing aan training in skeletspieren. The FASEB Journal 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Regulatie van mitochondriale biogenese. Essays in Biochemistry 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Keton-gebaseerde metabolische therapie: is verhoogd NAD+ een primair mechanisme? Frontiers in Molecular Neuroscience 10: 377.
- Fowler, B. (1978). Algemene subcellulaire effecten van lood, kwik, cadmium en arseen. Environmental Health Perspectives 22:37-41.
- Hamblin, M. (2018). Mechanismen en mitochondriale redoxsignalisatie in fotobiomodulatie. Photochemistry and Photobiology 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Ver-infraroodstraling (FIR): de biologische effecten en medische toepassingen. Photonics and Lasers in Medicine 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). Elektromagnetische stimulatie verhoogt de mitochondriale functie in osteogene cellen en bevordert de genezing van botfracturen. Scientific Reports 11 (1): 19114.
- Tai, Y. et al. (2020). Magnetische velden moduleren het metabolisme en de darmmicrobioom in correlatie met Pgc-1 alpha-expressie: vervolg op een in vitro magnetische mitohormetische studie. The FASEB Journal 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). Het effect van hyperbare zuurstof op mitochondriale en glycolytische energiemetabolisme: het caloristasisconcept. Cell Stress and Chaperones 25 (4): 667-677.
- Chen, W. et al. (2020). Hyperbare zuurstof beschermt tegen myocardiale ischemie-reperfusieletsel door mitochondriale disfunctie en autofagie te remmen. Molecular Medicine Reports 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). De complexiteit van het maken van ubiquinon. Trends in Endocrinology & Metabolism 30 (12): 929-943.
- Volpe, S. (2013). Magnesium in ziektepreventie en algehele gezondheid. Advances in Nutrition 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O’Brien, P. (2006). Mitochondriale functie en toxiciteit: de rol van de B-vitaminenfamilie op mitochondriale energiemetabolisme. Chemico-biological Interactions 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Lipoïnezuurmetabolisme en mitochondriale redoxregulatie. Journal of Biological Chemistry 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Carnitine in human muscle bioenergetics: can carnitine supplementation improve physical exercise? Molecules 25 (1): 182.
- Wax, B. et al. (2021). Creatine voor oefening en sportprestaties, met hersteloverwegingen voor gezonde populaties. Nutrients 13 (6): 1915.
- Hwang, P. et al. (2020). Effecten van pyrroloquinoline quinone (PQQ) suppletie op de aerobe oefenprestaties en indices van mitochondriale biogenese bij ongetrainde mannen. Journal of the American College of Nutrition 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Het beïnvloeden van de samenstelling van mitochondriale membranen en bio-energetica door omega-3 suppletie. The Journal of Physiology 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). Nicotinamide riboside vergroot het NAD+-metabolome van verouderde menselijke skeletspieren en induceert transcriptomische en ontstekingsremmende handtekeningen. Cell Reports 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Curcumine, mitochondriale biogenese en mitofagie: recente gegevens verkennen en toekomstige behoeften aangeven. Biotechnology Advances 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Selenium, een micronutriënt die de cardiovasculaire gezondheid moduleert via redox enzymologie. Nutrients 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Regulatie van PGC-1α, een knooppuntregulator van mitochondriale biogenese. The American Journal of Clinical Nutrition 93 (4): 884S-890S.
- Helgerud, J. et al. (2007). Aerobe hoge-intensiteit intervallen verbeteren VO2max meer dan gematigde training. Geneeskunde en wetenschap in sport en oefening 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Vergelijkbare metabolische aanpassingen tijdens de oefening na sprintintervallen met een laag volume en traditionele uithoudingstraining bij mensen. Journal of Physiology 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Differentiële effecten van weerstand- en uithoudingsoefeningen in de gevoede toestand op de fosforylering van signaalmoleculen en eiwitsynthese in menselijke spieren. The Journal of Physiology 586586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Krachttraining verandert de mitochondriale functie in menselijke skeletspieren. Geneeskunde en wetenschap in sport en oefening 47 (9): 1922-1931.
- Baar, K. (2006). Training voor uithoudingsvermogen en kracht: lessen uit cellulaire signalering. Geneeskunde & wetenschap in sport & oefening 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). De paden van mitofagie voor kwaliteitscontrole en verwijdering van mitochondriën. Celdood & differentiatie 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitochondriën en de autofagie–ontsteking–celdood as in de veroudering van organismen. Wetenschap 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitofagie: een veelbelovende therapeutische doelstelling voor neuroprotectie tijdens veroudering en leeftijdsgerelateerde ziekten. British Journal of Pharmacology 180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Caloriebeperking: is AMPK een belangrijke sensor en effector? Fysiologie 26 (4): 214-224.
- Um, J. et al. (2010). AMP-geactiveerde proteïnekinase-deficiënte muizen zijn resistent tegen de metabolische effecten van resveratrol. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). De anti-verouderingseigenschappen van een uit druiven afgeleid antioxidant worden gereguleerd door de mitochondriale balans van fusie en splitsing, wat leidt tot mitofagie die wordt getriggerd door een signaalnetwerk van Sirt1-Sirt3-Foxo3-PINK1-PARKIN. Oxidatieve geneeskunde en cellulaire levensduur 2014: 345105.
- Longo, V. & Panda, S. (2016). Vasten, circadiane ritmes en tijdsbeperkt voeden in een gezonde levensduur. Cell Metabolism 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I& Sahebkar, A. (2020). Het effect van vasten of caloriebeperking op de inductie van mitofagie: een literatuurreview. Journal of Cachexia, Sarcopenia and Muscle 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Oxidatieve stress, mitochondriaal DNA-mutatie en aantasting van antioxidantenzymen bij veroudering. Experimental Biology and Medicine 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). mtDNA-mutaties en hun rol in veroudering, ziekten en forensische wetenschappen. Aging and Disease 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Generatie van reactieve zuurstofsoorten door mitochondriën. Antioxidanten 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Reactieve zuurstofsoorten en mitochondriën: een nexus van cellulaire homeostase. Redox Biologie 6: 472-485.
- Correia‐Melo, C. et al. (2016). Mitochondriën zijn vereist voor pro-verouderingskenmerken van het senescente fenotype. The EMBO Journal 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Mitochondriale fusie- en splitsingsproteïnen als nieuwe therapeutische doelwitten voor de behandeling van hart- en vaatziekten. European Journal of Pharmacology 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitofagie: een opkomende rol in veroudering en leeftijdsgerelateerde ziekten. Frontiers in Cell and Developmental Biology 8: 200.