NAD+ is een co-enzym dat in alle levende cellen voorkomt en noodzakelijk is voor de basisfunctionaliteit van het lichaam. NAD+-niveaus nemen af naarmate we ouder worden, wat wordt gedacht bij te dragen aan het verouderingsproces.
Nicotinamide adenine dinucleotide (NAD+/NADH)
NAD werd voor het eerst ontdekt tijdens de gisting van gist. Sinds de ontdekking is gebleken dat NAD (nicotinamide adenine dinucleotide) een belangrijke cofactor is die deelneemt aan vrijwel alle cellulaire reacties. Deze omvatten DNA-reparatie, functie van het immuunsysteem, ATP-productie en functie van de circadiane klok. NAD+ bevordert de energieproductie en stelt cellen in staat om goed te functioneren. Dysregulatie van de NAD+-niveaus is geassocieerd met metabole ziekten en verouderingsgerelateerde ziekten, waaronder neurodegeneratie, defecte immuunresponsen en kanker.
NAD heeft twee vormen – NAD+ en NADH, die beide de overdracht van elektronen aansteken:
- NAD+ is een oxiderend middel dat elektronen van andere moleculen oppikt en zo gereduceerd wordt
- NADH is een reducerend middel dat ontstaat uit gereduceerd NAD+ en vervolgens wordt gebruikt om elektronen aan andere moleculen te doneren, waardoor het weer NAD+ wordt
- Elektronen van NADH kunnen energie opslaan die tijdens een proces genaamd oxidatieve fosforylering in de mitochondriën wordt omgezet in ATP (zie het hoofdstuk over Oefeningen in de Biohacker’s Handbook voor meer informatie)
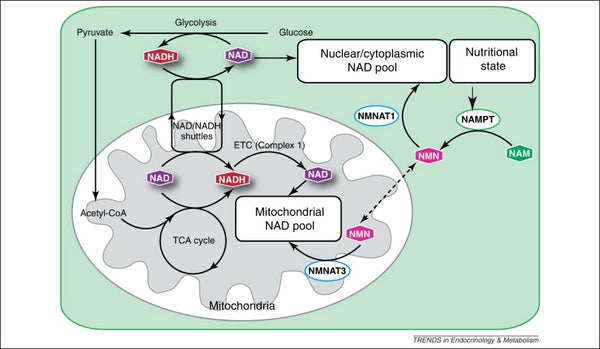
Afbeelding: Onderhoud van de mitochondriale NAD-voorraad.
Bron: Stein, L. & Imai, S. (2012). De dynamische regulatie van NAD-metabolisme in mitochondriën. Trends in Endocrinologie en Metabolisme 23 (9): 420–428.
Inleiding tot NAD+
Idealiter is NAD+ in een homeostatische status van biosynthese, consumptie, recycling en afbraak op zowel cellulair als systemisch niveau. Menselijke cellen kunnen NAD+ de novo syntheseren uit tryptofaan via het kynureninepad of uit nicotinezuur (NA) via het Preiss-Handlerpad. Echter, wordt het meeste NAD+ gerecycled uit nicotinamide (NAM), NA, nicotinamide riboside (NR) en nicotinamide mononucleotide (NMN) in het reddingspad om de cellulair NAD+-niveaus te handhaven. NAD+ kan in verschillende metabolische processen worden gereduceerd tot NADH, waaronder glycolyse, vetzuuroxidatie en de Krebs-cyclus.
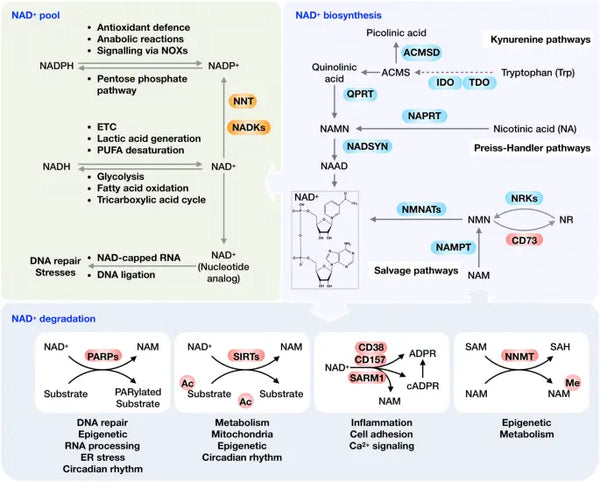
Afbeelding: Overzicht van het NAD+ metabolisme en zijn fysiologische functie.
Bron: Xie, N. et al. (2020). NAD+ metabolisme: pathofysiologische mechanismen en therapeutisch potentieel. Signaaloverdracht en gerichte therapie 5 (1): 1–37.
Als een co-substraat dat belangrijk is voor verschillende fundamentele macromoleculen, kan NAD+ worden gekliefd door NAD+-verbruikende enzymen. Deze omvatten PARPs, sirtuinen, CD38 en SARM1 om NAM en ADP-ribose te genereren (zie afbeelding). Onder normale homeostatische omstandigheden wordt CD38 op lage niveaus tot expressie gebracht, terwijl de toenemende expressie van CD38 met veroudering een cruciale rol speelt in de leeftijdsgebonden afname van NAD+. Deze opvatting wordt bevestigd door de observatie dat PARP1- en CD38-inhibitie effectief de totale beschikbaarheid van NAD+ verhoogt, wat leidt tot SIRT1-activatie.
Een afname van de NAD+-niveaus, gebaseerd op recente wetenschap, is geassocieerd met veroudering. Het is gebruikelijk dat de NAD+-niveaus na de leeftijd van 60 jaar tot minder dan de helft dalen vergeleken met de niveaus in je twintig. De grote vraag is waarom de NAD+-niveaus in de eerste plaats afnemen. Er zijn een paar theorieën over dit onderwerp, maar de nieuwste en meest ondersteunde theorie is dat de NAD+-niveaus afnemen met de leeftijd omdat het wordt vernietigd door de overactiviteit van een NAD-verbruikend enzym CD38. Een lage NAD+-status staat ook bekend om het immuunsysteem van het lichaam en natuurlijke afweermechanismen te remmen.
CD38, ook bekend als cyclisch ADP-ribose hydrolase, is een glycoproteïne dat op het oppervlak van veel immuuncellen (vooral witte bloedcellen) voorkomt, waaronder B-lymfocyten, natuurlijke killercellen, CD4⁺ en CD8. Gewoonlijk resulteert meer ontsteking in een hogere CD38-expressie, wat vervolgens NAD+ uitput. Daarom, het beheersen van laaggradige ontsteking en ontsteking in het algemeen, is de beste manier om NAD+-verlies door veroudering te minimaliseren.
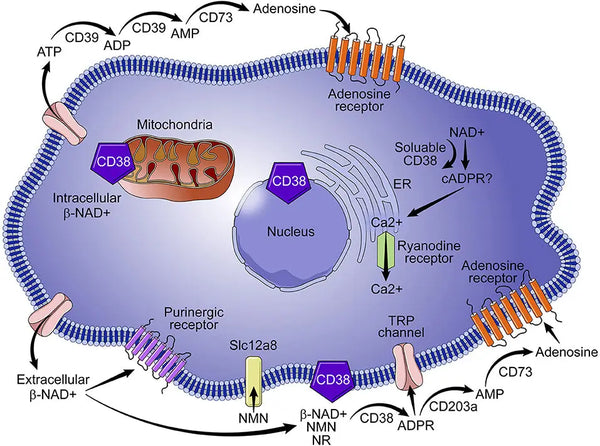
Afbeelding: Rol van CD38 in NAD+ metabolisme.
Bron: Hogan, K. & Chini, C. & Chini, E. (2019). De veelzijdige ecto-enzym CD38: rollen in immunomodulatie, kanker, veroudering en metabole ziekten. Frontiers in Immunology 10: 1187.
NAD+ verlicht oxidatieve schade veroorzaakt door virale en bacteriële infecties
Virale infecties en infecties in het algemeen veroorzaken oxidatieve stress in gastcellen (bijv. menselijke cellen). Daarom wordt oxidatieve stress beschouwd als een pathogeen factor bij virale infecties. De verhoogde reactieve zuurstofsoorten in cellen door virale infectie veroorzaken bijvoorbeeld DNA-schade, genmutatie, celdood, integratie van viraal DNA en tumorigenese. Om de door oxidatieve stress veroorzaakte DNA-schade te herstellen, is een grote hoeveelheid NAD+ nodig en wordt deze verbruikt door verhoogde PARPs als reactie op virale infectie.
Sirtuinen zijn een andere klasse van NAD+-verbruikende enzymen, die brede antivirale eigenschappen hebben op diverse virussen (inclusief HIV-1, HCMB, H1N1 en HCV). CD38 is het derde NAD+-verbruikende enzym dat overexpressie vertoont als reactie op meerdere virale infecties. CD38-tekort resulteert in een verhoogde vatbaarheid voor verschillende pathogenen.
Bacteriële infecties induceren ook een snelle productie van intracellulaire reactieve zuurstofsoorten (ROS) ofwel door NADPH-oxidases (NOXs) of mitochondriën die essentieel zijn voor macrofagen om bacteriën op te ruimen. NAD+/NADH oefent de bacteriedodende activiteit uit door de ROS-generatie, de pro-inflammatoire respons en de anti-infectie autofagie te bevorderen. Dit gunstige en natuurlijke metabolische proces heeft een goed functionerend NAD+ metabolisme en optimale niveaus van NAD+ nodig om goed te functioneren. De eliminatie van de ROS resulteert in defecte bacteriedodende (bacteriën-dodende) activiteit, waardoor bacteriën kunnen overleven en herhaaldelijk verschillende weefsels kunnen koloniseren.
Dit is de reden waarom het niet voordelig is voor het immuunsysteem om voortdurend te veel antioxidanten te gebruiken. De sleutel hier voor optimale homeostase is een balans tussen oxidatieve stress en antioxidantcapaciteit.
Opkomend bewijs ondersteunt de hypothese dat de CD38 en producten die worden gecontroleerd door de CD38/NAD+ as mogelijk een significante rol spelen in de pathogenese van SARS-CoV-2-infectie. Overexpressie van CD38 in COVID-19 veroorzaakt celdood voornamelijk door uitputting van NAD+. Orale toediening van NAD+-precursors (NR, NAM en NMN) lijkt de meest effectieve benadering te zijn om de NAD+-niveaus aan te vullen (zie later). Van deze NAD+-precursors heeft NR (1 gram per dag gesupplementeerd) ontstekingsremmende effecten in verschillende ziekteomstandigheden. Huidig wetenschappelijk bewijs lijkt te bevestigen dat belangrijke gebeurtenissen van de biosynthese en consumptie van NAD+ significante rollen spelen in de antivirale immuunrespons. Het verhogen van de NAD+-niveaus door de biosynthetische paden te moduleren of door het verlagen van het NAD+-verbruik kan helpen de hyperimmune respons op SARS-CoV-2-infectie te beheersen.
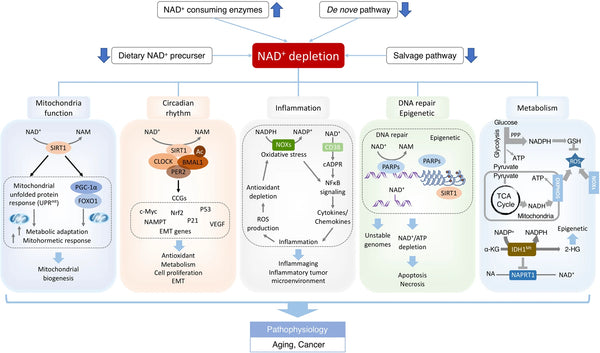
Afbeelding: NAD+-tekorten in verouderingsgerelateerde disfunctie en kanker.
Bron: Xie, N. et al. (2020). NAD+ metabolisme: pathofysiologische mechanismen en therapeutisch potentieel. Signaaloverdracht en gerichte therapie 5 (1): 1–37.
Levensstijlfactoren die de NAD+-niveaus verlagen:
- Circadiaanse ritme mismatches
- Chronische ontsteking en oxidatieve stress
- Constante calorische overschot (altijd te veel eten) – hogere NADH, lagere NAD+
- Verhoogde bloedsuiker- en insulineniveaus
- Chronisch alcoholgebruik
Mogelijke gevolgen van NAD+-tekort:
- Beïnvloede functie van het immuunsysteem
- Versnelde veroudering
- Mitochondriale disfunctie
- Verstoorde circadiaanse klokken (met veroudering)
- Verhoogde carcinogenese en risico op kanker
- Verhoogd risico op insulineresistentie en de ontwikkeling van diabetes
- Verhoogd risico op obesitas
- Verhoogd risico op niet-alcoholische leververvetting
- Verhoogd risico op neurodegeneratieve aandoeningen
- Verhoogd risico op hart- en nierfalen
Beste manieren om de NAD+-niveaus in het lichaam te verhogen:
In het algemeen worden de intracellulaire NAD+-niveaus gehandhaafd tussen 0,2 en 0,5 mM, afhankelijk van het celtype of weefsel. Echter, de concentratie en distributie van NAD+ kunnen fluctueren als reactie op diverse fysiologische stimuli en cellulaire stress.
- Oefen regelmatig (intermittent) vasten en calorische beperking toe (leer meer hier)
- Activeer ketogenese in het lichaam en heb regelmatig perioden van glucosebeperking
- Beweeg regelmatig
- Oefen warmte-alteratie toe (leer meer hier)
- De beste voedselbronnen van NAD+-precursors zijn:
- Rauwe en gefermenteerde zuivel (rijk aan NR)
- Vette vis zoals zalm, sardines, forel en makreel (rijk aan niacine)
- Rendier, rundvlees en kippenlever (rijk aan niacine)
- Varkensvlees en kalkoen (rijk aan tryptofaan en niacine)
- Rundvlees (rijk aan niacine)
- Supplement met NAD+-precursors
- Nicotinamide riboside (NR): optimale dosis 300 mg per dag
- Nicotinamide mononucleotide (NMN): optimale dosis 250–500 mg per dag
- Liposomale dosis is ongeveer 10x kleiner
- Gebruik met trimethylglycine (TMG) voor een optimaal methylatieproces
- Niacinamide (NAM): optimale dosis 250–500 mg per dag
- Nicotinezuur (NA): optimale dosis 250–500 mg per dag
Er zijn geen langetermijngegevens over de veiligheid van continue suppletie met NAD+-precursors, NR en NMN in het bijzonder. Te hoge NAD+-niveaus kunnen ook verstoringen in de NAD+/NADH homeostase veroorzaken. Deze omvatten circadiaanse ritme mismatches en op basis van muizenstudies, verstoringen van de slaapcyclus evenals verstoorde honger- en eetpatronen. Op basis hiervan kan het ideaal zijn om NAD+-precursors 's ochtends in te nemen.
Aanbevolen supplementen:
Fysiologische voordelen van hoge NAD+-niveaus in het lichaam:
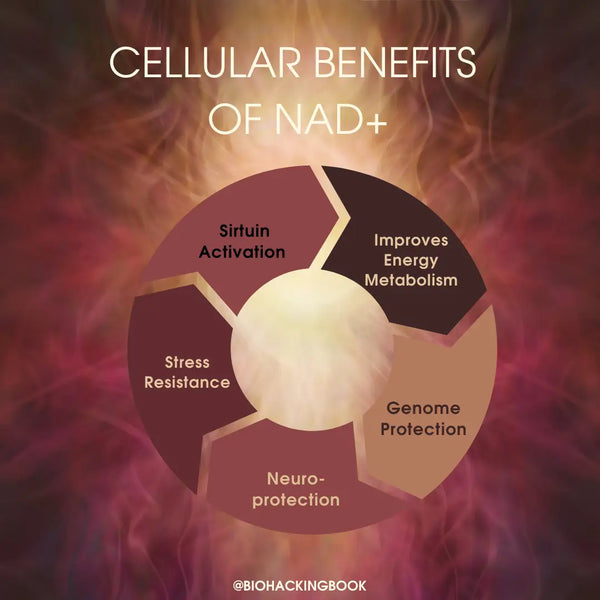
- Optimaal mitochondriale functie
- Cruciaal biochemisch element in energieproductie en spierfunctie
- Optimaal hersenfunctie en preventie van neurodegeneratie
- Optimaal slaap-waakritme en onderhoud van natuurlijke circadiaanse ritmes
- Bescherming tegen oxidatieve stress en ontsteking
- Cellulaire overleving en zuurstofproductie
- Vertraagde veroudering en langere levensduur & gezondheidspan via mitofagie en DNA-reparatie (gebaseerd op muizenstudies)
- Verlaagd risico op hartziekten via het omkeren van leeftijdsgerelateerde arteriële disfunctie en verbeterde algehele hartgezondheid (gebaseerd op muizenstudies)
- Verminderde veroudering van de huid
///






