De studie van veerkracht door de lens van genetica is een groeiend interessegebied, dat vaak kruist met de disciplines van psychologie, neurobiologie en genomica. Hoewel het concept van veerkracht – het vermogen om te herstellen van of zich aan te passen aan tegenspoed of stress – veelzijdig is en beïnvloed wordt door een complexe interactie van genetische, omgevings- en psychologische factoren, zijn er specifieke DNA-tests ontwikkeld om inzicht te geven in de genetische componenten van deze eigenschap.
Inleiding
Genen zijn segmenten van DNA die de instructies bevatten die het lichaam nodig heeft om elk van de vele duizenden eiwitten te maken die nodig zijn voor het leven. Elk gen bestaat uit duizenden combinaties van "letters" (genaamd basen) die je genetische code vormen. De code geeft de instructies om de eiwitten te maken die nodig zijn voor een goede ontwikkeling en functie.(1)
Genetische variaties kunnen de expressie van een gen beïnvloeden, waardoor metabolische processen die belangrijk zijn voor het behoud van cellulaire gezondheid en hoe we reageren op omgevingsinterventies zoals dieet, levensstijl, supplementen en medicatie, worden beïnvloed.
Kennis van deze genetische variaties biedt ongeëvenaard inzicht in biologische systemen, waardoor zorgverleners precieze interventies kunnen aanbevelen die gericht zijn op het helpen bereiken van iemands doelen en het bereiken van optimale gezondheid.
Begrijpen van Genetische Merkers van Veerkracht
Veerkracht—het vermogen om te herstellen van of zich gemakkelijk aan te passen aan tegenspoed of verandering—wordt steeds meer gezien door de lens van de genetica. Door genetische merkers te onderzoeken, proberen onderzoekers en clinici de biologische basis te onthullen die zou kunnen verklaren waarom sommige individuen effectiever terugveren van stress en trauma dan anderen.(2) Dit opkomende onderzoeksgebied heeft zich gericht op veerkrachtgerelateerde DNA-tests die genetische merkers onderzoeken die mogelijk verantwoordelijk zijn voor de verschillen in individuele stressreacties.
In het hart van dit onderzoek liggen de endocriene en zenuwstelsels (het autonome zenuwstelsel, in het bijzonder) die centraal staan in de reactie van het lichaam op stress. De hypothalamus-hypofyse-bijnier (HPA) as, in het bijzonder, is een centraal aandachtspunt omdat het een cruciale rol speelt in het reguleren van de stressreactiemechanismen van het lichaam. Dit complexe netwerk van interacties tussen de hypothalamus, de hypofyse en de bijnieren coördineert de productie en regulatie van belangrijke stresshormonen, zoals cortisol.
Cortisol heeft verstrekkende effecten op veel lichaamsfuncties en wordt vrijgegeven als reactie op stress en een lage bloedglucoseconcentratie. Onder normale omstandigheden helpt cortisol om de homeostase te herstellen na stressvolle gebeurtenissen. Echter, genvariaties die de HPA-as beïnvloeden, kunnen leiden tot verschillen in hoe cortisol wordt geproduceerd, gereguleerd en uit het lichaam wordt verwijderd. Deze genetische variaties kunnen de fysiologische veerkracht van een individu beïnvloeden — hun vermogen om de psychologische en fysieke gezondheid na tegenspoed te behouden of snel te herstellen.(3)
DNA-tests voor veerkracht onderzoeken genvarianten die geassocieerd zijn met de receptoren voor stresshormonen, eiwitten die betrokken zijn bij de stresshormoonpaden en enzymen die deze hormonen metabolizeren. Bijvoorbeeld, een variant van het FKBP5-gen, dat betrokken is bij het reguleren van de gevoeligheid van de glucocorticoïde receptor waardoor cortisol zijn effecten uitoefent, zou de stressreactie van een individu kunnen wijzigen en mogelijk hun vatbaarheid voor stressgerelateerde aandoeningen. Verder uitbreidend, zijn genen die coderen voor neurotransmitters – de chemische boodschappers van de hersenen die bijdragen aan stemmingsregulatie en cognitie – ook in de schijnwerpers. Deze omvatten genen zoals COMT, die essentieel is voor de afbraak van dopamine, een neurotransmitter die geassocieerd is met plezier en beloningssystemen.(4)
Bovendien, ontsteking is een biologisch proces dat nauw verbonden is met stress en stemmingsstoornissen. Chronische ontsteking, die door genetische variaties kan worden beïnvloed, kan de hersenfunctie en het gedrag beïnvloeden.(5) Daarom kunnen genetische tests ook proberen varianten in pro-inflammatoire cytokinegenen, zoals IL-6 en TNF, te identificeren, die individuen vatbaar kunnen maken voor langdurige ontstekingsreacties en hun mentale veerkracht kunnen beïnvloeden.
Het begrijpen van deze genetische merkers is de hoeksteen voor gepersonaliseerde interventies. Door genetische aanleg te identificeren, kunnen individuen proactieve stappen ondernemen om hun veerkracht te versterken door middel van levensstijlveranderingen, psychologische strategieën en medische behandelingen die zijn afgestemd op hun unieke genetische samenstelling. Deze benadering is een voorbeeld van de verschuiving naar precisiegeneeskunde, waarbij het one-size-fits-all-model plaatsmaakt voor meer geïndividualiseerde zorg.
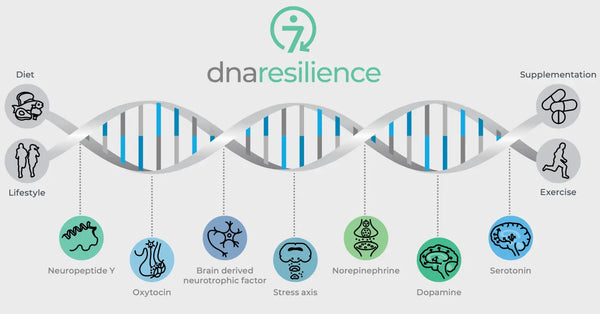
Afbeelding: De zeven moleculaire paden van veerkracht.
Soorten DNA-tests voor veerkracht
1) Stressresponsgenen
Stressresponsgenen zijn kritische componenten van ons lichaamssysteem voor het beheren en reageren op stressoren. Ze coderen voor eiwitten die verschillende fysiologische processen reguleren, waaronder de afgifte en werking van cortisol, een hormoon dat cruciaal is in de stressreactie.
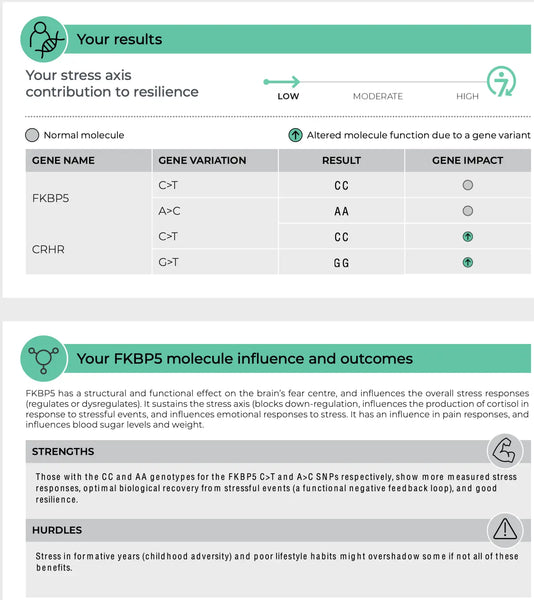
CRHR1 (Corticotropine-Releasing Hormoon Receptor 1)
CRHR1 codeert een receptor voor corticotropine-releasing hormoon (CRH), een centraal hormoon dat de stressreactie initieert. Wanneer CRH bindt aan CRHR1, stimuleert het de productie en afgifte van adrenocorticotroop hormoon (ACTH), wat de bijnieren aanzet tot de productie van cortisol. Varianten in het CRHR1-gen kunnen beïnvloeden hoe gevoelig deze receptor is voor CRH, wat de algehele stressreactie kan veranderen. Bijvoorbeeld, sommige polymorfismen kunnen leiden tot een verhoogde stressreactie, wat kan bijdragen aan angst of depressie. In tegenstelling tot anderen kunnen ze de reactie verminderen, wat invloed heeft op het vermogen om acute stress aan te kunnen.(6-7)
FKBP5 (FK506 Binding Protein 5)
Het FKBP5-gen speelt een rol bij het reguleren van de gevoeligheid van de glucocorticoïde receptor, de receptor waardoor cortisol zijn effecten uitoefent. Specifieke polymorfismen in FKBP5 zijn in verband gebracht met gewijzigde feedbackremming van de HPA-as en verschillende reacties op glucocorticoïden. Bijvoorbeeld, sommige varianten van FKBP5 kunnen de affiniteit van de glucocorticoïde receptor voor cortisol verminderen, wat mogelijk leidt tot een verminderde stressreactie en een verhoogd risico op stressgerelateerde psychiatrische aandoeningen zoals PTSD of ernstige depressie.(8-9)
Afbeelding: Een voorbeeldpagina van de DNA Veerkracht-test.
NR3C1 (Nucleaire Receptor Subfamilie 3, Groep C, Lid 1)
NR3C1 codeert voor de glucocorticoïde receptor zelf. Variaties in dit gen kunnen beïnvloeden hoe het lichaam reageert op cortisol. Specifieke polymorfismen in NR3C1 kunnen de gevoeligheid of dichtheid van glucocorticoïde receptoren beïnvloeden, wat van invloed is op hoe effectief cortisol zijn functies kan uitoefenen. Dit kan leiden tot een scala aan reacties, van een gedempte stressreactie die een individu kan belemmeren om adequaat te reageren op stressoren tot een overdreven reactie die kan resulteren in chronische stresssymptomen en zelfs depressie.(10-12)
De resultaten van de testen van stressresponsgenen kunnen inzicht geven in de aanleg van een individu voor stressgerelateerde gezondheidsproblemen. Bijvoorbeeld:
-
Verhoogde Stressreactie: Individuen met specifieke varianten kunnen reactiever zijn op stress en hogere cortisolniveaus ervaren tijdens stressvolle gebeurtenissen.
-
Verminderde Stressreactie: Omgekeerd kunnen sommige individuen een gedempte stressreactie hebben, wat beschermend kan zijn in acute stresssituaties, maar ook de activatie van noodzakelijke fysiologische mechanismen in reactie op uitdagingen kan belemmeren.
2) Uitleg van Neurotransmitterfunctie Tests
Neurotransmitterfunctie tests zijn ontworpen om de genetische factoren te onderzoeken die van invloed zijn op hoe neurotransmitters worden gesynthetiseerd, vrijgegeven en afgebroken in de hersenen. Aangezien neurotransmitters chemische boodschappers zijn die stemming, cognitie en stressreacties reguleren, kunnen variaties in genen die met deze stoffen verband houden aanzienlijke implicaties hebben voor de psychologische veerkracht van een individu en de algehele mentale gezondheid.
Het verkennen van neurotransmitterfunctie in de context van veerkracht en stressreactie gaat verder dan alleen de catecholamines zoals dopamine. Het omvat een breder spectrum van neurotransmittersystemen die betrokken zijn bij stemmingsregulatie, alertheid en cognitieve functie. Verschillende genen zijn betrokken bij de synthese, signalering en afbraak van deze neurotransmitters, waaronder dopamine beta-hydroxylase (DBH), dopamine-receptoren (DRD2, DRD4) en verschillende serotonine-gerelateerde genen.(13)
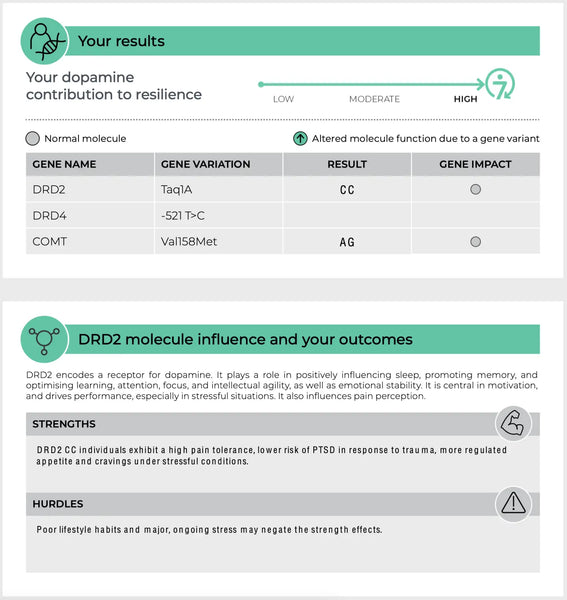
COMT (Catechol-O-Methyltransferase)
Het COMT-gen is een van de meest uitgebreid bestudeerde genen met betrekking tot neurotransmitterfunctie. Het codeert een enzym dat catecholamines afbreekt—zoals dopamine, epinefrine en norepinefrine—neurotransmitters die cruciaal zijn voor de stressreactie, cognitie en emotie-regulatie.
Er zijn bekende polymorfismen in het COMT-gen, zoals de Val158Met-variant. Deze variant kan het activiteitsniveau van het enzym op verschillende manieren beïnvloeden:(14-15)
- Hoge-activiteitsvorm (Val-variant): Deze vorm van het enzym breekt dopamine sneller af, wat kan leiden tot lagere niveaus van dopamine in de prefrontale cortex, een hersengebied dat betrokken is bij uitvoerende functies en besluitvorming. Individuen met deze variant kunnen beter presteren in taken onder stabiele omstandigheden, maar kunnen gevoeliger zijn voor cognitieve achteruitgang onder stress door lagere beschikbaarheid van dopamine.
- Lage-activiteitsvorm (Met-variant): Omgekeerd, deze vorm van het COMT-enzym metaboliseert dopamine langzamer, wat resulteert in hogere dopamine-niveaus in de hersenen. Dit kan de cognitieve functie onder stress verbeteren, maar kan ook het risico op stressgerelateerde psychopathologieën, zoals angststoornissen, verhogen, omdat de hersenen mogelijk overgestimuleerd worden door overtollige dopamine.
Dopamine Beta-Hydroxylase (DBH)
DBH is een enzym dat dopamine omzet in norepinefrine, een neurotransmitter die betrokken is bij de vecht-of-vluchtreactie. Genetische variaties in het DBH-gen kunnen de enzymactiviteit beïnvloeden, wat de niveaus van dopamine en norepinefrine in de hersenen en het perifere zenuwstelsel beïnvloedt.(16-18)
- Lage Activiteit: Varianten die geassocieerd zijn met lagere DBH-activiteit kunnen leiden tot hogere niveaus van dopamine en verlaagde niveaus van norepinefrine, wat invloed kan hebben op cognitieve functies zoals aandacht en besluitvorming en hoe een individu reageert op stress.
- Hoge Activiteit: Omgekeerd kunnen varianten die resulteren in hogere DBH-activiteit de dopamine-niveaus verlagen terwijl ze norepinefrine verhogen, wat mogelijk invloed heeft op stressreactiviteit en angst.
Dopamine Receptoren (DRD2 en DRD4)
DRD2 en DRD4 zijn genen die respectievelijk de dopamine-receptoren D2 en D4 coderen. Deze receptoren maken deel uit van het dopaminesysteem dat talrijke functies reguleert, waaronder stemming, beloning en motorische controle.(19-20)
- DRD2: Varianten in het DRD2-gen kunnen de dichtheid en bindingsaffiniteit van D2-receptoren beïnvloeden. Dit kan de kwetsbaarheid voor stress en de effectiviteit van beloningsgerelateerde signalen beïnvloeden, met mogelijke implicaties voor aandoeningen zoals verslaving en depressie.
- DRD4: Het DRD4-gen is bekend om een variabel aantal tandemherhalingen (VNTR) in het coderingsgebied. Specifieke herhalingen zijn geassocieerd met eigenschappen zoals nieuwigheid zoeken en het risico op aandachtsstoornissen. Dit polymorfisme kan de efficiëntie van synaptische dopaminesignalisering beïnvloeden en is bestudeerd in de context van gedrags- en psychologische veerkracht.
Afbeelding: Een voorbeeldpagina van de DNA Veerkracht-test.
Serotonine Genvariaties
Serotonine is een andere cruciale neurotransmitter in de regulatie van stemming, eetlust en slaap, die allemaal door stress kunnen worden beïnvloed. Verschillende genen die betrokken zijn bij serotoninesignalisering zijn van belang:
- 5-HTT (SLC6A4): Dit gen codeert voor de serotonine transporter, verantwoordelijk voor de heropname van serotonine uit de synaptische spleet. Het 5-HTTLPR-polymorfisme in de promotorregio van dit gen is bestudeerd vanwege de associatie met stressgevoeligheid en stemmingsstoornissen.(21)
- MAOA: Het monoamine oxidase A-gen is verantwoordelijk voor het afbreken van serotonine. Variaties in dit gen kunnen de serotonineniveaus beïnvloeden en zijn geassocieerd met gedragskenmerken en vatbaarheid voor stress.(22)
- TPH2: Tryptofaanhydroxylase-2 is een enzym dat cruciaal is voor de synthese van serotonine in de hersenen. Genetische variaties in TPH2 kunnen de serotonineproductie beïnvloeden, wat mogelijk invloed heeft op emotionele regulatie en reactie op stress.(23)
De interpretatie van de resultaten van deze tests kan complex zijn. Bijvoorbeeld, een variant die geassocieerd is met een hoger risico op stressgerelateerde aandoeningen betekent niet noodzakelijk dat een individu dergelijke aandoeningen zal ontwikkelen, maar kan wijzen op een verhoogde kwetsbaarheid. Evenzo garandeert het bezitten van een "veerkracht"-variant geen onoverwinnelijke weerstand tegen stress, aangezien omgevingsfactoren en levensstijlkeuzes aanzienlijke rollen spelen.
3) Ontsteking en de impact op de hersenen
Chronische ontsteking kan schadelijk zijn voor de gezondheid van de hersenen. Men denkt dat het bijdraagt aan de ontwikkeling en progressie van neurodegeneratieve ziekten en mogelijk de stressreactie van de hersenen beïnvloedt, die nauw verbonden is met veerkracht. Pro-inflammatoire cytokines, zoals interleukine-6 (IL-6) en tumor necrosefactor (TNF), kunnen de bloed-hersenbarrière oversteken en interageren met de paden die stemming, motivatie en alertheid reguleren.(24)
Genvarianten Geassocieerd met Ontsteking
IL-6 (Interleukine-6)
IL-6 is een cytokine dat een rol speelt in de ontstekingsreactie en betrokken is bij verschillende biologische functies, waaronder de immuunrespons, hematopoëse en botmetabolisme. In de context van stress en veerkracht is IL-6 gerelateerd aan het volgende:(25-26)
- Verhoogde IL-6-niveaus zijn geassocieerd met een groter risico op het ontwikkelen van depressie en andere stemmingsstoornissen.
- Specifieke genetische varianten van het IL-6-gen kunnen leiden tot een verhoogde expressie van IL-6, wat mogelijk de ontstekingsreactie verergert en het vermogen van de hersenen om met stress om te gaan, verandert.
TNF (Tumor Necrosefactor)
TNF is een andere cytokine die betrokken is bij systemische ontsteking. Het heeft verschillende rollen, waaronder het reguleren van immuuncellen en de inductie van koorts, apoptose en ontsteking.(27)
- Overexpressie van TNF is in verband gebracht met verschillende chronische ziekten, waaronder reumatoïde artritis, inflammatoire darmziekte en psoriasis, evenals psychologische stress en depressie.
- Varianten in het TNF-gen kunnen het niveau van TNF-productie beïnvloeden, wat directe implicaties kan hebben voor ontstekingsprocessen in het hele lichaam en de hersenen.
4) Neurobiologische Regulators en Veerkrachtfactoren
Genetische variaties in cruciale neurobiologische regulators bepalen ook de veerkracht tegen stress. Deze omvatten oxytocine, Brain-Derived Neurotrophic Factor (BDNF) en Neuropeptide Y (NPY). Oxytocine speelt een rol bij het reguleren van sociaal gedrag en stressreacties. BDNF is cruciaal voor het behoud van neuroplasticiteit en cognitieve functie onder stress en NPY moduleert angst en de fysiologische stressreactie. Deze moleculen beïnvloeden gezamenlijk onze neurale circuits en psychologische veerkracht, en bieden inzicht in individuele verschillen in stressveerkracht en potentiële wegen voor gepersonaliseerde biohackingstrategieën.
Oxytocine
Oxytocine wordt vaak de "liefdeshormoon" genoemd vanwege de rol in sociale binding, moederlijke gedragingen en intimiteit. Het heeft ook anxiolytische effecten en beïnvloedt sociale cognitie en gedrag.
- Genetische Invloed: Variaties in het oxytocine receptor gen (OXTR) zijn geassocieerd met emotionele regulatie, sociaal gedrag en stressresponsiviteit. Specifieke polymorfismen in OXTR kunnen de bindings efficiëntie en expressieniveaus van oxytocine receptoren beïnvloeden, wat de mogelijkheid van een individu om met stress om te gaan en sociale relaties te vormen kan beïnvloeden.(28)
- Implicaties: In de context van veerkracht testen, kan het beoordelen van OXTR-varianten inzicht geven in de aanleg van een individu voor sociale angst, empathieniveaus en potentiële veerkracht in het gezicht van stress, vooral die welke sociale dynamiek omvat.(29)
Brain-Derived Neurotrophic Factor (BDNF)
BDNF is een cruciaal eiwit dat betrokken is bij neuroplasticiteit, het vermogen van de hersenen om zich te reorganiseren en nieuwe neurale verbindingen gedurende het leven te vormen. Het is cruciaal voor leren, geheugen en de regeneratie van neuronen.(30)
- Genetische Variaties: De BDNF-genvariant Val66Met is een van de meest bestudeerde polymorfismen. De Met-allel is geassocieerd met verminderde activiteit-afhankelijke secretie van BDNF, wat de cognitieve functie en veerkracht tegen neurologische en psychiatrische aandoeningen kan beïnvloeden.(31)
- Implicaties: Het testen op BDNF-genvarianten kan helpen de capaciteit van een individu voor neuroplasticiteit in reactie op stress te voorspellen en kan implicaties hebben voor herstel van neurologische letsels of trauma.(32)
Afbeelding: Een voorbeeldpagina van de DNA Veerkracht-testanalyse.
Neuropeptide Y (NPY)
NPY is een van de meest voorkomende peptiden in de hersenen en is betrokken bij het reguleren van stressreacties, angst en voedselinname. Het wordt beschouwd als een endogeen anxiolytisch middel.
- Genetische Associaties: Polymorfismen in het NPY-gen kunnen leiden tot verschillen in NPY-expressie en -secretie, wat mogelijk de stressveerkracht van een individu beïnvloedt. Hogere niveaus van NPY zijn over het algemeen beschermend tegen de effecten van stress.
- Implicaties Genetische tests voor NPY-varianten kunnen mogelijk de basislijn stressveerkracht van een individu aangeven en hun psychologische reactie op chronische stress en trauma voorspellen.(33)
De Rol van Epigenetica in het Modulerende van Stress Veerkracht
Het veld van epigenetica duikt in een laag van complexiteit die verder gaat dan de statische DNA-sequentie. Epigenetische modificaties bestaan uit chemische veranderingen in de DNA-structuur, zoals methylatie en histonmodificaties, die kunnen beïnvloeden hoe genen worden geëxprimeerd zonder de onderliggende genetische code te veranderen. Deze veranderingen zijn dynamisch en responsief op omgevingsstimuli, waaronder chronische stress. Blootstelling aan langdurige stress kan leiden tot epigenetische veranderingen die de werking van genen die betrokken zijn bij de stressreactie beïnvloeden, wat het voor individuen moeilijker kan maken om effectief met nieuwe stressoren om te gaan.(34-35)
Bedrijven aan de voorhoede van gepersonaliseerde geneeskunde wagen zich nu in de epigenetica, op zoek naar hoe deze modificaties kunnen bijdragen aan het vermogen van een individu om stress te weerstaan en terug te veren. Door epigenetische merkers te analyseren, kunnen wetenschappers inzicht krijgen in de huidige staat van genexpressieprofielen, die het resultaat zijn van zowel genetische aanleg als omgevingsinvloeden. Dergelijke tests kunnen epigenetische veranderingen identificeren in reactie op chronische stress, wat een momentopname biedt van de moleculaire mechanismen die bijdragen aan de stressreactie van een individu of het gebrek daaraan.
Bovendien opent het begrijpen van deze epigenetische veranderingen de deur naar gepersonaliseerde interventies. Specifieke levensstijlveranderingen, dieetaanpassingen en therapeutische strategieën kunnen worden aanbevolen om nadelige epigenetische modificaties te omkeren. Deze gepersonaliseerde benadering verbetert niet alleen de veerkracht van een individu, maar draagt ook bij aan een breder begrip van hoe stress onze biologische systemen op epigenetisch niveau beïnvloedt, wat zou kunnen leiden tot nieuwe behandelingen en preventieve strategieën voor stressgerelateerde aandoeningen. Door het epigenetische landschap van de stressreactie in kaart te brengen, kunnen we beginnen een completer beeld te schetsen van de factoren die bijdragen aan ons unieke vermogen om met de uitdagingen van het leven om te gaan.
De Voordelen en Beperkingen van Veerkracht DNA-tests
Deze tests kunnen individuen een beter begrip bieden van hun aangeboren veerkracht en stressreactie. Dergelijke kennis kan gepersonaliseerde strategieën voor het omgaan met stress en het verbeteren van de mentale gezondheid informeren. Het is echter essentieel om deze tests met voorzichtigheid te benaderen:
- Complex Kenmerk: Veerkracht wordt niet bepaald door een enkel gen, maar is een complex kenmerk dat wordt beïnvloed door vele genen en omgevingsfactoren.
- Omgevingsinvloed: Genetica werkt niet in isolatie. Levenservaringen, ondersteuningssystemen en levensstijlkeuzes zijn significant in veerkracht.
- Voorspellende Kracht: Hoewel deze tests inzicht kunnen bieden, zijn ze geen definitieve voorspellers van het vermogen van een individu om met de uitdagingen van het leven om te gaan.
Conclusie
DNA-tests met betrekking tot veerkracht vertegenwoordigen een intrigerende grens in het begrijpen van hoe onze genetische samenstelling mogelijk de mogelijkheid beïnvloedt om met stress om te gaan en te herstellen van tegenspoed. Hoewel ze waardevolle inzichten kunnen bieden, moeten ze worden gezien als een stuk van de enorme puzzel die de veerkracht van een individu vormt. Voor iedereen die geïnteresseerd is in deze tests, wordt aanbevolen om een zorgverlener of een genetisch adviseur te raadplegen om de resultaten te interpreteren binnen de bredere context van hun gezondheid en levensstijl.
- Krijg hier je Integrale DNA-test!
- Boek een consult om je laboratorium- en gentests met Dr. Sovijärvi hier te interpreteren.
Wetenschappelijke referenties:
- Bobrow, M., & Grimbaldeston, A. H. (2000). Medische genetica, het humane genoomproject en publieke gezondheid: Gepresenteerd aan de Universiteit van Liverpool, 9 december 1996 en geaccepteerd voor publicatie op 17 februari 2000. Tijdschrift voor Epidemiologie & Gemeenschapsgezondheid, 54(9), 645-649.
- Cicchetti, D. (2010). Veerkracht onder omstandigheden van extreme stress: een multilevelperspectief. Wereldpsychiatrie, 9(3), 145.
- Luecken, L. J.,& Gallo, L. C. (Eds.). (2008). Handbook of physiological research methods in health psychology. Sage.
- Southwick, S. M.,Vythilingam, M.,& Charney, D. S. (2005). De psychobiologie van depressie en veerkracht tegen stress: implicaties voor preventie en behandeling. Annu. Rev. Clin. Psychol., 1, 255-291.
- Michaud, M.,Balardy, L.,Moulis, G.,Gaudin, C.,Peyrot, C.,Vellas, B., ... & Nourhashemi, F. (2013). Pro-inflammatoire cytokines, veroudering en leeftijdsgerelateerde ziekten. Tijdschrift van de American Medical Directors Association, 14(12), 877-882. Aguilera, G.,
- Nikodemova, M.,Wynn, P. C.,& Catt, K. J. Corticotropine-releasing hormoonreceptoren: twee decennia later. (2004). Corticotropine-releasing hormoonreceptoren: twee decennia later. Peptides, 25(3), 319-329.
- Subbannayya, T.,Balakrishnan, L.,Sudarshan, G.,Advani, J.,Kumar, S.,Mahmood, R., ... & Prasad, T. K. (2013). Een geïntegreerde kaart van het corticotropine-releasing hormoon signaalpad. Tijdschrift voor celcommunicatie en signalering, 7, 295-300.
- Binder, E. B. (2009). De rol van FKBP5, een co-chaperone van de glucocorticoïde receptor in de pathogenese en therapie van affectieve en angststoornissen. Psychoneuroendocrinologie, 34, S186-S195.
- Ising, M.,Depping, A. M.,Siebertz, A.,Lucae, S.,Unschuld, P. G.,Kloiber, S., ... & Holsboer, F. (2008). Polymorfismen in de FKBP5-genregio moduleren het herstel van psychosociale stress bij gezonde controles. Europese Journal of Neuroscience, 28(2), 389-398.
- Vitellius, G.,Trabado, S.,Bouligand, J.,Delemer, B.,& Lombès, M. (2018, juni). Pathofysiologie van glucocorticoïde signalering. In Annales d'endocrinologie (Vol. 79, No. 3, pp. 98-106). Elsevier Masson.
- Van West, D.,Van Den Eede, F.,Del-Favero, J.,Souery, D.,Norrback, K. F.,Van Duijn, C., ... & Claes, S. (2006). Glucocorticoïde receptor gen-gebaseerde SNP-analyse bij patiënten met terugkerende majeure depressie. Neuropsychofarmacologie, 31(3), 620-627.
- Schneider, K. K.,Frings, C.,Meyer, J.,& Schote, A. B. (2016). De rol van het glucocorticoïde receptor gen (NR3C1) voor de verwerking van aversieve stimuli. Neuroscience Research, 107, 8-13.
- Azadmarzabadi, E.,Haghighatfard, A.,& Mohammadi, A. (2018). Laag veerkracht tegen stress is geassocieerd met veranderingen in de expressie van kandidaatgenen in het dopaminerge signaalpad. Psychogeriatrie, 18(3), 190-201.
- Heinz, A.,& Smolka, M. N. (2006). De effecten van het catechol O-methyltransferase-genotype op hersenactivatie veroorzaakt door affectieve stimuli en cognitieve taken. Reviews in the Neurosciences, 17(3), 359-368.
- Mier, D.,Kirsch, P.,& Meyer-Lindenberg, A. (2010). Neurale substraten van de pleiotrope werking van genetische variatie in COMT: een meta-analyse. Moleculaire psychiatrie, 15(9), 918-927.
- Mustapic, M.,Maihofer, A. X.,Mahata, M.,Chen, Y.,Baker, D. G.,O'Connor, D. T.,& Nievergelt, C. M. (2014). Het catecholamine biosynthetisch enzym dopamine β-hydroxylase (DBH): eerste genoom-brede zoektocht naar posities van eigenschap-bepalende varianten die additief werken in de proximale promotor. Menselijke moleculaire genetica, 23(23), 6375-6384.
- Vincent, S.,& Robertson, D. (2002). Het bredere perspectief: catecholamine-afwijkingen. Klinisch Autonoom Onderzoek, 12, I44-I49.
- Hoenicka, J.,Aragüés, M.,Ponce, G.,Rodríguez-Jiménez, R.,Jiménez-Arriero, M. A.,& Palomo, T. (2007). Van dopaminerge genen naar psychiatrische aandoeningen. Neurotoxiciteit onderzoek, 11, 61-71.
- Hill, S. Y.,Hoffman, E. K.,Zezza, N.,Thalamuthu, A.,Weeks, D. E.,Matthews, A. G.,& Mukhopadhyay, I. (2008). Dopaminerge mutaties: binnen-familie associatie en koppeling in multiplex alcoholafhankelijkheidsfamilies. American Journal of Medical Genetics Part B: Neuropsychiatrische Genetica, 147(4), 517-526.
- He, Y.,Martin, N.,Zhu, G.,& Liu, Y. (2018). Kandidaatgenen voor nieuwigheid-zoekend gedrag: een meta-analyse van associatiestudies van: DRD4: exon III en: COMT: Val158Met. Psychiatrische genetica, 28(6), 97-109.
- Avula, R.,Rand, A.,Black, J. L.,& O'kane, D. J. (2011). Gelijktijdige genotypering van meerdere polymorfismen in het menselijke serotonine transporter gen en detectie van nieuwe allelvarianten. Translationele psychiatrie, 1(8), e32-e32.
- Tivol, E. A.,Shalish, C.,Schuback, D. E.,Hsu, Y. P.,& Breakefield, X. O. (1996). Mutational analysis of the human MAOA gene. American journal of medical genetics, 67(1), 92-97.
- Waider, J.,Araragi, N.,Gutknecht, L.,& Lesch, K. P. (2011). Tryptofaanhydroxylase-2 (TPH2) in stoornissen van cognitieve controle en emotie-regulatie: een perspectief. Psychoneuroendocrinologie, 36(3), 393-405.
- Bauer, M. E.,& Teixeira, A. L. (2021). Neuro-inflammatie bij stemmingsstoornissen: rol van regulerende immuuncellen. Neuroimmunomodulatie, 28(3), 99-107.
- Anderson, G.,Kubera, M.,Duda, W.,Lasoń, W.,Berk, M.,& Maes, M. (2013). Verhoogde IL-6 trans-signaling bij depressie: focus op het tryptofaan kataboliet pad, melatonine en neuroprogressie. Farmacologische Rapporten, 65(6), 1647-1654.
- Perry, B. I.,Upthegrove, R.,Kappelmann, N.,Jones, P. B.,Burgess, S.,& Khandaker, G. M. (2021). Associaties van immunologische eiwitten/kenmerken met schizofrenie, majeure depressie en bipolaire stoornis: een bi-directionele twee-sample mendeliaanse randomisatie studie. Brein, gedrag en immuniteit, 97, 176-185.
- Bradley, J. (2008). TNF-gemedieerde inflammatoire ziekte. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 214(2), 149-160.
- Loth, E.,Poline, J. B.,Thyreau, B.,Jia, T.,Tao, C.,Lourdusamy, A., ... & IMAGEN Consortium. (2014). Oxytocine receptor genotype moduleert de activiteit van de ventrale striatum op sociale signalen en de reactie op stressvolle levensgebeurtenissen. Biologische psychiatrie, 76(5), 367-376.
- Myers, A. J.,Williams, L.,Gatt, J. M.,McAuley-Clark, E. Z.,Dobson-Stone, C.,Schofield, P. R.,& Nemeroff, C. B. (2014). Variatie in het oxytocine receptor gen is geassocieerd met een verhoogd risico op angst, stress en depressie bij individuen met een geschiedenis van blootstelling aan vroege levensstress. Tijdschrift voor psychiatrisch onderzoek, 59, 93-100.
- Cowansage, K. K.,LeDoux, J. E.,& Monfils, M. H. (2010). Brain-derived neurotrophic factor: een dynamische poortwachter van neurale plasticiteit. Current molecular pharmacology, 3(1), 12-29.
- Chen, Z. Y.,Jing, D.,Bath, K. G.,Ieraci, A.,Khan, T.,Siao, C. J., ... & Lee, F. S. (2006). Genetische variant BDNF (Val66Met) polymorfisme verandert angstgerelateerd gedrag. science, 314(5796), 140-143.
- Phillips, C. (2017). Brain-derived neurotrophic factor, depressie en fysieke activiteit: het maken van de neuroplastic verbinding. Neurale plasticiteit, 2017.
- Schmeltzer, S. N.,Herman, J. P.,& Sah, R. (2016). Neuropeptide Y (NPY) en posttraumatische stressstoornis (PTSD): een translationele update. Experimentele neurologie, 284, 196-210.
- Lux, V. (2016, maart). Epigenetische Programmeren in Psychobiologische Ontwikkeling: Bewijs voor de Dual-Activatietheorie en een Bemiddelende Rol van Vroege Levensstress. In Qatar Foundation Annual Research Conference Proceedings Volume 2016 Issue 1 (Vol. 2016, No. 1, p. HBOP3415). Hamad bin Khalifa University Press (HBKU Press).
- Chukwuma Sr, C. (2022). Epigenetica en de essentie ervan in het begrijpen van menselijke groei, ontwikkeling en ziekte. J Med Res, 8(5), 165-172.