Alles wat je moet weten over veroudering en anti-verouderingsprocessen. Hoe veroudering om te keren? Wat zijn de 9 kenmerken van veroudering? Lees verder om erachter te komen!
In 2013 publiceerden Carlos López-Otín en zijn collega's een baanbrekend artikel, waarin ze probeerden de cellulaire en moleculaire kenmerken van veroudering te identificeren en te categoriseren. Ze stelden negen kandidaat-kenmerken voor die over het algemeen worden beschouwd als bijdragend aan het verouderingsproces en samen het verouderingsfenotype bepalen. López-Otín et al. definieerden dat een kenmerk idealiter aan de drie volgende criteria moet voldoen: het moet zich manifesteren tijdens normale veroudering, de experimentele verergering moet veroudering versnellen en de experimentele verbetering moet het normale verouderingsproces vertragen en daarmee de gezonde levensduur verlengen.
De oorspronkelijke negen kenmerken van veroudering
De sleutel tot het vertragen of zelfs omkeren van veroudering is niet gebaseerd op het idee van alleen het verlengen van de levensduur, maar gezondheidsduur (de periode van het leven die in goede gezondheid wordt doorgebracht, vrij van de chronische ziekten en handicaps van veroudering). Tot nu toe is er niet veel compressie van morbiditeit geweest omdat we de mortaliteit meer hebben verminderd dan we morbiditeit hebben voorkomen. De gezondheidsduur (gezonde jaren van leven) zal toenemen wanneer morbiditeit (de toestand van lijden aan een ziekte of medische aandoening) afneemt, het meest effectief door de leeftijd van het begin te verhogen.
Succesvolle en gezonde veroudering kan als volgt worden gedefinieerd:
- Lage kans op ziekte of handicap
- Hoge cognitieve en fysieke functiecapaciteit
- Actieve betrokkenheid bij het leven
De voorgestelde negen kenmerken van veroudering zijn gegroepeerd in drie categorieën:
- 1. Primaire kenmerken (oorzaken van schade)
- De initiërende triggers waarvan de schadelijke gevolgen zich geleidelijk met de tijd ophopen. Alle onmiskenbaar negatief.
- 2. Antagonistische kenmerken (reacties op schade)
- Tegenovergestelde effecten van de primaire kenmerken. Bij lage niveaus bemiddelen ze gunstige effecten, maar bij hoge niveaus worden ze schadelijk (bijv. senescentie).
- 3. Integratieve kenmerken (schuldigen van het fenotype)
- Het eindresultaat van de vorige twee groepen kenmerken en de opgestapelde schade die niet kan worden gecompenseerd door weefselhomeostatische mechanismen. Deze zijn uiteindelijk verantwoordelijk voor de functionele achteruitgang die gepaard gaat met veroudering.
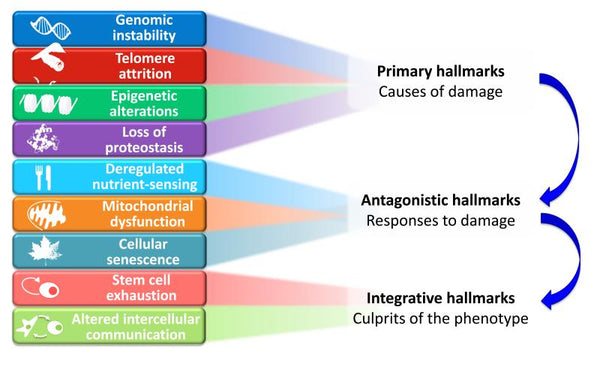
Afbeelding: Functionele Verbindingen tussen de Kenmerken van Veroudering.
Bron: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). De kenmerken van veroudering. Cell 153 (6): 1194–1217.
1. Genomische instabiliteit
De integriteit en stabiliteit van DNA worden voortdurend uitgedaagd door externe fysieke, chemische en biologische agenten, evenals door interne bedreigingen, waaronder fouten bij DNA-replicatie, spontane hydrolytische reacties en de productie van reactieve zuurstofsoorten. Deze leiden uiteindelijk tot de accumulatie van genetische schade gedurende het leven.
Manieren om de genomische stabiliteit te verbeteren (Kenmerk #1):
- Antioxidatieve micronutriënten (selenium, zink, vitamine C, vitamine E) -> beperk DNA-letsel
- Herstel zelfs lichte tekorten aan foliumzuur, vitamine B12, niacine en zink -> heeft een significante impact op de spontane chromosoomschadegraad
- Ganoderma lucidum (reishi) glucanen
- Polyfenolen -> vangen vrije radicalen
- Gemiddelde & ”auto-gereguleerde” oefening
- Vermijd het volgende:
- Straling en chemische blootstelling
- Blootstelling aan zware metalen
- Nikkel, cadmium en arseen, in het bijzonder
- Roken
- Te lang zitten
- Overmatig gebruik van alcohol, energiedranken en melk
2. Telomeerverlies
Telomeren zijn bijzonder kwetsbaar voor leeftijdsgerelateerde achteruitgang. Telomeerverkorting wordt waargenomen tijdens normale veroudering zowel bij mensen als bij muizen. Telomeren zijn gebonden aan een multiproteïnecomplex genaamd shelterin, dat de toegang van DNA-reparatie-eiwitten tot de telomeren voorkomt (zonder dit zouden telomeren worden “gerepareerd” als DNA-breuken, wat leidt tot chromosoomfusies). DNA-schade bij telomeren is opmerkelijk constant en zeer efficiënt in het induceren van senescentie.
Manieren om telomeerverkorting te verminderen (Kenmerk #2):
- Verhoog de inname van antioxidanten via voeding
- Hoge inname van omega-3-vetzuren, in het bijzonder
- Optimaliseer de vitamine D, vitamine B12 en folaat niveaus in het bloed
- Mediterrane voeding
- Vermijd het volgende:
- Roken
- Obesitas
- Toxineblootstelling en vervuiling
- Balans van stressniveaus
- Balans van trainingsroutine en intense trainingssessies
- Loving-kindness meditatie & mindfulness meditatie praktijk (en meditatie in het algemeen)
- Hyperbare zuurstoftherapie (HBOT)
- Gynostemma, gotu kola en astragalus kruiden (mogelijk effectief)
- Wat niet werkt: langdurige calorische beperking
3. Epigenetische veranderingen
Veel soorten epigenetische veranderingen beïnvloeden alle cellen en weefsels gedurende het leven (veroorzaakt door dingen zoals dieet, chemicaliën, medicijnen, zonlicht, hitte/kou, lichaamsbeweging, enz.). Epigenetische veranderingen veronderstellen veranderingen in DNA-methylatiepatronen, posttranslationele modificatie van histonen en chromatine-remodeling. Leden van de sirtuinfamilie van NAD-afhankelijke eiwitdeacetylasen en ADP-ribosyltransferasen zijn uitgebreid bestudeerd als potentiële anti-verouderingsfactoren – bij mensen dragen ten minste drie leden van de sirtuinfamilie, SIRT1, SIRT3 en SIRT6, bij aan gezonde veroudering.
Manieren om te beheren epigenetische verandering (Kenmerk #3):
- Optimaliseer methylatiepaden (folaat, B12, B6, TMG)
- Sirtuinpadactivatoren (SIRT1, SIRT3, SIRT6):
- Spermidine (remt histondeacetylasen)
- Intermitterende calorische beperking en intermitterend vasten
- Regelmatige (intense) lichaamsbeweging
- Slaapoptimalisatie (slaapverlies veroorzaakt schadelijke epigenetische veranderingen)
- Metformine (bijwerkingen zijn de kanttekening); bij voorkeur (dihydro)berberine
- Alfa-ketoglutaraat (CaAKG)
- Krijg regelmatig hormetische doses van warmte, kou, zonlicht, enz. (”de dosis maakt het gif”)
- Epigenetische medicijnen in ontwikkeling die gericht zijn op DNA-methyltransferase, histondeacetylase, histonmethyltransferase en chromatine
Aanbevolen supplementen:
Purovitalis Liposomale Quercetine
Purovitalis Liposomale Resveratrol
4. Verlies van proteostase
Proteostase omvat mechanismen voor de stabilisatie van correct gevouwen eiwitten (vooral de hitte-shockfamilie van eiwitten) en mechanismen voor de afbraak van eiwitten door het proteasoom of de lysosoom. Meerdere studies hebben aangetoond dat proteostase verandert met veroudering wat leidt tot chronische expressie van niet-gevouwen, verkeerd gevouwen of geaggregeerde eiwitten. Deze dragen bij aan de ontwikkeling van enkele leeftijdsgerelateerde degeneratieve ziekten, zoals de ziekte van Alzheimer.
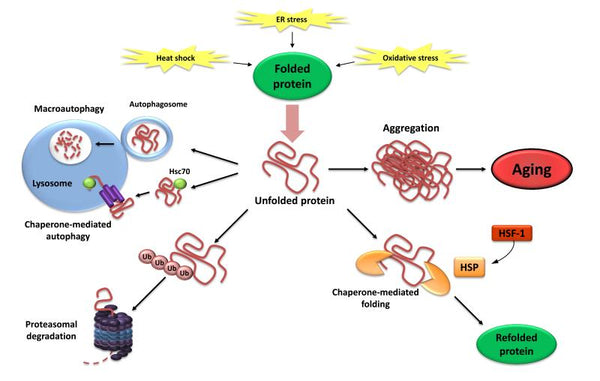
Afbeelding: Verlies van Proteostase. Het falen om niet-gevouwen eiwitten opnieuw te vouwen of af te breken kan leiden tot hun accumulatie en aggregatie, wat resulteert in proteotoxic effecten.
Bron: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). De kenmerken van veroudering. Cell 153 (6): 1194–1217.
Manieren om de stabiliteit van proteostase te verbeteren (Kenmerk #4):
In het algemeen is de beste manier om het lichaam te beschermen tegen het verlies van proteostase door autofagie te activeren.
- Vasten, intermitterende calorische beperking (langdurig is niet nuttig!), ketose, oefening (in een nuchtere toestand het beste), weerstandstraining, kou & hitteblootstelling, diepe slaap (en melatonine)
- Sulforafaan, koffie, curcumine, polyfenolen, EVOO, resveratrol, groene thee, spermidine
- Senolytische voedingsstoffen & supplementen:
- Quercetine, fisetine, luteoline, curcumine, piperlongumine, moleculair waterstof (H2) enz.
- AMPK-activatoren:
- Berberine (DHB is nog beter), resveratrol (en pterostilbeen), hesperidine, ginsenosiden, quercetine, curcumine, naringenine, gynostemma, crocine (in saffraan), salvianolzuur B, alfa-liponzuur, enz.
- Metformine & rapamycine (Nb. pos mogelijke bijwerkingen)
- Hsp70 (hitte-shock eiwit 70) inductoren:
- Sauna en hitteblootstelling
- Shikonine (van de wortels van de shikonineplant)
- Specifieke senolytische medicijnen (zoals Dasatinib en Navitoclax)
5. Gedereguleerde voedingssensoriek
IGF-1 en insuline signaling staat bekend als het IIS-pad, dat het meest geconserveerde verouderingscontrolesysteem in de evolutie is. Naast het IIS-pad dat deelneemt aan glucose sensing, zijn er drie aanvullende gerelateerde en onderling verbonden voedingssensor systemen: mTOR (sensing van hoge aminozuurconcentraties), AMPK (sensing van lage-energie toestanden door hoge AMP-niveaus te detecteren), en sirtuinen (sensing van lage-energie toestanden door hoge NAD+-niveaus te detecteren). Samenvattend, er is sterk bewijs dat anabole signaling (mTOR, hoge insuline) veroudering versnelt en verminderde voedingssignaling (AMPK, lage insuline) de levensduur verlengt.
Manieren om gedereguleerde voedingssensoriek te beheren (Kenmerk #5):
Praktisch gezien zijn alle voorgaande manieren om kenmerken 1-4 te beheren opgenomen in het sensibiliseren en opnieuw reguleren van voedingssensoriek. Deze omvatten:
- dieetbeperkingen
- AMPK-activatie
- sirtuinactivatie
- hormesis
- het verminderen van oxidatieve stress en ontsteking
- het verhogen van autofagie
6. Mitochondriale disfunctie
Mitochondriale disfunctie is gevonden om het verouderingsproces te versnellen. Wanneer een organisme veroudert, vermindert de effectiviteit van de ademhalingsketen van de cellen, wat leidt tot elektronlekkage en verminderde ATP-generatie. De verminderde efficiëntie van mitochondriale bio-energetica met veroudering kan resultaat zijn van meerdere elkaar kruisende mechanismen, waaronder verminderde biogenese van mitochondriën, accumulatie van mutaties en deleties in mtDNA, oxidatieve stress in mitochondriale eiwitten, destabilisatie van de ademhalingsketen, veranderingen in de lipide samenstelling van mitochondriale membranen en veranderingen in mitochondriale dynamiek.
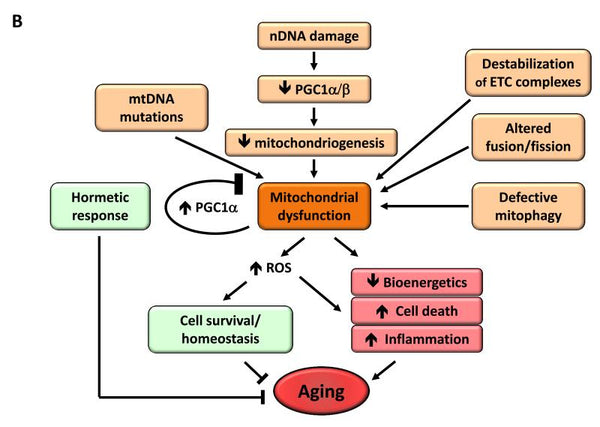
Afbeelding: Mitochondriale disfunctie en de invloed ervan op veroudering.
Bron: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). De kenmerken van veroudering. Cell 153 (6): 1194–1217.
Manieren om mitochondriale disfunctie te beheren (Kenmerk #6):
- Activeer mitohormesis met:
- Intermitterende calorische beperking
- Intermitterend vasten
- Lichaamsbeweging
- Koude blootstelling
- Fytonutriënten (zoals flavonoïden)
- Richt je op het Nrf2-pad (homeostase & structurele integriteit) met:
- Hitte- en koudeblootstelling
- Fysieke oefening
- Intermitterend vasten en ketose
- Sulforafaan, polyfenolen, quercetine, curcumine, enz.
- Moleculair waterstof (H2) -> productaanbeveling
- Verbeter mitochondriale biogenese & herstel (activering van PGC-1α):
- Fysieke oefening
- Ketose en ketonlichamen
- Acetyl-L-carnitine
- Polyfenolen, quercetine
- Rhodiola rosea (salidrosides)
- Co-enzym Q10, pyrroloquinoline quinone (PQQ), nicotinamide mononucleotide (NMN), alfa-liponzuur (ALA)
7. Cellulaire senescentie
Omdat het aantal senescente cellen toeneemt met veroudering, is verondersteld dat senescentie bijdraagt aan veroudering. Senescentie is echter nodig om de verspreiding en proliferatie van beschadigde cellen te voorkomen, wat een immuunrespons triggert. Dit cellulaire controlepunt vereist een efficiënt systeem voor celvervanging dat zowel de verwijdering van senescente cellen als de mobilisatie van voorlopercellen omvat om het optimale aantal cellen te herstellen. Senescente cellen vertonen aanzienlijke veranderingen in hun secretome, dat bijzonder rijk is aan pro-inflammatoire cytokines en matrixmetalloproteinases. Het wordt daarom aangeduid als het “senescentie-geassocieerde secretie-fenotype”.
Manieren om cellulaire senescentie te bestrijden (Kenmerk #7):
Senescente cellen stoppen uiteindelijk met vermenigvuldigen, maar sterven niet af wanneer ze dat zouden moeten, zoals reguliere cellen doen. In plaats daarvan blijven ze bestaan en blijven ze chemicaliën afgeven die ontsteking en immuunrespons kunnen triggeren.
Senolytische verbindingen die selectief senescente cellen targeten omvatten:
- Fisetin (ook wel “de ultieme senolytic” genoemd)
- Quercetine
- Theaflavins
- Apigenine
- Tocotrienolen (vorm van vitamine E)
- Piperlongumine
- Moleculair waterstof (H2)
8. Uitputting van stamcellen
Volwassen stamcellen zijn in staat tot zelfvernieuwing en differentiatie in meerdere celtypen binnen een weefsel. Hoewel fenotypes en mechanismen sterk variëren, neemt de functie van alle stamcelpopulaties af met de leeftijd. Uitputting van stamcellen is de verenigende consequentie van verschillende verouderingsgerelateerde schade en vormt waarschijnlijk een van de uiteindelijke schuldigen van cellulaire veroudering. Studies bij oude muizen hebben een algehele afname van de celcyclusactiviteit van hematopoëtische stamcellen (HSC's), wat correleert met de accumulatie van DNA-schade en overexpressie van celcyclusremmende eiwitten (bijv. p16INK4a). Telomeerverkorting is ook gevonden als een belangrijke oorzaak van de afname van stamcellen bij veroudering.
Manieren om stamceluitputting tegen te gaan (Kenmerk #8):
- Stamceltherapie (autoloog vs allogeen & verschillende celtypen)
- Stamceltherapieën zijn nog steeds een ”wilde westen” – potentiële bijwerkingen en risico's zijn aanwezig, zoals de groei van tumoren en kanker.
- Fotobiomodulatie (”roodlichttherapie”)
- PBM stimuleert verschillende soorten stamcellen om hun migratie, proliferatie en differentiatie in vitro en in vivo te verbeteren.
- Herstel verouderde stamcellen door toxische metabolieten aan te pakken:
- Activeer sirtuinen – SIRT1 & SIRT 3 (zie #3 & #4)
- N-acetylcysteïne (NAC)
- Verbeter de stabiliteit van proteostase (zie #4)
- Verbeter de mitochondriale functie (zie #6)
- Gebruik senolytica (zie #7)
- Herstel epigenetisch geheugen (zie #3)
- Optimaliseer vitamine D-niveaus
- Spirulina (in vitro studie)
9. Veranderde intercellulaire communicatie
Cellulaire veroudering vindt ook plaats op het niveau van intercellulaire communicatie. Deze omvatten neurohormonale signalering (verhoogde ontstekingsreacties), immunosurveillance (pathogenen en premaligne cellen) en veranderingen in de extracellulaire omgeving. Veroudering door ontsteking wordt inflammaging genoemd. Het kan het resultaat zijn van meerdere oorzaken, zoals de accumulatie van pro-inflammatoire weefselschade, het falen van een disfunctioneel immuunsysteem om effectief pathogenen en disfunctionele gastcellen te verwijderen en het optreden van een onvoldoende autofagische respons. Veranderingen in de veroudering van één weefsel kunnen leiden tot verouderingsspecifieke verslechtering van het aangrenzende weefsel: senescente cellen induceren senescentie in hun aangrenzende cellen via gap-junction-gemedieerde cel-celcontacten en processen die reactieve zuurstofsoorten omvatten. Dit fenomeen wordt ook wel een senescente cel bijeffect genoemd.
Manieren om te verbeteren intercellulaire communicatie (Kenmerk #9):
- Lagere algemene ontsteking in het lichaam
- Een algehele anti-inflammatoire levensstijlbenadering
- Gebruik moleculair waterstof (H2)
- Meerdere anti-verouderingseffecten in het lichaam (inclusief de vermindering van inflammaging)
- Lagere oxidatieve stress in het lichaam en verminder reactieve zuurstofsoorten (ROS)
- Verhoog autofagie in het lichaam (zie eerder)
- Behandel darmdysbiose en verbeter de diversiteit en algemene gezondheid van de darmmicrobiota
- Behandel mogelijk lekkende darm syndroom
10. Stijfheid van de extracellulaire matrix (ECM)
Naast deze in 2013 gedefinieerde negen kenmerken van veroudering, is er een tiende kenmerk in de maak. Twee onderzoekers, Alexander Fedintsev en Alexey Moskalev, hebben in 2021 een artikel gepubliceerd dat een nadere blik werpt op de verharding van de extracellulaire matrix (ECM): de opbouw van kruisverbindingen tussen langlevende moleculen zoals collageen en elastine. Ze suggereren dat de verharding van de ECM wordt veroorzaakt door de niet-enzymatische chemische reacties van glycaties, carbamylaties en carbonylaties en dat het zelfs de bovenliggende oorzaak zou kunnen zijn van verschillende geaccepteerde kenmerken van veroudering, zoals cellulaire senescentie. Deze veranderingen leiden tot de vorming van adducten en kruisverbindingen die op hun beurt ontsteking, fibrose, verstoring van de circadiane klok van weefsels, veroudering van stamcellen, enzovoort veroorzaken. Het is eerder vastgesteld dat geavanceerde glycatieweerstanden (AGE's) pathogene betekenis hebben voor verschillende weefsels en paden in het lichaam. Organismen met buitengewoon lange levensduur (zoals bowhead walvissen) hebben uitzonderlijk lage accumulatiesnelheden van AGE's.
Potentiële therapeutica voor de stijfheid van de extracellulaire matrix (ECM) (Kenmerk #10):
In menselijke skeletspieren is de leeftijdsgerelateerde functionele achteruitgang te wijten aan de verhoogde stijfheid van de ECM, voornamelijk veroorzaakt door collageenaccumulatie.
- Manuele therapie en mechanistische druk
- Osteopathische therapie, acupunctuur, myofasciale release
- Een combinatie van synthetische en natuurlijke AGE-remmers die synergetisch werken in verschillende stadia van de vorming
- Natuurlijke producten zijn onder andere carnosine, alfa-liponzuur, taurine, vitamine C, benfotiamine en pyridoxamine -> productaanbeveling
- Polyfenolen, terpenoïden en polysacchariden
- Verminder ook de inname van geavanceerde glycatieweerstanden uit voedsel
- Stimuleer elastogenese (nieuwe medicijnen?)
- RAGE (receptor voor geavanceerde glycatieweerstanden) antagonisten [verschillende peptiden]
///








