Apprenez les techniques de supplémentation essentielles grâce à notre guide sur les trois principaux sénolytiques naturels qui peuvent rajeunir les cellules et améliorer la santé. Avec l'âge, la sénescence cellulaire - lorsque les cellules cessent de se diviser et s'accumulent dans l'organisme - peut entraîner diverses maladies liées à l'âge. Cependant, certains composés naturels ont été identifiés comme de puissants sénolytiques capables d'éliminer sélectivement ces cellules âgées. Cet article se penche sur les fondements scientifiques de ces substances remarquables et sur la manière de les intégrer dans les habitudes quotidiennes pour en tirer des bénéfices en termes de santé et de lutte contre l'âge.
Introduction
Le vieillissement est un processus biologique complexe caractérisé par un déclin progressif des fonctions physiologiques et une susceptibilité accrue aux maladies. Bien que le vieillissement ait longtemps été considéré comme un aspect inévitable de la vie, les récentes avancées dans le domaine de la recherche sur le vieillissement ont permis d'améliorer la qualité de vie des personnes âgées. biogérontologie ont mis en évidence les mécanismes cellulaires et moléculaires qui le sous-tendent. Parmi ces mécanismes, la sénescence cellulaire est apparue comme l'un des principaux facteurs contribuant aux pathologies liées à l'âge. Il s'agit d'un arrêt irréversible de la croissance déclenché par divers facteurs de stress.(1)
Le nombre de cellules sénescentes augmentant avec le vieillissement, on a supposé que la sénescence contribuait au vieillissement. La sénescence est nécessaire pour empêcher la distribution et la prolifération de cellules endommagées, déclenchant ainsi une réponse du système immunitaire. Ce point de contrôle cellulaire nécessite un système de substitution cellulaire efficace qui implique à la fois l'élimination des cellules sénescentes et la mobilisation des cellules progénitrices pour restaurer le nombre optimal de cellules.(2)
Les lésions de l'ADN nucléaire sont souvent considérées comme une cause sous-jacente de la sénescence, principalement sous la forme de cassures double-brin de l'ADN qui activent la voie de réponse aux lésions de l'ADN (DDR). L'activation prolongée de la DDR déclenche la sénescence. Un ou quelques télomères (extrémités des chromosomes) signalant la DDR suffisent à déclencher la sénescence cellulaire réplicative. L'activation des oncogènes est également un puissant déclencheur de sénescence.(3)
Les cellules sénescentes expriment des altérations substantielles de leur sécrétome, qui est particulièrement enrichi en cytokines pro-inflammatoires et en métalloprotéinases matricielles. C'est ce qu'on appelle le phénotype sécrétoire associé à la sénescence (SASP).. Les cellules sénescentes présentent des changements phénotypiques distincts, tels qu'une morphologie aplatie, une altération de l'expression des gènes et la sécrétion de molécules pro-inflammatoires. Alors que la sénescence sert initialement de mécanisme de suppression des tumeurs en stoppant la prolifération des cellules endommagées, l'accumulation de cellules sénescentes au fil du temps contribue au dysfonctionnement des tissus et favorise les maladies liées au vieillissement. (4)
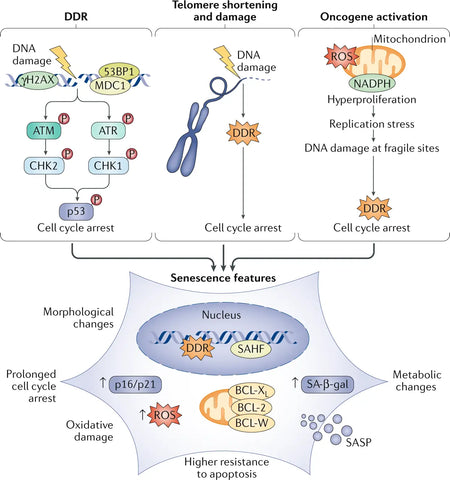
Image: Facteurs et phénotypes de la sénescence.
Source d'information: Di Micco, R., Krizhanovsky, V., Baker, D. et d'Adda di Fagagna, F. (2021). Sénescence cellulaire dans le vieillissement : des mécanismes aux opportunités thérapeutiques. Nature Reviews Molecular Cell Biology 22 (2): 75–95.
Compte tenu des effets néfastes des cellules sénescentes sur l'homéostasie tissulaire et l'espérance de vie, le ciblage de ces cellules est apparu comme une stratégie thérapeutique prometteuse. Les sénolytiques sont des composés conçus pour induire l'apoptose des cellules sénescentes tout en épargnant sélectivement les cellules saines. Ils ont le potentiel d'atténuer l'inflammation, d'améliorer la régénération des tissus et retarder l'apparition des pathologies liées à l'âge.(5)
Composés sénolytiques
De nombreux composés naturels et synthétiques ont été identifiés comme des composés sénolytiques potentiels. sénolytiquesLa quercétine (un composé naturel) et le dasatinib (un médicament synthétique) sont les premiers candidats de cette catégorie. Outre la quercétine et le dasatinib, plusieurs autres composés, dont la fisétine, le navitoclax et le ABT-263, ont montré des propriétés sénolytiques prometteuses dans des modèles précliniques. Cet article présente les trois principaux sénolytiques naturels potentiels et prometteurs disponibles aujourd'hui.
Fisétine
La fisétine est un flavonol bioactif (un polyphénol) très étudié pour son potentiel de promotion de la santé et de la longévité, principalement en atténuant la sénescence cellulaire. On la trouve principalement dans les fraises, les pommes, les kakis, les oignons, les raisins et, en petites quantités, dans les concombres (voir image). La fisétine possède une série d'activités biologiques attribuables à sa structure moléculaire unique (une structure planaire et plusieurs anneaux de carbone).(6-7)
Une première exploration des propriétés de la fisétine révèle sa puissante capacité antioxydante, qui découle de sa capacité à piéger les espèces réactives de l'oxygène (ROS). Elle joue donc un rôle crucial dans la défense cellulaire contre le stress oxydatif.(8)

Image de la fisétine: Sources alimentaires de fisétine.
Source de la fisétine: Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetin : a dietary antioxidant for health promotion (Fisétine : un antioxydant alimentaire pour la promotion de la santé). Antioxidants & Redox Signaling 19 (2): 151–162.
L'activité sénolytique de la fisétine est au cœur de la recherche sur la longévité. La sénescence cellulaire est un état dans lequel les cellules cessent de proliférer et s'accumulent au fil du temps - elle est impliquée dans diverses maladies liées à l'âge (voir plus loin pour plus de détails). On a constaté que la fisétine induit l'apoptose de ces cellules sénescentes de manière sélective. On suppose que cette élimination sélective atténue les phénotypes associés à la sénescence, contribuant ainsi à retarder ou à prévenir les pathologies liées à l'âge. Comparée à un autre composé sénolytique possible, la fisétine est environ deux fois plus puissante que la quercétine (voir plus loin dans l'article).(9-10)
L'activité prooxydante des flavonoïdes (comme la fisétine) est un élément important à prendre en compte lors de la recherche de sénolytiques. Les cellules sénescentes accumulent des niveaux élevés de cuivre et de fer. Le mécanisme sélectif de la quercétine ou de la fisétine est explicitement associé aux dommages oxydatifs favorisés par le cuivre et le fer dans les cellules sénescentes, tuant ainsi les cellules résistantes à l'apoptose.(11)
La fisétine affecte également des voies de signalisation cellulaires cruciales qui font partie intégrante du processus de vieillissement. Elle module la fonction des sirtuines (SIRT1 en particulier), de mTOR (inhibition) et de JAK-STAT/NF-κB, qui jouent un rôle crucial dans la régulation de la survie cellulaire, de l'apoptose et de l'autophagie. En modulant ces voies, la fisétine peut théoriquement améliorer la fonction cellulaire, réduire l'inflammation et maintenir l'homéostasie tissulaire.(12-14)
Il a également été démontré que la fisétine possède des propriétés neuroprotectrices. Elle atténue les dommages neuronaux et améliore les fonctions cognitives, principalement grâce à son action antioxydante et à la modulation des voies de signalisation neuronales.(15-16)
Malgré ces résultats précliniques prometteurs, il est essentiel de reconnaître que la plupart des recherches sur la fisétine se sont limitées à des modèles in vitro et animaux. La transposition de ces résultats à des applications cliniques chez l'homme nécessite des essais cliniques rigoureux pour vérifier l'efficacité, la sécurité et le dosage optimal de la fisétine. Heureusement, certaines études cliniques sont déjà en cours et nous devrions obtenir des résultats dans les prochaines années.(17-18)
Quercétine
La quercétine est un important antioxydant classé parmi les flavonols. Elle est naturellement présente dans de nombreux légumes, fruits, baies, feuilles et céréales. La quercétine se trouve principalement dans les câpres, les radis, l'aneth, la coriandre, le chou, l'oignon rouge, le brocoli et les baies telles que les canneberges et les airelles. La quercétine est l'un des flavonols les plus importants et les plus répandus dans la nature.

Les recherches montrent que la quercétine agit comme un agent antiviral, antimicrobien et anti-inflammatoire.(19) En outre, des études ont démontré les effets antihistaminiques de la quercétine, ce qui signifie qu'elle peut aider à traiter les allergies.(20-21) L'impact le plus important de la quercétine sur le corps humain est sa capacité à réduire l'inflammation silencieuse.(22)
Le potentiel de la quercétine à promouvoir la longévité peut être attribué à ses propriétés antioxydantes. En tant qu'antioxydant, la quercétine piège les radicaux libres, réduisant ainsi le stress oxydatif dans l'organisme. Des recherches ont indiqué que la quercétine peut activer les sirtuines (SIRT-1 en particulier), qui régulent les processus cellulaires tels que la réparation de l'ADN, l'expression des gènes et le métabolisme. L'activation des sirtuines est liée à l'augmentation de la durée de vie dans divers organismes.(23-24)
Il a également été démontré que la quercétine active la voie Nrf2 et, dans les noyaux cellulaires, elle active la transcription de divers gènes pilotés par l'élément de réponse antioxydant (ARE). Ces gènes augmentent l'expression d'enzymes cytoprotectrices, telles que la glutathion S-transférase, la NAD(P)H quinone déshydrogénase 1 et l'hème oxygénase-1.(25)
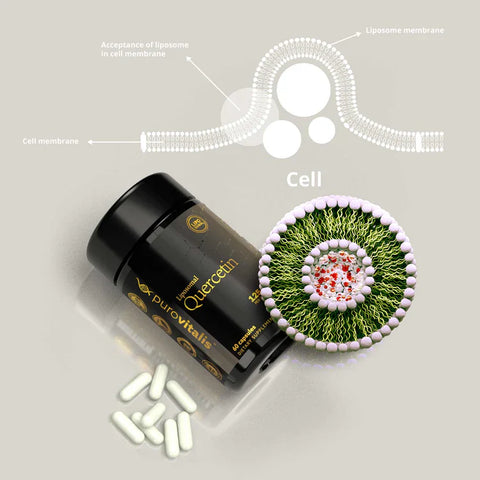
En général, les suppléments de quercétine sont pris à raison de 500 mg deux fois par jour. Toutefois, le dosage optimal de la quercétine n'a pas encore été déterminé. L'apport nutritionnel recommandé pour la quercétine est généralement de 5 à 40 mg par jour, mais elle peut également être consommée en quantités beaucoup plus importantes (> 500 mg).
En ce qui concerne la quercétine, nous recommandons la forme liposomale de Purovitalis.
Apigénine
L'apigénine (4′,5,7,-trihydroxyflavone) est un composé flavonoïde naturel présent dans diverses plantes, notamment le persil, le céleri et les agrumes. Elle est particulièrement abondante dans les fleurs de la camomille. L'apigénine pourrait contribuer à la prévention de maladies chroniques telles que le diabète, la maladie d'Alzheimer, la dépression, l'insomnie et le cancer, avec des bénéfices observés dans la recherche in vivo (études animales et humaines).(26)

L'un des aspects les plus prometteurs de l'apigénine est sa capacité à promouvoir la résilience cellulaire. Il a été démontré que l'apigénine active la voie Nrf2, qui joue un rôle crucial dans la défense de l'organisme contre le stress oxydatif et l'inflammation. En augmentant l'expression des enzymes antioxydantes telles que la superoxyde dismutase, la catalase et la glutathion peroxydase, l'apigénine contribue à protéger les cellules contre les dommages causés par les espèces réactives de l'oxygène (ROS).(27)
Outre ses propriétés antioxydantes, l'apigénine a démontré des effets anti-inflammatoires. On a constaté qu'elle inhibait la production de cytokines pro-inflammatoires, telles que TNF-α, IL-1β et IL-6, en modulant la voie de signalisation NF-κB.(28) L'apigénine a également été étudiée pour ses propriétés anticancéreuses potentielles. Des études ont montré que l'apigénine peut induire l'apoptose (mort cellulaire programmée) dans diverses lignées cellulaires cancéreuses, y compris les cellules cancéreuses du sein, de la prostate et du côlon. L'apigénine favorise également l'autophagie, contribuant ainsi à l'élimination des éléments cellulaires dysfonctionnels.(29-30)
L'apigénine a également été étudiée pour sa capacité à moduler les voies associées au vieillissement. L'une de ces voies est la voie de signalisation insuline/IGF-1 (IIS), connue pour jouer un rôle dans la régulation de la durée de vie chez diverses espèces. Il a été démontré que l'apigénine inhibe la voie IIS, imitant potentiellement les effets de la restriction calorique, une intervention bien établie pour promouvoir la longévité.(31-32) En outre, l'apigénine inhibe la NAD+ase CD38, qui est associée au syndrome métabolique, en augmentant les niveaux intracellulaires de NAD+ et en diminuant l'acétylation globale des protéines.(33) En ce qui concerne la sénescence, en particulier, l'apigénine inhibe la NAD+ase CD38, qui est associée au syndrome métabolique.pigénine contribue à empêcher les cellules sénescentes restantes de produire des SASP (phénotype sécrétoire associé à la sénescence ; voir plus haut) afin de favoriser la santé cellulaire et tissulaire.(34)
En ce qui concerne le dosage, il n'existe pas de dose universellement recommandée pour la supplémentation en apigénine. Cependant, des études ont utilisé des doses allant de 25 à 100 mg/kg de poids corporel dans des modèles animaux.(35) Les suppléments se situent généralement entre 50 et 500 mg par jour. Cependant, le dosage le plus efficace et le plus sûr n'a pas encore été établi de manière concluante. L'apigénine est généralement considérée comme sûre, mais des doses élevées peuvent interagir avec certains médicaments.
Conclusion
En conclusion de l'analyse du potentiel des sénolytiques naturels, il est évident que des composés tels que la fisétine, la quercétine et l'apigénine présentent des capacités sénolytiques significatives qui peuvent avoir un impact profond sur le processus de vieillissement. Ces substances ciblent et éliminent spécifiquement les cellules sénescentes, s'attaquant ainsi à un mécanisme fondamental du vieillissement et aux pathologies qui y sont liées. L'intégration de ces composés bioactifs dans le régime alimentaire - provenant de sources telles que les fraises, les oignons et la camomille - représente une approche stratégique pour améliorer la fonction cellulaire et atténuer l'accumulation des dommages cellulaires au fil du temps.
Toutefois, si les données précliniques sont prometteuses, la traduction de ces résultats en stratégies cliniques pratiques nécessite des recherches empiriques supplémentaires pour valider l'efficacité et la sécurité. Il est donc essentiel de poursuivre l'exploration de ces composés dans le cadre d'essais cliniques rigoureux.
Références scientifiques :
- Sikora, E., Arendt, T., Bennett, M. et Narita, M. (2011). Impact de la signature de la sénescence cellulaire sur la recherche sur le vieillissement. Examens de la recherche sur le vieillissement, 10(1), 146-152.
- He, S. et Sharpless, N. E. (2017). Senescence in health and disease. Cellule, 169(6), 1000-1011.
- Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Sénescence cellulaire dans le vieillissement : des mécanismes aux opportunités thérapeutiques. Nature Reviews Molecular Cell Biology 22 (2): 75–95.
- Kuilman, T. & Michaloglou, C. & Mooi, W. & Peeper, D. (2010). L'essence de la sénescence. Genes & Development 24 (22): 2463–2479.
- Kirkland, J. L. et Tchkonia, T. (2020). Médicaments sénolytiques : de la découverte à la traduction. Journal of internal medicine, 288(5), 518-536.
- Sengupta, B. & Banerjee, A. & Sengupta, P. (2005). Interactions of the plant flavonoid fisetin with macromolecular targets : insights from fluorescence spectroscopic studies (Interactions du flavonoïde végétal fisetin avec des cibles macromoléculaires : aperçu des études spectroscopiques de fluorescence). Journal of Photochemistry and Photobiology B : Biology (Journal de photochimie et de photobiologie B : biologie). 80 (2): 79–86.
- Bag, S. & Ghosal, S. & Karmakar, S. & Pramanik, G. & Bhowmik, S. (2023). Découverte du comportement de liaison contrasté des flavonoïdes végétaux Fisetin et Morin ayant des groupes hydroxyles subsidiaires (- OH) avec les structures d'ADN i-motif HRAS1 et HRAS2 : Décodage des altérations structurelles et des influences positionnelles. ACS Omega 8 (33): 30315–30329.
- Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetin : a dietary antioxidant for health promotion (Fisétine : un antioxydant alimentaire pour la promotion de la santé). Antioxidants & Redox Signaling 19 (2): 151–162.
- Yousefzadeh, M. et al. (2018). La fisétine est un sénothérapeutique qui prolonge la santé et la durée de vie. EBioMedicine 36: 18-28.
- Wyld, L. et al. (2020). Senescence and cancer : a review of clinical implications of senescence and senotherapies (sénescence et cancer : une revue des implications cliniques de la sénescence et des sénothérapies). Cancers 12 (8): 2134.
- Wang, Y. & He, Y. & Rayman, M. & Zhang, J. (2021). Mécanisme sélectif prospectif des agents sénolytiques émergents dérivés des flavonoïdes. Journal of Agricultural and Food Chemistry 69 (42): 12418–12423.
- Wiciński, M. et al. (2023). Natural Phytochemicals as SIRT Activators-Focus on Potential Biochemical Mechanisms. Nutrients 15 (16): 3578.
- Afroze, N. et al. (2022). Fisetin deters cell proliferation, induces apoptosis, alleviates oxidative stress and inflammation in human cancer cells, HeLa. International Journal of Molecular Sciences 23 (3): 1707.
- Roy, T. et al. (2023). Le double ciblage de mTOR/IL-17A et de l'autophagie par la fisétine atténue l'inflammation cutanée de type psoriasis. Frontiers in Immunology 13: 1075804.
- Samanta, S. et al. (2022). Les effets neuroprotecteurs de la fisétine, un flavonoïde naturel, dans les maladies neurodégénératives : Focus on the role of oxidative stress. Frontiers in Pharmacology 13: 1015835.
- Singh, S. & Singh, A. & Garg, G. & Rizvi, S. I. (2018). La fisétine en tant que mimétique de la restriction calorique protège le cerveau du rat contre le stress oxydatif induit par le vieillissement, l'apoptose et la neurodégénérescence. Sciences de la vie 193: 171–179.
- Verdoorn, B. et al. (2021). Fisetin for COVID-19 in skilled nursing facilities : Essais sénolytiques dans l'ère COVID. Journal of the American Geriatrics Society 69 (11): 3023–3033.
- Kirkland, J. (2024). Allégement par la fisétine de la fragilité, de l'inflammation et des mesures connexes chez les femmes âgées (AFFIRM). ClinicalTrials.gov ID : NCT03430037.
- Chirumbolo, S. (2010). Le rôle de la quercétine, des flavonols et des flavones dans la modulation de la fonction des cellules inflammatoires. Inflammation & Allergy-Drug Targets 9 (4): 263–285.
- Chirumbolo, S. (2011). La quercétine comme médicament anti-allergique potentiel : quelles perspectives ? Iran Journal of Allergy Asthma and Immunology (Journal iranien de l'allergie, de l'asthme et de l'immunologie) 10 (2): 139–140.
- Sagit, M. et al. (2017). Efficacité de la quercétine dans un modèle expérimental de rhinite allergique chez le rat. European Archives of Oto-Rhino-Laryngology (Archives européennes d'oto-rhino-laryngologie) 274 (8): 3087–3095.
- Li, Y. et al. (2016). Quercétine, inflammation et immunité. Nutriments 8 (3): 167.
- Costa, L. & Garrick, J. & Roquè, P. & Pellacani, C. (2016). Mécanismes de neuroprotection par la quercétine : Contrecarrer le stress oxydatif et plus encore. Médecine oxydative et longévité cellulaire 2016: 2986796.
- Cui, Z. et al (2022). Application thérapeutique de la quercétine dans les maladies liées au vieillissement : SIRT1 comme mécanisme potentiel. Frontiers in Immunology 13: 943321.
- Suraweera, T. & Rupasinghe, H. & Dellaire, G. & Xu, Z. (2020). Régulation de la voie Nrf2/ARE par les flavonoïdes alimentaires : Un ami ou un ennemi pour la gestion du cancer ? Antioxidants 9: 973.
- Salehi, B. et al. (2019). Le potentiel thérapeutique de l'apigénine. International Journal of Molecular Sciences 20 (6): 1305.
- Paredes-Gonzalez, X. et al. (2015). Induction de l'expression génique médiée par NRF2 par les flavones phytochimiques alimentaires apigénine et lutéoline. Biopharmaceutique & Disposition des médicaments 36 (7): 440–451.
- Ginwala, R. & Bhavsar, R. & Chigbu, D. & Jain, P. & Khan, Z. (2019). Rôle potentiel des flavonoïdes dans le traitement des maladies inflammatoires chroniques avec un accent particulier sur l'activité anti-inflammatoire de l'apigénine. Antioxydants 8 (2): 35.
- Shukla, S. et Gupta, S. (2010). Apigenin : a promising molecule for cancer prevention (Apigénine : une molécule prometteuse pour la prévention du cancer). Pharmaceutical Research 27: 962–978.
- Sung, B. & Chung, H. & Kim, N. (2016). Rôle de l'apigénine dans la prévention du cancer via l'induction de l'apoptose et de l'autophagie. Journal of Cancer Prevention 21 (4) : 216-226.
- Pan, H. et Finkel, T. (2017). Protéines et voies clés qui régulent la durée de vie. Journal of Biological Chemistry 292 (16): 6452–6460.
- Shukla, S. & Gupta, S. (2009). L'apigénine supprime la signalisation du récepteur du facteur de croissance I analogue à l'insuline dans le cancer de la prostate humain : Une étude in vitro et in vivo. Molecular Carcinogenesis 48 (3): 243–252.
- Escande, C. et al. (2013). Le flavonoïde apigénine est un inhibiteur de l'ase NAD+ CD38 : implications pour le métabolisme cellulaire du NAD+, l'acétylation des protéines et le traitement du syndrome métabolique. Diabetes 62 (4): 1084–1093.
- Lim, H. & Park, H. & Kim, H. (2015). Effets des flavonoïdes sur la formation du phénotype sécrétoire associé à la sénescence induite par la bléomycine dans les fibroblastes BJ. Pharmacologie biochimique 96 (4): 337–348.
- Salehi, B. et al. (2019). Le potentiel thérapeutique de l'apigénine. International Journal of Molecular Sciences 20 (6): 1305.