Mitochondries sont des organites vitaux situés dans le cytoplasme des cellules eucaryotes. Le bon fonctionnement des mitochondries permet d'améliorer tous les processus de l'organisme, du mouvement et de l'exercice à la digestion et à la récupération. Elles jouent un rôle essentiel dans la production d'énergie et dans de nombreux autres processus cellulaires. Les mitochondries sont le siège de la phosphorylation oxydative, qui produit l'ATP, la principale source d'énergie de la cellule. Sur le plan structurel, les mitochondries peuvent être évaluées par une membrane externe et une membrane interne très repliée qui forme les compartiments nécessaires à leur métabolisme. Outre la production d'énergie, les mitochondries exercent d'autres activités telles que la signalisation calcique et la régulation du métabolisme cellulaire, ainsi que l'apoptose (mort programmée), ce qui les rend vitales pour le maintien de l'homéostasie cellulaire.
Les fondements de la fonction mitochondriale
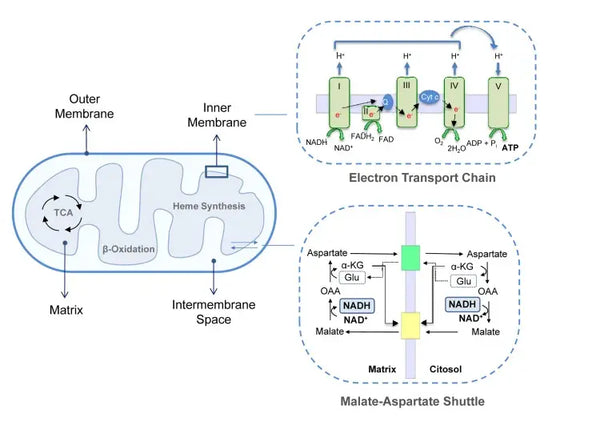
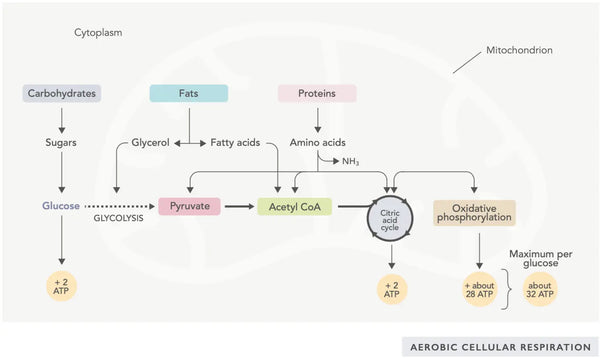
La production d'ATP (la principale molécule d'énergie utilisée par les cellules) est la caractéristique fondamentale de l'activité mitochondriale. Ce processus passe par deux voies biochimiques principales : le cycle de l'acide citrique (cycle TCA ou cycle de Krebs) et la chaîne de transport des électrons (ETC).
Cycle de l'acide citrique
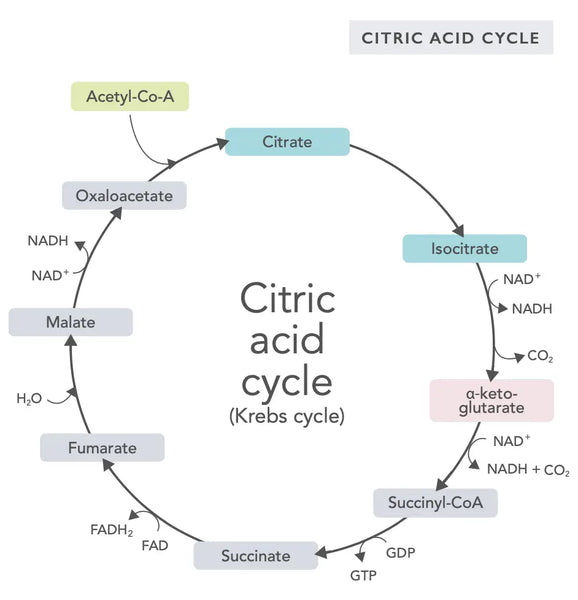
Le cycle de l'acide citrique, ou cycle de Krebs (nommé d'après le prix Nobel Hans Adolf Krebs, qui l'a découvert), se produit dans les mitochondries des cellules.(1)Le principal composé métabolique du cycle de l'acide citrique est l'acide acétique (acétyl-coenzyme A) produit à partir d'acides gras, d'hydrates de carbone et de protéines.(2)
Les différentes réactions du cycle de l'acide citrique (voir image) forment des ions hydrogène et des électrons qui sont ensuite transférés vers la membrane mitochondriale interne pour la phosphorylation oxydative (liaison de l'énergie aux molécules d'ATP par oxydation) et la chaîne de transport d'électrons. La réaction libère du NADH et de petites quantités de ATP et de dioxyde de carbone.
Le cycle de l'acide citrique comporte dix étapes, chacune influencée par les vitamines B, certains minéraux tels que le magnésium et le fer, et le principal antioxydant du foie, le glutathion. Les réactions sont inhibées par les métaux lourds tels que le mercure, l'arsenic et l'aluminium.
Les molécules de NADH, riches en énergie, captent la majeure partie de l'énergie générée au cours du cycle de l'acide citrique. Pour chaque molécule d'acétyl coenzyme A, trois molécules de NADH sont générées et utilisées comme énergie dans la réaction suivante (phosphorylation oxydative).
La régulation du cycle de l'acide citrique est déterminée par la disponibilité de divers acides aminés et par la rétro-inhibition (par exemple, si trop de NADH est produit, plusieurs enzymes du cycle de l'acide citrique sont inhibées, ce qui ralentit les réactions).
Oxaloacétate est un composé qui répond à un besoin soudain de produire de l'énergie (par exemple, dans le cerveau ou les muscles). La prise d'un supplément d'oxaloacétate peut être utile et peut même stimuler la régénération des mitochondries dans le cerveau, réduire l'inflammation silencieuse dans le corps et augmenter le nombre de cellules nerveuses.(3)
En clair, l'organisme intègre des systèmes ingénieux qui transforment les aliments consommés en électrons, utilisés comme énergie pour divers besoins.
Phosphorylation oxydative
La phosphorylation oxydative se compose de la chaîne de transport d'électrons et de l'ATP synthase. La phosphorylation oxydative produit la plus grande partie de l'énergie générée en aérobie (ATP). Elle est la continuation du cycle de l'acide citrique.
Dans la chaîne de transport d'électrons, les ions hydrogène (H+) sont libérés dans l'espace intermembranaire mitochondrial. Les ions hydrogène libérés de l'espace intermembranaire retournent dans la mitochondrie par l'intermédiaire de l'ATP synthase. En utilisant l'énergie libérée au cours du processus, l'ATP synthase convertit l'ADP utilisé pour l'énergie en ATP.
L'ubiquinone (coenzyme Q10) contribue à la chaîne de transport des électrons. Elle est utilisée depuis des décennies comme complément alimentaire. Un faible taux d'ubiquinone cellulaire peut être un facteur prédisposant à diverses maladies en raison d'une production insuffisante d'énergie aérobie dans les cellules. En outre, l'utilisation de médicaments contre le cholestérol (statines) est un facteur contribuant à la carence en ubiquinone.(4)
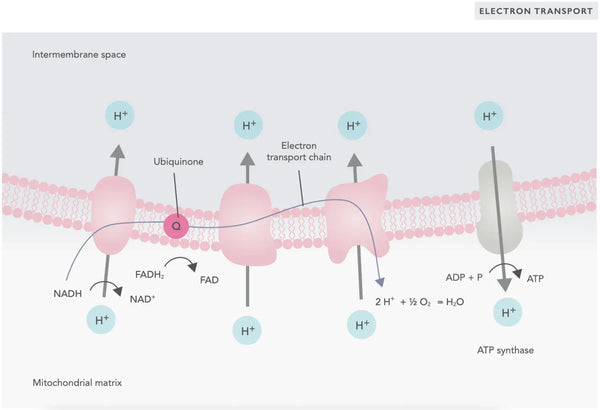
Cet ensemble coordonné de réactions génère de l'ATP et établit un gradient de protons à travers la membrane mitochondriale interne, un processus connu sous le nom de chimiosmose. L'énergie stockée dans ce gradient alimente la synthèse de l'ATP, reliant le flux d'électrons à travers l'ETC à la production d'énergie cellulaire.(5)
Facteurs influençant l'efficacité des mitochondries
L'efficacité mitochondriale, qui est évidemment vitale pour une fonction cellulaire optimale, est influencée par divers facteurs. Les plus importants sont décrits ci-dessous.
Composition génétique
Les mitochondries possèdent un ADN distinct et individuel (ADN mitochondrial, ADNmt), différent de l'ADN nucléaire. L'ADNmt code pour des composants essentiels de la chaîne de transport d'électrons et des protéines mitochondriales. Les mutations de l'ADNmt peuvent entraîner un dysfonctionnement des protéines, perturbant la chaîne de transport des électrons et la synthèse de l'ATP. Il peut en résulter une réduction de la production d'énergie et une augmentation de la production d'espèces réactives de l'oxygène (ROS), ce qui contribue au dysfonctionnement mitochondrial et cellulaire.(6)
Stress oxydatif
Les mitochondries sont une source importante de ROS, qui sont des sous-produits du métabolisme de l'oxygène. Alors que de faibles niveaux de ROS fonctionnent dans la signalisation cellulaire, des ROS excessifs peuvent causer des dommages oxydatifs aux protéines, aux lipides et à l'ADN des mitochondries. Ce stress oxydatif compromet l'intégrité et la fonction des mitochondries, inhibant la production d'ATP et entraînant une nouvelle production de ROS dans un cycle délétère. Les défenses antioxydantes, notamment la superoxyde dismutase et la glutathion peroxydase, jouent un rôle essentiel dans l'atténuation de ces dommages.(7-8)
Disponibilité des nutriments
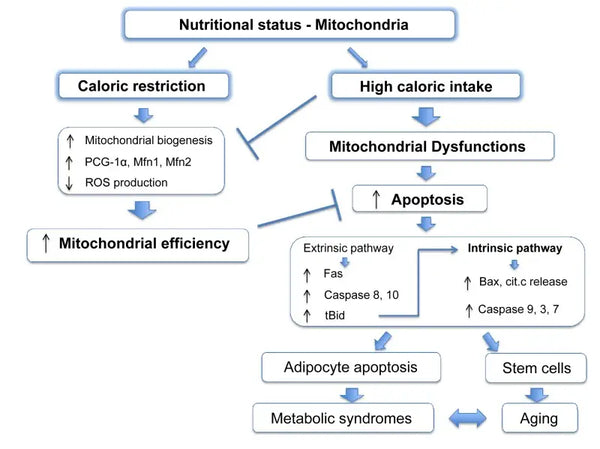
Les mitochondries ont besoin de substrats spécifiques pour produire de l'énergie. Le glucose et les acides gras sont les principales sources de génération d'ATP via la glycolyse et la β-oxydation, respectivement. La disponibilité de ces substrats a un impact direct sur la fonction mitochondriale. Par exemple, dans des conditions de surplus de nutriments, telles qu'une forte disponibilité de glucose, les mitochondries peuvent produire des quantités excessives d'ATP et de ROS, ce qui peut entraîner des perturbations métaboliques.(9-10)
Inversement, la pénurie de nutriments peut limiter la production d'énergie mitochondriale, ce qui affecte la fonction et la survie des cellules. Contrairement à certains rapports d'études animales sur les avantages de la restriction calorique sur la biogenèse mitochondriale, il semble qu'elle n'augmente pas la biogenèse mitochondriale. En revanche, elle préserve la fonction mitochondriale en protégeant l'intégrité et la fonction des composants cellulaires existants.(11-12)
Facteurs liés au mode de vie
L'exercice physique
L'activité physique influence la quantité et la qualité des mitochondries. L'exercice stimule la biogenèse mitochondriale, ce qui entraîne une augmentation de la densité mitochondriale et de l'efficacité de la production d'énergie.(13) L'entraînement d'endurance en particulier renforce la capacité oxydative des mitochondries, améliorant leur capacité à utiliser l'oxygène pour la production d'ATP (voir plus de détails dans la suite de l'article).
Alimentation
Les composants du régime alimentaire influencent considérablement la fonction mitochondriale. Les ratios de macronutriments, l'apport calorique et les nutriments spécifiques (comme les antioxydants, les vitamines et les minéraux) influencent le métabolisme des mitochondries. Les régimes riches en nutriments qui soutiennent la fonction mitochondriale peuvent améliorer la production d'énergie et réduire le stress oxydatif (voir plus loin). Activation cétose peut également augmenter la biogenèse mitochondriale et améliorer l'efficacité des mitochondries.(14-15)
Facteurs environnementaux
L'exposition à des facteurs de stress environnementaux, tels que les toxines, les polluants, les métaux lourds (plomb, mercure, arsenic et cadmium, par exemple) et les radiations, peut avoir des effets néfastes sur la fonction mitochondriale. Ces facteurs de stress peuvent induire des dommages oxydatifs, perturber l'activité de la chaîne de transport d'électrons et altérer la dynamique mitochondriale, y compris les processus de fusion et de fission.(16)
Interventions technologiques
Photobiomodulation (ou thérapie par la lumière rouge)
Photobiomodulation est l'utilisation de l'énergie photonique non ionisante pour déclencher des changements photochimiques dans les structures cellulaires réceptives aux photons, en particulier dans les mitochondries. On pense que la lumière rouge et la thérapie par la lumière infrarouge agissent principalement par l'intermédiaire de photo-accepteurs. Les ondes de lumière rouge pénètrent la peau et atteignent les mitochondries de la cellule, augmentant ainsi la production d'énergie de la cellule. Divers événements y contribuent, par exemple l'accélération de la respiration mitochondriale par l'intermédiaire de la cytochrome c oxydase.(17) Pour en savoir plus sur les avantages de la photobiomodulation pour la santé, cliquez ici.
Sauna infrarouge
Les saunas infrarouges utilisent le rayonnement infrarouge, qui chauffe directement les tissus corporels au lieu de l'air. La fréquence du rayonnement émis par les saunas infrarouges est de 3 à 12 μm, ce qui correspond à l'infrarouge lointain (FIR). On a constaté que la lumière infrarouge lointaine avait des effets au niveau des tissus, en particulier sur la chaîne respiratoire des mitochondries dans le processus de production d'énergie cellulaire et sur l'approvisionnement en sang des tissus en dilatant les vaisseaux sanguins et en améliorant la circulation.(18)
Thérapie par champ électromagnétique pulsé (CEMP)
La thérapie PEMF utilise des champs électromagnétiques pour favoriser divers processus physiologiques. La recherche suggère que le CEMP peut améliorer la fonction mitochondriale en augmentant la consommation d'oxygène cellulaire et en améliorant la production d'ATP. La thérapie PEMF affecte directement les mitochondries, ramenant les cellules à un état d'énergie et de charge électrique plus sain.(19-20) Lisez le guide complet sur la thérapie PEMF ici.
Oxygénothérapie hyperbare (OHB)
L'OHB consiste à respirer de l'oxygène pur dans un environnement pressurisé. Il a été cliniquement prouvé que l'oxygénothérapie hyperbare revitalise les mitochondries et augmente la formation d'ATP en fournissant des quantités supraphysiologiques d'oxygène nécessaires à la respiration cellulaire. Une étude récente a montré que l'oxygénothérapie hyperbare augmentait la biogenèse des mitochondries et l'autophagie en augmentant partiellement la production d'espèces réactives de l'oxygène. Ce processus produit de nouvelles mitochondries saines et détruit les anciennes mitochondries dysfonctionnelles. Cette étude a également révélé une activation accrue de la transcription et de la réplication de l'ADN des mitochondries.(21-22) Pour en savoir plus sur l'OHB, cliquez ici.
Soutien nutritionnel et complémentaire pour la fonction mitochondriale
Le rôle de la nutrition dans le maintien de la santé mitochondriale est essentiel, certains nutriments étant particulièrement cruciaux pour une fonction mitochondriale optimale. Il s'agit notamment des éléments suivants.
- Coenzyme Q10 (CoQ10) : L'ubiquinone est liposoluble et ressemble à une vitamine. L'ubiquinone fonctionne comme un transporteur d'électrons dans la chaîne de transfert d'électrons dans les mitochondries (voir figure de droite) et favorise la sécrétion d'ATP. Les niveaux d'ubiquinone diminuent dans divers tissus avec le vieillissement.(23)
- Le magnésium: Impliqué dans la synthèse de l'ATP et crucial pour le maintien de l'intégrité et de la fonction des mitochondries.(24)
- Vitamines B : Dont B1 (thiamine), B2 (riboflavine), B3 (niacine), B5 (acide pantothénique), B6, B7 (biotine) et B12. Ces vitamines B sont cruciales pour divers aspects du métabolisme énergétique mitochondrial.(25)
- Acide alpha-lipoïque : L'ALA est un puissant antioxydant qui contribue également à régénérer d'autres antioxydants. Il joue un rôle dans le métabolisme énergétique et peut améliorer la fonction mitochondriale.(26)
- Carnitine (spécifiquement Acetyl-L-Carnitine) : Transporte les acides gras dans les mitochondries pour la bêta-oxydation, qui est cruciale pour la production d'énergie, en particulier dans les cellules musculaires.(27)
- Créatine : La créatine est un composé naturel de l'organisme qui contribue à fournir de l'énergie aux cellules, en particulier aux cellules musculaires, en augmentant la formation d'adénosine triphosphate (ATP). La supplémentation en créatine peut améliorer l'efficacité des mitochondries, en particulier lors d'exercices de haute intensité.(28)
- Pyrroloquinoline Quinone (PQQ) : La PQQ est un antioxydant qui augmente la biogenèse mitochondriale par le biais de la teneur en protéines PGC-1 et soutient la fonction mitochondriale.(29)
- Acides gras oméga-3 (EPA et DHA) : Les oméga-3 sont essentiels au maintien de la fluidité et de la fonction de la membrane mitochondriale. On les trouve principalement dans l'huile de poisson et les poissons gras.(30)
- Riboside de nicotinamide (NR) et mononucléotide de nicotinamide (NMN): Ces précurseurs du NAD+ sont essentiels à la fonction mitochondriale et à la production d'énergie. Une supplémentation en NR ou en NMN peut contribuer à augmenter les niveaux de NAD+ et donc à améliorer l'efficacité des mitochondries.(31) Pour en savoir plus sur l'optimisation du NAD+, cliquez ici.
- La curcumine : La curcumine est le composé actif du curcuma. Il a été démontré qu'elle protège les mitochondries des dommages oxydatifs et améliore leur fonctionnement.(32)
- Sélénium : Un oligo-élément essentiel qui joue un rôle dans la protection des mitochondries contre le stress oxydatif. Le sélénium augmente également la biogenèse des mitochondries.(33)
Exercice et biogenèse mitochondriale
L'activité physique régulière est un facteur essentiel pour favoriser la biogenèse mitochondriale, qui conduit à la création de nouvelles mitochondries, augmentant ainsi leur quantité et leur capacité fonctionnelle dans les cellules. Les différentes formes d'exercice exercent des effets distincts sur la dynamique des mitochondries. Les deux formes d'exercice les plus importantes sont l'entraînement aérobie et l'entraînement en résistance.
Exercice aérobie
La densité des mitochondries dans les cellules musculaires squelettiques augmente sensiblement au cours d'un exercice aérobie (course à pied, cyclisme et natation).
La biogenèse des mitochondries est régulée par le PGC-1α (coactivateur du récepteur gamma activé par les proliférateurs de peroxysomes 1-alpha), une protéine régulatrice essentielle, dont l'expression est stimulée par l'exercice aérobique. Le PGC-1α coactive les facteurs respiratoires nucléaires (NRF) et le facteur de transcription mitochondrial A (TFAM), qui sont nécessaires à la transcription de l'ADNmt et à la réplication des mitochondries. Il en résulte une efficacité accrue de la phosphorylation oxydative, une meilleure endurance et une plus grande génération d'ATP dans les cellules musculaires.(34)
L'entraînement par intervalles de haute intensité (HIIT) est particulièrement efficace. particulièrement efficace pour augmenter le nombre de mitochondries et l'absorption maximale d'oxygène (VO2max).(35-36)
Entraînement en résistance
La fonction et l'efficacité mitochondriales sont les principales cibles de l'entraînement en résistance (par exemple, l'haltérophilie et les exercices au poids du corps). Il déclenche des changements dans la synthèse des protéines mitochondriales, améliorant ainsi la qualité et l'efficacité des mitochondries présentes. La musculation augmente également la production d'enzymes dans les chaînes de transport d'électrons et le cycle de Krebs, ce qui améliore encore la capacité des cellules à synthétiser l'ATP. Il peut également augmenter le nombre et la taille des mitochondries dans les cellules musculaires, mais pas autant que l'exercice aérobie.(37-38)
L'effet combiné de ces modalités d'exercice sur la biogenèse et la fonction mitochondriales souligne l'importance de l'activité physique dans le maintien et l'amélioration de la santé mitochondriale. Un entraînement régulier en aérobic et en résistance améliore globalement la densité, l'efficacité et le métabolisme énergétique des mitochondries. Ces adaptations sont cruciales pour les performances athlétiques et sont importantes pour le maintien de la santé, la prévention des maladies et la gestion des conditions associées au dysfonctionnement mitochondrial.
Il convient toutefois de noter que l'entraînement simultané de la force et de l'endurance entraîne une adaptation moindre, car les protéines kinases PKB et AMPK bloquent l'une et l'autre la signalisation en aval, ce qui entrave l'effet de l'entraînement simultané.(39)
Mitophagie et santé cellulaire
La mitophagie est un type sélectif d'autophagie qui joue un rôle essentiel dans les conditions cellulaires en étant capable de dégrader uniquement les mitochondries endommagées ou non fonctionnelles. Ce mécanisme est crucial pour la santé des mitochondries et de la cellule, car il empêche les ARNm qui codent pour des sous-unités défectueuses de s'accumuler, évitant ainsi d'autres crises dans les fonctions cellulaires et de nombreuses pathologies.(40)
L'élimination des mitochondries endommagées par la mitophagie contribue à réduire le stress oxydatif, l'apoptose et l'inflammation (associés à diverses pathologies). Une mitophagie déficiente facilite l'accumulation de mitochondries dysfonctionnelles dans la pathogenèse des troubles neurodégénératifs tels que la maladie de Parkinson et la maladie d'Alzheimer. De même, dans les troubles métaboliques, la perte de mitophagie entraîne des modifications du métabolisme mitochondrial, ce qui se traduit par une résistance à l'insuline et un diabète de type 2.(41-42)
Il a été démontré que la restriction calorique favorise la mitophagie. Cela est dû en partie à l'activation des sirtuines (SIRT1), de la protéine kinase activée par l'AMP (AMPK) et du facteur de transcription EB qui soutiennent à la fois la réponse à la crise énergétique cellulaire et l'initiation de la mitophagie. Plus précisément, les sirtuines régulent la fonction des facteurs de la machinerie de mitophagie, en réduisant au silence les mitochondries endommagées.(43)
Les effets moléculaires de la restriction calorique sont imités par des composés tels que le resvératrol (un polyphénol présent dans le vin rouge et certaines baies) et de nombreux autres polyphénols. Le resvératrol favorise l'activation de SIRT1 et de l'AMPK, augmentant ainsi la mitophagie responsable de l'amélioration de la fonction des mitochondries et de la restauration de la santé cellulaire.(44-45)
La mitophagie peut être améliorée par le jeûne intermittent. Cette amélioration est probablement atténuée par le passage métabolique d'une énergie basée sur le glucose à une énergie basée sur la cétone pendant le jeûne, et ce passage déclenche la mitophagie.(46-47)
Dysfonctionnement mitochondrial en tant que caractéristique du vieillissement
Comprendre comment les mitochondries contribuent au processus de vieillissement est au cœur de la recherche en gérontologie et en biologie cellulaire. Au fur et à mesure que les organismes vieillissent, le dysfonctionnement mitochondrial devient plus courant, ce qui joue un rôle dans l'aspect physiologique du vieillissement.
Les mitochondries vieillissantes produisent moins d'ATP, ce qui affecte les processus énergétiques nécessaires au bien-être cellulaire. De plus, les changements structurels des mitochondries associés à l'âge interfèrent encore plus avec cette diminution de la production énergétique, comme la composition anormale du potentiel de la membrane mitochondriale et l'intégrité de la paroi interne de la mitochondrie.(48)
La position des ADN mitochondrial (ADNmt) près de la chaîne de transport d'électrons, où se produisent les espèces réactives de l'oxygène, influe sur sa vulnérabilité aux mutations. Cependant, les mutations s'accumulent avec le temps, entraînant un dysfonctionnement mitochondrial. Contrairement à l'ADN nucléaire, qui est lié aux histones pour le protéger et qui dispose de divers mécanismes de réparation, l'ADNmt n'est pas protégé par les histones et ne dispose pas d'un large éventail de méthodes de réparation, de sorte qu'il peut facilement être endommagé.(49)
Dans les cellules, les mitochondries produisent des espèces réactives de l'oxygène (ROS). Bien que les ROS constituent un moyen essentiel pour la cellule de communiquer avec son environnement et de s'y adapter, la production de niveaux élevés de ces molécules est limitée par un contrôle rigoureux. Une production excessive dans diverses conditions liées à l'âge entraîne un stress oxydatif dans les cellules. Celui-ci détruit différents composants cellulaires, qu'il s'agisse de protéines, de lipides ou d'ADN. Les mitochondries sont même les premiers destinataires des dommages oxydatifs, créant un cercle vicieux puisque les mitochondries endommagées ne font que générer plus de ROS, augmentant ainsi le stress oxydatif cellulaire. sénescence cellulaire.(50-52)
La dynamique mitochondriale est cruciale pour la fonction mitochondriale qui aide à maintenir le processus de fusion et de fission. Cependant, cette dynamique est perturbée avec le vieillissement et les mitochondries subissent une fragmentation au lieu d'une fusion. Ces changements affectent la fonction des mitochondries et leur position dans les cellules.(53)
La perte de la fonction mitochondriale n'est pas un phénomène passif lié au vieillissement, mais un participant actif à la pathogenèse des maladies liées à l'âge. Le dysfonctionnement mitochondrial a été associé à des pathologies telles que les maladies neurodégénératives, les maladies cardiovasculaires et les troubles métaboliques. Dans ces pathologies, une production d'énergie réduite ou défectueuse, un stress oxydatif accru et l'incapacité d'éliminer les mitochondries endommagées jouent un rôle essentiel dans la pathogenèse et l'évolution de la maladie.(54)
Conclusion
L'optimisation de la santé mitochondriale et de son déclin avec le vieillissement est une tâche difficile, mais heureusement, il y a beaucoup à faire. Les principales interventions impliquent un soutien nutritionnel des substrats essentiels à la régénération, notamment la coenzyme Q10, le magnésium et les vitamines B ; la participation régulière à diverses disciplines d'exercice pour augmenter la biogenèse mitochondriale ; et des modifications du mode de vie telles que la restriction calorique ou le jeûne intermittent pour influencer les mécanismes de mitophagie.
Le dysfonctionnement mitochondrial étant reconnu comme l'un des facteurs du vieillissement, ces stratégies sont essentielles pour soutenir la santé cellulaire et lutter contre la dégradation liée à l'âge. Les approches intégratives utilisant la puissance des connaissances scientifiques en combinaison avec des changements de mode de vie applicables peuvent créer des conditions favorables à la prévention et au ralentissement de l'usure mitochondriale, ce qui contribue globalement au bien-être et à la longévité de l'individu.
Références scientifiques
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900-81), pionnier de la médecine moderne, architecte du métabolisme intermédiaire. Journal of Medical Biography 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biochimie. 5e édition. Chapitre 17, Le cycle de l'acide citrique. New York : W. H. Freeman.
- Wilkins, H. et al. (2014). L'oxaloacétate active la biogenèse mitochondriale du cerveau, améliore la voie de l'insuline, réduit l'inflammation et stimule la neurogenèse. Génétique moléculaire humaine 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Déficience primaire et secondaire en coenzyme Q10 : le rôle de la supplémentation thérapeutique. Nutrition Reviews 71 (3): 180–188. Review.
- Saraste, M. (1999). La phosphorylation oxydative à la fin du siècle. Science 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Les ARNt mitochondriaux humains : biogenèse, fonction, aspects structurels et maladies. Revue annuelle de génétique 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Les mitochondries sont-elles le principal contributeur d'espèces réactives de l'oxygène dans les cellules ? Journal of Experimental Biology 224 (5) : jeb221606.
- Thannickal, V. et Fanburg, B. (2000). Reactive oxygen species in cell signaling (Espèces réactives de l'oxygène dans la signalisation cellulaire). American Journal of Physiology-Lung Cellular and Molecular Physiology (Journal américain de physiologie - Physiologie cellulaire et moléculaire du poumon). 279 (6) : L1005-L1028.
- Marín-García, J. et Marín-García, J. (2013). Mécanismes de production de bioénergie dans les mitochondries. Les mitochondries et leur rôle dans les maladies cardiovasculaires. 99–121.
- Bottje, W. (2019). Métabolisme oxydatif et efficacité : l'équilibre délicat des mitochondries. Science de la volaille 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Nutrient availability links mitochondria, apoptosis, and obesity (La disponibilité des nutriments relie les mitochondries, l'apoptose et l'obésité). Aging (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). La restriction calorique chronique préserve la fonction mitochondriale dans la sénescence sans augmenter la biogenèse mitochondriale. Métabolisme cellulaire 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Mécanismes moléculaires de l'adaptation mitochondriale à l'entraînement à l'exercice dans le muscle squelettique. The FASEB Journal 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Régulation de la biogenèse mitochondriale. Essais en biochimie 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Thérapie métabolique à base de cétone : l'augmentation du NAD+ est-elle un mécanisme primaire ? Frontiers in Molecular Neuroscience 10: 377.
- Fowler, B. (1978). Effets subcellulaires généraux du plomb, du mercure, du cadmium et de l'arsenic. Environmental Health Perspectives 22:37-41.
- Hamblin, M. (2018). Mécanismes et signalisation redox mitochondriale dans la photobiomodulation. Photochimie et photobiologie 94 (2): 199–212.
- Vatansever, F. et Hamblin, M. (2012). Le rayonnement infrarouge lointain (FIR) : ses effets biologiques et ses applications médicales. Photonique et lasers en médecine 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). La stimulation électromagnétique augmente la fonction mitochondriale dans les cellules ostéogéniques et favorise la réparation des fractures osseuses. Scientific Reports 11 (1): 19114.
- Tai, Y. et al. (2020). Les champs magnétiques modulent le métabolisme et le microbiome intestinal en corrélation avec l'expression dePgc-1 alpha : Follow-up to an in vitro magnetic mitohormetic study. The FASEB Journal 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). L'effet de l'oxygène hyperbare sur le métabolisme énergétique mitochondrial et glycolytique : le concept de caloristase. Stress cellulaire et chaperons 25 (4): 667-677.
- Chen, W. et al. (2020). L'oxygène hyperbare protège contre la lésion myocardique d'ischémie-reperfusion en inhibant le dysfonctionnement des mitochondries et l'autophagie. Rapports de médecine moléculaire 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). La complexité de la fabrication de l'ubiquinone. Trends in Endocrinology & Metabolism (Tendances en endocrinologie et métabolisme) 30 (12): 929-943.
- Volpe, S. (2013). Le magnésium dans la prévention des maladies et la santé globale. Advances in Nutrition 4 (3) : 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O'Brien, P. (2006). Fonction mitochondriale et toxicité : rôle de la famille des vitamines B sur le métabolisme énergétique mitochondrial. Interactions chimico-biologiques 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Métabolisme de l'acide lipoïque et régulation redox mitochondriale. Journal of Biological Chemistry 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Carnitine in human muscle bioenergetics : can carnitine supplementation improve physical exercise ? Molecules 25 (1): 182.
- Wax, B. et al. (2021). Créatine pour l'exercice et la performance sportive, avec des considérations de récupération pour les populations en bonne santé. Nutriments 13 (6): 1915.
- Hwang, P. et al. (2020). Effets de la supplémentation en pyrroloquinoline quinone (PQQ) sur la performance de l'exercice aérobie et les indices de la biogenèse mitochondriale chez les hommes non entraînés. Journal of the American College of Nutrition 39 (6): 547-556.
- Jeromson, S. et Hunter, D. (2014). Influencer la composition de la membrane mitochondriale et la bioénergétique par la supplémentation en oméga-3. The Journal of Physiology 592 (Pt 9) : 1913-1914.
- Elhassan, Y. et al. (2019). Nicotinamide riboside augmente le métabolome NAD+ du muscle squelettique humain âgé et induit des signatures transcriptomiques et anti-inflammatoires. Cell Reports 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Curcumine, biogenèse mitochondriale et mitophagie : exploration des données récentes et indication des besoins futurs. Avancées en biotechnologie 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Le sélénium, un micronutriment qui module la santé cardiovasculaire via l'enzymologie redox. Nutriments 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Régulation de PGC-1α, un régulateur nodal de la biogenèse mitochondriale. The American Journal of Clinical Nutrition 93 (4) : 884S-890S.
- Helgerud, J. et al. (2007). Aerobic high-intensity intervals improve VO2max more than moderate training. Medicine and Science in Sports and Exercise 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Similar metabolic adaptations during exercise after low volume sprint interval and traditional endurance training in humans. Journal of Physiology 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Differential effects of resistance and endurance exercise in the fed state on signalling molecule phosphorylation and protein synthesis in human muscle. The Journal of Physiology 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Resistance exercise training alters mitochondrial function in human skeletal muscle. Medicine and Science in Sports and Exercise (Médecine et science du sport et de l'exercice) 47 (9): 1922-1931.
- Baar, K. (2006). Training for endurance and strength : lessons from cell signaling (Entraînement à l'endurance et à la force : leçons tirées de la signalisation cellulaire). Médecine et science du sport et de l'exercice 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Les voies de la mitophagie pour le contrôle de la qualité et l'élimination des mitochondries. Mort cellulaire et différenciation 20 (1): 31-42.
- Green, D., Galluzzi, L. et Kroemer, G. (2011). Les mitochondries et l'axe autophagie-inflammation-mort cellulaire dans le vieillissement de l'organisme. Science 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitophagy : A promising therapeutic target for neuroprotection during ageing and age-related diseases (Mitophagie : une cible thérapeutique prometteuse pour la neuroprotection au cours du vieillissement et des maladies liées à l'âge). British Journal of Pharmacology 180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Restriction calorique : l'AMPK est-elle un capteur et un effecteur clé ? Physiology 26 (4): 214-224.
- Um, J. et al. (2010). Les souris déficientes en AMP-activated protein kinase sont résistantes aux effets métaboliques du resvératrol. Diabète 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Les propriétés antivieillissement d'un antioxydant dérivé du raisin sont régulées par l'équilibre mitochondrial de la fusion et de la fission conduisant à la mitophagie déclenchée par un réseau de signalisation de Sirt1-Sirt3-Foxo3-PINK1-PARKIN. Médecine oxydative et longévité cellulaire 2014: 345105.
- Longo, V. et Panda, S. (2016). Fasting, circadian rhythms, and time-restricted feeding in healthy lifespan. Cell Metabolism 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I& Sahebkar, A. (2020). L'effet du jeûne ou de la restriction calorique sur l'induction de la mitophagie : une revue de la littérature. Journal of Cachexia, Sarcopenia and Muscle 11 (6): 1447-1458.
- Wei, Y. et Lee, H. (2002). Oxidative stress, mitochondrial DNA mutation, and impairment of antioxidant enzymes in aging (Stress oxydatif, mutation de l'ADN mitochondrial et altération des enzymes antioxydantes dans le vieillissement). Experimental Biology and Medicine 227 (9) : 671-682.
- Zapico, S. & Ubelaker, D. (2013). Mutations de l'ADNmt et leur rôle dans le vieillissement, les maladies et les sciences médico-légales. Aging and Disease 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Génération d'espèces réactives de l'oxygène par les mitochondries. Antioxydants 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Espèces réactives de l'oxygène et mitochondries : A nexus of cellular homeostasis. Redox Biology 6: 472-485.
- Correia-Melo, C. et al. (2016). Les mitochondries sont nécessaires pour les caractéristiques pro-vieillissement du phénotype sénescent. The EMBO Journal 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Les protéines de fusion et de fission mitochondriales comme nouvelles cibles thérapeutiques pour le traitement des maladies cardiovasculaires. European Journal of Pharmacology 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitophagy : an emerging role in aging and age-associated diseases (Mitophagie : un rôle émergent dans le vieillissement et les maladies associées à l'âge). Frontiers in Cell and Developmental Biology 8: 200.