L'étude de la résilience sous l'angle de la génétique est un domaine d'intérêt en pleine expansion, qui recoupe souvent les disciplines de la psychologie, de la neurobiologie et de la génomique. Bien que le concept de résilience - la capacité de récupérer ou de s'adapter à l'adversité ou au stress - ait de multiples facettes et soit influencé par une interaction complexe de facteurs génétiques, environnementaux et psychologiques, des tests ADN spécifiques ont été mis au point pour mettre en lumière les composantes génétiques de ce trait de caractère.
Introduction
Les gènes sont des segments d'ADN qui contiennent les instructions dont l'organisme a besoin pour fabriquer chacune des milliers de protéines nécessaires à la vie. Chaque gène comprend des milliers de combinaisons de "lettres" (appelées bases) qui constituent le code génétique. Ce code donne les instructions pour fabriquer les protéines nécessaires au bon développement et au bon fonctionnement de l'organisme.(1)
Les variations génétiques peuvent affecter l'expression d'un gène, affectant ainsi les processus métaboliques qui sont importants pour le maintien de la santé cellulaire et la façon dont nous réagissons aux interventions environnementales telles que l'alimentation, le mode de vie, les suppléments et les médicaments.
La connaissance de ces variations génétiques offre une vision inégalée des systèmes biologiques, permettant aux praticiens de santé de recommander des interventions précises visant à aider les individus à atteindre leurs objectifs et à parvenir à une santé optimale.
Comprendre les marqueurs génétiques de la résilience
La résilience-la capacité à se rétablir ou à s'adapter facilement à l'adversité ou au changement - est de plus en plus perçue à travers la génétique. En examinant les marqueurs génétiques, les chercheurs et les cliniciens cherchent à découvrir les fondements biologiques qui pourraient expliquer pourquoi certaines personnes se remettent mieux que d'autres d'un stress ou d'un traumatisme.(2) Ce champ d'investigation en plein essor s'est concentré sur les tests ADN liés à la résilience qui examinent les marqueurs génétiques potentiellement responsables des différences dans les réponses individuelles au stress.
Les systèmes endocrinien et nerveux sont au cœur de cette recherche (le système nerveux autonome, en particulier) qui jouent un rôle central dans la réponse de l'organisme au stress. L'axe hypothalamo-hypophyso-surrénalien (HHS), en particulier, est au centre des préoccupations, car il joue un rôle essentiel dans la régulation du mécanisme de réponse au stress de l'organisme. Ce réseau complexe d'interactions entre l'hypothalamus, l'hypophyse et les glandes surrénales orchestre la production et la régulation des principales hormones du stress, telles que le cortisol.
Le cortisol a des effets considérables sur de nombreuses fonctions de l'organisme et est libéré en réponse au stress et à une faible concentration de glucose dans le sang. Dans des circonstances normales, le cortisol aide à rétablir l'homéostasie après des événements stressants. Cependant, les variations génétiques qui affectent l'axe HPA peuvent entraîner des différences dans la façon dont le cortisol est produit, régulé et éliminé de l'organisme. Ces variations génétiques peuvent influencer la résilience physiologique d'un individu, c'est-à-dire sa capacité à maintenir ou à retrouver rapidement une bonne santé psychologique et physique après une épreuve.(3)
Tests ADN pour la résilience étudient les variantes génétiques associées aux récepteurs des hormones de stress, aux protéines impliquées dans les voies des hormones de stress et aux enzymes qui métabolisent ces hormones. Par exemple, une variante du gène FKBP5, qui intervient dans la régulation de la sensibilité du récepteur des glucocorticoïdes par lequel le cortisol exerce ses effets, pourrait modifier la réponse au stress d'un individu et potentiellement sa susceptibilité aux troubles liés au stress. Les gènes qui codent pour les neurotransmetteurs - les messagers chimiques du cerveau qui contribuent à la régulation de l'humeur et à la cognition - sont également sous les feux de la rampe. Il s'agit notamment de gènes comme le COMT, qui joue un rôle dans la dégradation de la dopamine, un neurotransmetteur associé aux systèmes de plaisir et de récompense.(4)
En outre, l'inflammation est un processus biologique étroitement lié au stress et aux troubles de l'humeur. L'inflammation chronique, que les variations génétiques peuvent influencer, peut affecter les fonctions cérébrales et le comportement.(5) Ainsi, les tests génétiques pourraient également chercher à identifier des variantes dans les gènes des cytokines pro-inflammatoires, telles que l'IL-6 et le TNF, qui pourraient prédisposer les individus à des réponses inflammatoires prolongées et affecter leur résilience mentale.
La compréhension de ces marqueurs génétiques est la pierre angulaire des interventions personnalisées. En identifiant les prédispositions génétiques, les individus peuvent prendre des mesures proactives pour renforcer leur résilience en modifiant leur mode de vie, en adoptant des stratégies psychologiques et en suivant des traitements médicaux adaptés à leur constitution génétique unique. Cette approche illustre l'évolution vers la médecine de précision, où le modèle unique cède la place à des soins plus individualisés.
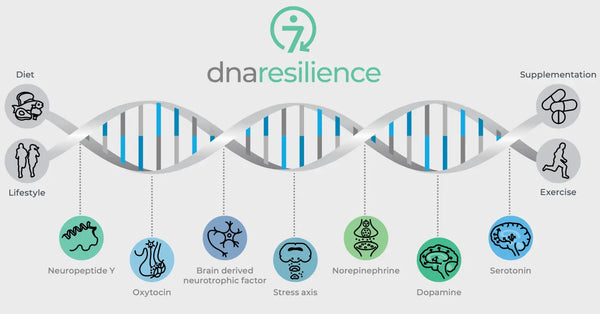
Image: Les sept voies moléculaires de la résilience.
Types de tests ADN pour la résilience
1) Gènes de réponse au stress
Les gènes de réponse au stress sont des composants essentiels du système de gestion et de réponse aux facteurs de stress de notre organisme. Ils codent pour des protéines qui régulent divers processus physiologiques, notamment la libération et l'action du cortisol, une hormone qui joue un rôle essentiel dans la réponse au stress.
CRHR1 (récepteur 1 de l'hormone de libération de la corticotropine)
CRHR1 code pour un récepteur de l'hormone de libération de la corticotropine (CRH), une hormone centrale qui déclenche la réponse au stress. Lorsque la CRH se lie à la CRHR1, elle stimule la production et la libération de l'hormone adrénocorticotrope (ACTH), qui incite les glandes surrénales à produire du cortisol. Les variantes du gène CRHR1 peuvent influencer la sensibilité de ce récepteur à la CRH, ce qui peut modifier la réponse globale au stress. Par exemple, certains polymorphismes peuvent entraîner une augmentation de la réponse au stress, ce qui peut contribuer à l'anxiété ou à la dépression. À l'inverse, d'autres peuvent atténuer la réponse, ce qui a un impact sur la capacité à gérer un stress aigu.(6-7)
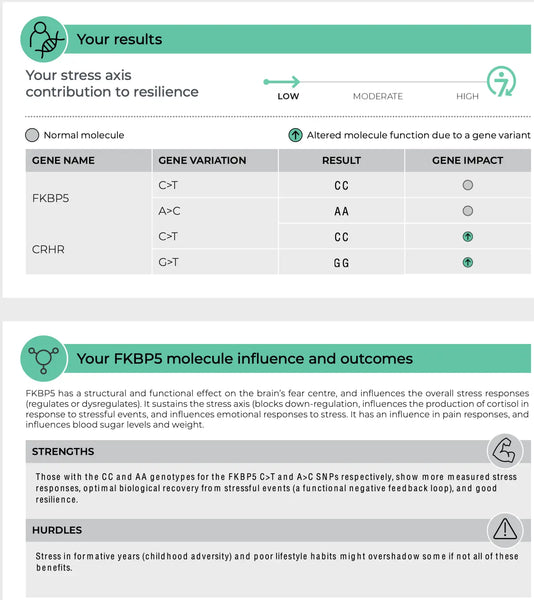
FKBP5 (protéine 5 de liaison au FK506)
Le gène FKBP5 joue un rôle dans la régulation de la sensibilité du récepteur des glucocorticoïdes, qui est le récepteur par lequel le cortisol exerce ses effets. Des polymorphismes spécifiques du gène FKBP5 ont été associés à une modification de la rétro-inhibition de l'axe HPA et à des réponses différentes aux glucocorticoïdes. Par exemple, certaines variantes de FKBP5 peuvent réduire l'affinité du récepteur des glucocorticoïdes pour le cortisol, ce qui peut entraîner une altération de la réponse au stress et un risque accru de troubles psychiatriques liés au stress, tels que le syndrome de stress post-traumatique (SSPT) ou la dépression majeure.(8-9)
Image : Une page d'exemple de la base de données test de résilience ADN.
NR3C1 (Sous-famille des récepteurs nucléaires 3, groupe C, membre 1)
NR3C1 code pour le récepteur des glucocorticoïdes lui-même. Les variations de ce gène peuvent affecter la façon dont l'organisme réagit au cortisol. Des polymorphismes spécifiques du NR3C1 peuvent influencer la sensibilité ou la densité des récepteurs des glucocorticoïdes, affectant ainsi l'efficacité avec laquelle le cortisol peut remplir ses fonctions. Il peut en résulter toute une série de réponses, allant d'une réponse au stress atténuée qui peut empêcher un individu de réagir de manière adéquate aux facteurs de stress à une réponse exagérée qui peut entraîner des symptômes de stress chronique, voire une dépression.(10-12)
Les résultats des tests génétiques de la réponse au stress peuvent donner des indications sur la prédisposition d'un individu à des problèmes de santé liés au stress. Par exemple :
-
Réponse accrue au stress : Les personnes présentant des variantes spécifiques peuvent être plus réactives au stress et présenter des niveaux de cortisol plus élevés lors d'événements stressants.
-
Réponse au stress réduite : À l'inverse, certains individus peuvent avoir une réponse au stress atténuée, ce qui peut être protecteur dans des situations de stress aigu, mais peut aussi empêcher l'activation des mécanismes physiologiques nécessaires en réponse à des défis.
2) Explication des tests de fonctionnement des neurotransmetteurs
Les tests de fonction des neurotransmetteurs sont conçus pour étudier les facteurs génétiques qui influencent la façon dont les neurotransmetteurs sont synthétisés, libérés et décomposés dans le cerveau. Les neurotransmetteurs étant des messagers chimiques qui régulent l'humeur, la cognition et les réactions au stress, les variations des gènes liés à ces substances peuvent avoir des conséquences importantes sur la résistance psychologique et la santé mentale globale d'un individu.
L'étude de la fonction des neurotransmetteurs dans le contexte de la résilience et de la réponse au stress ne se limite pas aux catécholamines comme la dopamine. Elle englobe un spectre plus large de systèmes de neurotransmetteurs impliqués dans la régulation de l'humeur, la vigilance et les fonctions cognitives. Plusieurs gènes sont impliqués dans la synthèse, la signalisation et la dégradation de ces neurotransmetteurs, notamment la dopamine bêta-hydroxylase (DBH), les récepteurs de la dopamine (DRD2, DRD4) et divers gènes liés à la sérotonine.(13)
COMT (Catéchol-O-Méthyltransférase)
Le gène COMT est l'un des plus étudiés en ce qui concerne la fonction des neurotransmetteurs. Il code pour une enzyme qui décompose les catécholamines - telles que la dopamine, l'épinéphrine et la norépinéphrine - neurotransmetteurs essentiels à la réponse au stress, à la cognition et à la régulation des émotions.
Il existe des polymorphismes bien connus dans le gène COMT, comme la variante Val158Met. Cette variante peut affecter le niveau d'activité de l'enzyme de différentes manières :(14-15)
- Forme à forte activité (variante Val) : Cette forme de l'enzyme décompose la dopamine plus rapidement, ce qui peut entraîner une baisse des niveaux de dopamine dans le cortex préfrontal, une région du cerveau impliquée dans les fonctions exécutives et la prise de décision. Les personnes présentant cette variante peuvent obtenir de meilleurs résultats dans des conditions stables, mais sont plus susceptibles de souffrir d'un déclin cognitif en cas de stress, en raison d'une plus faible disponibilité de la dopamine.
- Forme à faible activité (variante Met) : À l'inverse, cette forme de l'enzyme COMT métabolise la dopamine plus lentement, ce qui se traduit par des niveaux de dopamine plus élevés dans le cerveau. Cela peut améliorer les fonctions cognitives en cas de stress, mais peut aussi augmenter le risque de psychopathologies liées au stress, comme les troubles anxieux, car le cerveau est potentiellement surstimulé par l'excès de dopamine.
Bêta-hydroxylase de la dopamine (DBH)
La DBH est une enzyme qui convertit la dopamine en norépinéphrine, un neurotransmetteur impliqué dans la réaction de lutte ou de fuite. Les variations génétiques du gène DBH peuvent affecter l'activité de l'enzyme, influençant les niveaux de dopamine et de norépinéphrine dans le cerveau et le système nerveux périphérique.(16-18)
- Faible activité : Les variantes associées à une faible activité du gène DBH peuvent conduire à des niveaux plus élevés de dopamine et à des niveaux réduits de norépinéphrine, ce qui peut affecter les fonctions cognitives telles que l'attention et la prise de décision et influencer la façon dont un individu réagit au stress.
- Activité élevée : À l'inverse, les variantes qui entraînent une activité DBH plus élevée peuvent réduire les niveaux de dopamine tout en augmentant la norépinéphrine, ce qui peut avoir un impact sur la réactivité au stress et l'anxiété.
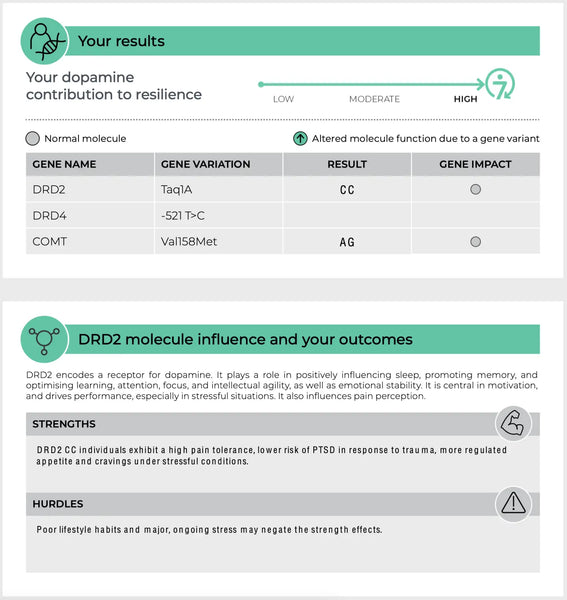
Récepteurs de la dopamine (DRD2 et DRD4)
Les gènes DRD2 et DRD4 codent respectivement pour les récepteurs dopaminergiques D2 et D4. Ces récepteurs font partie du système dopaminergique qui régule de nombreuses fonctions, notamment l'humeur, la récompense et le contrôle de la motricité(19-20)
- DRD2 : Les variantes du gène DRD2 peuvent avoir un impact sur la densité et l'affinité de liaison des récepteurs D2. Cela peut influencer la vulnérabilité au stress et l'efficacité des indices liés à la récompense, avec des implications potentielles pour des conditions telles que la dépendance et la dépression.
- DRD4 : Le gène DRD4 est connu pour son nombre variable de répétitions en tandem (VNTR) dans la région codante. Des répétitions spécifiques sont associées à des traits tels que la recherche de nouveauté et le risque de troubles de l'attention. Ce polymorphisme peut affecter l'efficacité de la signalisation synaptique de la dopamine et a été étudié dans le contexte de la résilience comportementale et psychologique.
Image: Une page d'exemple du site test de résilience ADN.
Variations du gène de la sérotonine
La sérotonine est un autre neurotransmetteur crucial dans la régulation de l'humeur, de l'appétit et du sommeil, qui peuvent tous être affectés par le stress. Plusieurs gènes impliqués dans la signalisation de la sérotonine sont intéressants :
- 5-HTT (SLC6A4) : Ce gène code pour le transporteur de la sérotonine, responsable de la recapture de la sérotonine dans la fente synaptique. Le polymorphisme 5-HTTLPR dans la région promotrice de ce gène a été étudié pour son association avec la sensibilité au stress et les troubles de l'humeur.(21)
- MAOA : Le gène de la monoamine oxydase A est responsable de la dégradation de la sérotonine. Les variations de ce gène peuvent affecter les niveaux de sérotonine et ont été associées à des traits comportementaux et à la sensibilité au stress.(22)
- TPH2 : La tryptophane hydroxylase-2 est une enzyme essentielle à la synthèse de la sérotonine dans le cerveau. Les variations génétiques de la TPH2 peuvent influencer la production de sérotonine, ce qui peut avoir un impact sur la régulation émotionnelle et la réponse au stress.(23)
L'interprétation des résultats de ces tests peut être complexe. Par exemple, une variante associée à un risque plus élevé de troubles liés au stress ne signifie pas nécessairement qu'un individu développera de tels troubles, mais elle peut suggérer une vulnérabilité accrue. De même, la possession d'une variante "résilience" ne garantit pas une résistance inébranlable au stress, car les facteurs environnementaux et les choix de mode de vie jouent un rôle important.
3) L'inflammation et son impact sur le cerveau
L'inflammation chronique peut nuire à la santé du cerveau. On pense qu'elle contribue au développement et à la progression des maladies neurodégénératives et qu'elle peut influencer la réponse au stress du cerveau, qui est étroitement liée à la résilience. Les cytokines pro-inflammatoires, comme l'interleukine-6 (IL-6) et le facteur de nécrose tumorale (TNF), peuvent traverser la barrière hémato-encéphalique et interagir avec les voies qui régulent l'humeur, la motivation et la vigilance.(24)
Variants génétiques associés à l'inflammation
IL-6 (Interleukine-6)
L'IL-6 est une cytokine qui joue un rôle dans la réponse inflammatoire et est impliquée dans diverses fonctions biologiques, notamment la réponse immunitaire, l'hématopoïèse et le métabolisme osseux. Dans le contexte du stress et de la résilience, l'IL-6 est liée aux éléments suivants :(25-26)
- Des niveaux élevés d'IL-6 ont été associés à un risque plus élevé de développer une dépression et d'autres troubles de l'humeur.
- Des variantes génétiques spécifiques du gène IL-6 peuvent conduire à une expression accrue de l'IL-6, ce qui peut exacerber la réponse inflammatoire et altérer la capacité du cerveau à faire face au stress.
TNF (facteur de nécrose tumorale)
Le TNF est une autre cytokine impliquée dans l'inflammation systémique. Il joue plusieurs rôles, notamment dans la régulation des cellules immunitaires et dans l'induction de la fièvre, de l'apoptose et de l'inflammation.(27)
- La surexpression du TNF a été associée à diverses maladies chroniques, dont la polyarthrite rhumatoïde, les maladies inflammatoires de l'intestin et le psoriasis, ainsi qu'au stress psychologique et à la dépression.
- Les variantes du gène TNF peuvent influencer le niveau de production du TNF, ce qui peut avoir des implications directes sur les processus inflammatoires dans l'ensemble du corps et du cerveau.
4) Régulateurs neurobiologiques et facteurs de résilience
Les variations génétiques de régulateurs neurobiologiques essentiels régissent également la résilience au stress. Il s'agit notamment de l'ocytocine, du facteur neurotrophique dérivé du cerveau (BDNF) et du neuropeptide Y (NPY). L'ocytocine joue un rôle dans la régulation des comportements sociaux et des réponses au stress. Le BDNF est essentiel au maintien de la neuroplasticité et des fonctions cognitives en cas de stress, et le NPY module l'anxiété et la réponse physiologique au stress. Ces molécules ont un impact collectif sur nos circuits neuronaux et notre résilience psychologique, ce qui permet de mieux comprendre les différences individuelles en matière de résilience au stress et d'envisager des stratégies personnalisées de biohacking.
L'ocytocine
L'ocytocine est souvent appelée "hormone de l'amour" en raison de son rôle dans les liens sociaux, les comportements maternels et l'intimité. Elle exerce également des effets anxiolytiques et influence la cognition et le comportement social.
- Influence génétique : Les variations du gène du récepteur de l'ocytocine (OXTR) ont été associées à la régulation émotionnelle, au comportement social et à la réactivité au stress. Des polymorphismes spécifiques du gène OXTR peuvent influencer l'efficacité de la liaison et les niveaux d'expression des récepteurs de l'ocytocine, ce qui peut affecter la capacité d'un individu à gérer le stress et à nouer des relations sociales.(28)
- Implications : Dans le contexte des tests de résilience, l'évaluation des variantes d'OXTR peut fournir des indications sur la prédisposition d'un individu à l'anxiété sociale, ses niveaux d'empathie et sa résilience potentielle face au stress, en particulier lorsqu'il s'agit de dynamique sociale.(29)
Facteur neurotrophique dérivé du cerveau (BDNF)
Le BDNF est une protéine cruciale impliquée dans la neuroplasticité, c'est-à-dire la capacité du cerveau à se réorganiser et à former de nouvelles connexions neuronales tout au long de la vie. Il est essentiel pour l'apprentissage, la mémoire et la régénération des neurones.(30)
- Variations génétiques : La variante Val66Met du gène BDNF est l'un des polymorphismes les plus étudiés. L'allèle Met a été associé à une sécrétion réduite de BDNF en fonction de l'activité, ce qui pourrait affecter la fonction cognitive et la résistance aux troubles neurologiques et psychiatriques.(31)
- Implications : Le dépistage des variantes du gène BDNF pourrait aider à prédire la capacité de neuroplasticité d'un individu en réponse au stress et pourrait avoir des implications pour le rétablissement après un traumatisme ou un accident neurologique.(32)
Image : Une page d'exemple de la base de données Analyse du test de résilience de l'ADN.
Neuropeptide Y (NPY)
Le NPY est l'un des peptides les plus abondants dans le cerveau. Il est impliqué dans la régulation des réponses au stress, de l'anxiété et de la prise alimentaire. Il est considéré comme un agent anxiolytique endogène.
- Associations génétiques : Les polymorphismes du gène NPY peuvent entraîner des différences dans l'expression et la sécrétion du NPY, ce qui peut influencer la résistance au stress d'un individu. Des niveaux élevés de NPY protègent généralement contre les effets du stress.
- Implications Les tests génétiques pour les variantes de NPY peuvent potentiellement indiquer la résistance au stress de base d'un individu et pourraient prédire sa réponse psychologique au stress chronique et aux traumatismes.(33)
Le rôle de l'épigénétique dans la modulation de la résistance au stress
Le domaine de l épigénétique s'intéresse à une couche de complexité qui va au-delà de la séquence statique de l'ADN. Les modifications épigénétiques consistent en des changements chimiques de la structure de l'ADN, tels que la méthylation et les modifications des histones, qui peuvent affecter la façon dont les gènes sont exprimés sans altérer le code génétique sous-jacent. Ces modifications sont dynamiques et réagissent aux stimuli environnementaux, y compris le stress chronique. L'exposition à un stress prolongé peut entraîner des modifications épigénétiques qui affectent le fonctionnement des gènes impliqués dans la réponse au stress, ce qui peut rendre plus difficile la gestion efficace de nouveaux facteurs de stress.(34-35)
Les entreprises à la pointe de la médecine personnalisée s'aventurent désormais dans le domaine de l'épigénétique, cherchant à découvrir comment ces modifications peuvent contribuer à la capacité d'un individu à résister au stress et à s'en remettre. En analysant les marqueurs épigénétiques, les scientifiques peuvent se faire une idée de l'état actuel des profils d'expression des gènes, qui résultent à la fois de prédispositions génétiques et d'influences environnementales. Ces tests permettent d'identifier les changements épigénétiques en réponse à un stress chronique, ce qui donne un aperçu des mécanismes moléculaires contribuant à la réponse au stress d'un individu ou à l'absence de réponse.
En outre, la compréhension de ces changements épigénétiques ouvre la voie à des interventions personnalisées. Des changements de mode de vie, des ajustements alimentaires et des stratégies thérapeutiques spécifiques pourraient être recommandés pour inverser les modifications épigénétiques négatives. Cette approche personnalisée permet non seulement d'améliorer la résilience d'un individu, mais aussi de mieux comprendre l'impact du stress sur nos systèmes biologiques au niveau épigénétique, ce qui pourrait déboucher sur de nouveaux traitements et de nouvelles stratégies préventives pour les troubles liés au stress. En cartographiant le paysage épigénétique de la réponse au stress, nous pouvons commencer à brosser un tableau plus complet des facteurs qui contribuent à notre capacité unique à faire face aux défis de la vie.
Avantages et limites des tests ADN de résilience
Ces tests peuvent offrir aux individus une meilleure compréhension de leur résilience innée et de leur réponse au stress. Ces connaissances pourraient permettre d'élaborer des stratégies personnalisées de gestion du stress et d'amélioration de la santé mentale. Toutefois, il est essentiel d'aborder ces tests avec prudence :
- Trait complexe : La résilience n'est pas déterminée par un seul gène, mais est un trait complexe influencé par de nombreux gènes et facteurs environnementaux.
- Influence de l'environnement : La génétique ne fonctionne pas de manière isolée. Les expériences de vie, les systèmes de soutien et les choix de mode de vie jouent un rôle important dans la résilience.
- Pouvoir prédictif : Bien que ces tests puissent donner des indications, ils ne sont pas des prédicteurs définitifs de la capacité d'un individu à faire face aux défis de la vie.
Conclusion
Les tests ADN liés à la résilience représentent une frontière intrigante pour comprendre comment notre patrimoine génétique peut influencer la capacité à gérer le stress et à se remettre de l'adversité. Bien qu'ils puissent fournir des informations précieuses, ils ne doivent être considérés que comme une pièce du gigantesque puzzle que constitue la résilience d'un individu. Pour toute personne intéressée par ces tests, il est recommandé de consulter un prestataire de soins de santé ou un conseiller en génétique afin d'interpréter les résultats dans le contexte plus large de leur santé et de leur mode de vie.
- Obtenez votre test ADN intégral ici !
- Réservez une consultation pour interpréter vos tests génétiques et de laboratoire avec le Dr Sovijärvi ici.
Références scientifiques :
- Bobrow, M. et Grimbaldeston, A. H. (2000). La génétique médicale, le projet du génome humain et la santé publique : Présenté à l'Université de Liverpool, 9 décembre 1996 et accepté pour publication le 17 février 2000. Journal of Epidemiology & Community Health, 54(9), 645-649.
- Cicchetti, D. (2010). Resilience under conditions of extreme stress : a multilevel perspective. World psychiatry, 9(3), 145.
- Luecken, L. J., & Gallo, L. C. (Eds.). (2008). Handbook of physiological research methods in health psychology (Manuel des méthodes de recherche physiologique en psychologie de la santé). Sage.
- Southwick, S. M., Vythilingam, M. et Charney, D. S. (2005). The psychobiology of depression and resilience to stress : implications for prevention and treatment. Annu. Rev. Clin. Psychol. 1, 255-291.
- Michaud, M., Balardy, L., Moulis, G., Gaudin, C., Peyrot, C., Vellas, B., ... & Nourhashemi, F. (2013). Cytokines pro-inflammatoires, vieillissement et maladies liées à l'âge. Journal of the American Medical Directors Association, 14(12), 877-882.
- Aguilera, G., Nikodemova, M., Wynn, P. C., & Catt, K. J. (2004). Corticotropin releasing hormone receptors : two decades later. Peptides, 25(3), 319-329.
- Subbannayya, T., Balakrishnan, L., Sudarshan, G., Advani, J., Kumar, S., Mahmood, R., ... & Prasad, T. K. (2013). An integrated map of corticotropin-releasing hormone signaling pathway (Une carte intégrée de la voie de signalisation de l'hormone de libération de la corticotropine). Journal of cell communication and signaling, 7, 295-300.
- Binder, E. B. (2009). The role of FKBP5, a co-chaperone of the glucocorticoid receptor in the pathogenesis and therapy of affective and anxiety disorders (Le rôle de FKBP5, un cochaperone du récepteur glucocorticoïde dans la pathogenèse et la thérapie des troubles affectifs et anxieux). Psychoneuroendocrinology, 34, S186-S195.
- Ising, M., Depping, A. M., Siebertz, A., Lucae, S., Unschuld, P. G., Kloiber, S., ... & Holsboer, F. (2008). Polymorphisms in the FKBP5 gene region modulate recovery from psychosocial stress in healthy controls (Polymorphismes dans la région du gène FKBP5 modulent la récupération après un stress psychosocial chez des témoins sains). European Journal of Neuroscience, 28(2), 389-398.
- Vitellius, G., Trabado, S., Bouligand, J., Delemer, B., & Lombès, M. (2018, juin). Physiopathologie de la signalisation des glucocorticoïdes. In Annales d'endocrinologie (Vol. 79, n°3, pp. 98-106). Elsevier Masson.
- Van West, D., Van Den Eede, F., Del-Favero, J., Souery, D., Norrback, K. F., Van Duijn, C., ... & Claes, S. (2006). Glucocorticoid receptor gene-based SNP analysis in patients with recurrent major depression. Neuropsychopharmacology, 31(3), 620-627.
- Schneider, K. K., Frings, C., Meyer, J. et Schote, A. B. (2016). Le rôle du gène du récepteur glucocorticoïde (NR3C1) pour le traitement des stimuli aversifs. Neuroscience Research, 107, 8-13.
- Azadmarzabadi, E., Haghighatfard, A. et Mohammadi, A. (2018). Une faible résilience au stress est associée à des altérations de l'expression des gènes candidats dans la voie de signalisation dopaminergique. Psychogeriatrics, 18(3), 190-201.
- Heinz, A. et Smolka, M. N. (2006). The effects of catechol O-methyltransferase genotype on brain activation elicited by affective stimuli and cognitive tasks. Reviews in the Neurosciences, 17(3), 359-368.
- Mier, D., Kirsch, P. et Meyer-Lindenberg, A. (2010). Neural substrates of pleiotropic action of genetic variation in COMT : a meta-analysis. Molecular psychiatry, 15(9), 918-927.
- Mustapic, M., Maihofer, A. X., Mahata, M., Chen, Y., Baker, D. G., O'Connor, D. T., & Nievergelt, C. M. (2014). L'enzyme de biosynthèse des catécholamines dopamine β-hydroxylase (DBH) : la première recherche à l'échelle du génome positionne les variants déterminant les traits agissant de manière additive dans le promoteur proximal. Human molecular genetics, 23(23), 6375-6384.
- Vincent, S. et Robertson, D. (2002). The broader view : catecholamine abnormalities. Clinical Autonomic Research, 12, I44-I49.
- Hoenicka, J., Aragüés, M., Ponce, G., Rodríguez-Jiménez, R., Jiménez-Arriero, M. A. et Palomo, T. (2007). Des gènes dopaminergiques aux troubles psychiatriques. Neurotoxicity research, 11, 61-71.
- Hill, S. Y., Hoffman, E. K., Zezza, N., Thalamuthu, A., Weeks, D. E., Matthews, A. G. et Mukhopadhyay, I. (2008). Dopaminergic mutations : Within-family association and linkage in multiplex alcohol dependence families. American Journal of Medical Genetics Part B : Neuropsychiatric Genetics, 147(4), 517-526.
- He, Y., Martin, N., Zhu, G. et Liu, Y. (2018). Gènes candidats pour la recherche de nouveauté : une méta-analyse des études d'association de : DRD4 : exon III et : COMT : Val158Met. Psychiatric genetics, 28(6), 97-109.
- Avula, R., Rand, A., Black, J. L. et O'kane, D. J. (2011). Génotypage simultané de polymorphismes multiples dans le gène du transporteur de la sérotonine humaine et détection de nouveaux variants alléliques. Translational psychiatry, 1(8), e32-e32.
- Tivol, E. A., Shalish, C., Schuback, D. E., Hsu, Y. P., & Breakefield, X. O. (1996). Analyse mutationnelle du gène MAOA humain. American journal of medical genetics, 67(1), 92-97.
- Waider, J., Araragi, N., Gutknecht, L. et Lesch, K. P. (2011). Tryptophan hydroxylase-2 (TPH2) dans les troubles du contrôle cognitif et de la régulation des émotions : une perspective. Psychoneuroendocrinology, 36(3), 393-405.
- Bauer, M. E. et Teixeira, A. L. (2021). Neuroinflammation in mood disorders : role of regulatory immune cells. Neuroimmunomodulation, 28(3), 99-107.
- Anderson, G., Kubera, M., Duda, W., Lasoń, W., Berk, M. et Maes, M. (2013). Augmentation de la transsignalisation de l'IL-6 dans la dépression : focus sur la voie du catabolite du tryptophane, la mélatonine et la neuroprogression. Pharmacological Reports, 65(6), 1647-1654.
- Perry, B. I., Upthegrove, R., Kappelmann, N., Jones, P. B., Burgess, S. et Khandaker, G. M. (2021). Associations of immunological proteins/traits with schizophrenia, major depression and bipolar disorder : a bi-directional two-sample mendelian randomization study. Brain, behavior, and immunity, 97, 176-185.
- Bradley, J. (2008). TNF-mediated inflammatory disease. The Journal of Pathology : A Journal of the Pathological Society of Great Britain and Ireland, 214(2), 149-160.
- Loth, E., Poline, J. B., Thyreau, B., Jia, T., Tao, C., Lourdusamy, A., ... & IMAGEN Consortium. (2014). Le génotype du récepteur de l'ocytocine module l'activité striatale ventrale aux indices sociaux et la réponse aux événements stressants de la vie. Biological psychiatry, 76(5), 367-376.
- Myers, A. J., Williams, L., Gatt, J. M., McAuley-Clark, E. Z., Dobson-Stone, C., Schofield, P. R., & Nemeroff, C. B. (2014). Variation dans le gène du récepteur de l'ocytocine est associée à un risque accru d'anxiété, de stress et de dépression chez les personnes ayant des antécédents d'exposition au stress de la vie précoce. Journal of psychiatric research, 59, 93-100.
- Cowansage, K. K., LeDoux, J. E. et Monfils, M. H. (2010). Brain-derived neurotrophic factor : a dynamic gatekeeper of neural plasticity. Current molecular pharmacology, 3(1), 12-29.
- Chen, Z. Y., Jing, D., Bath, K. G., Ieraci, A., Khan, T., Siao, C. J., ... & Lee, F. S. (2006). Genetic variant BDNF (Val66Met) polymorphism alters anxiety-related behavior. science, 314(5796), 140-143.
- Phillips, C. (2017). Facteur neurotrophique dérivé du cerveau, dépression et activité physique : établir la connexion neuroplastique. Neural plasticity, 2017.
- Schmeltzer, S. N., Herman, J. P. et Sah, R. (2016). Neuropeptide Y (NPY) et trouble de stress post-traumatique (TSPT) : une mise à jour translationnelle. Experimental neurology, 284, 196-210.
- Lux, V. (2016, mars). Programmation épigénétique dans le développement psychobiologique : Evidence for the Dual-Activation Theory and a Mediating Role of Early Life Stress. In Qatar Foundation Annual Research Conference Proceedings Volume 2016 Issue 1 (Vol. 2016, No. 1, p. HBOP3415). Hamad bin Khalifa University Press (HBKU Press).
- Chukwuma Sr, C. (2022). Epigenetics and its essence in understanding human growth, development and disease (L'épigénétique et son essence dans la compréhension de la croissance humaine, du développement et de la maladie). J Med Res, 8(5), 165-172.