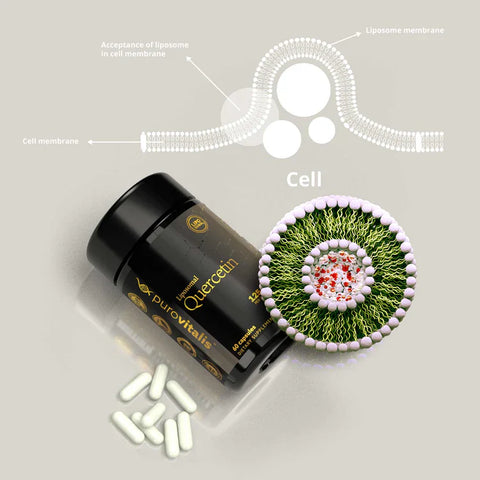
Õppige olulisi toidulisandeid meie juhendiga kolme parima loodusliku senolüütiku kohta, mis võivad rakke noorendada ja tervist parandada. Kui me vananeme, võib rakkude vananemine - kui rakud lõpetavad jagunemise ja kogunevad meie kehas - viia erinevate vanusega seotud haigusten tekkimiseni. Teatud looduslikud ühendid on aga tuvastatud kui võimsad senolüütikuteks mis on võimelised neid vananenud rakke selektiivselt puhastama. Selles artiklis vaadeldakse sügavamalt nende tähelepanuväärsete ainete taga peituvat teadust ja seda, kuidas lisada neid igapäevastesse rutiinidesse, et vananemisvastast kasu tervisele saavutada.
Sissejuhatus
Vananemine on keeruline bioloogiline protsess, mida iseloomustab füsioloogiliste funktsioonide järkjärguline langus ja suurenenud vastuvõtlikkus haigustele. Kuigi vananemist on pikka aega peetud elu paratamatuks aspektiks, on hiljutised edusammud seoses biogerontoloogia on paljastanud selle aluseks olevad rakulised ja molekulaarsed mehhanismid. Nende mehhanismide hulgas on esile kerkinud rakkude vananemine kui vanusega seotud patoloogiate silmapaistev tegur. Tegemist on pöördumatu kasvu peatumisega, mille käivitavad mitmesugused stressitegurid.(1)
Kuna vananemisega suureneb vananevate rakkude arv, on eeldatud, et vananemine aitab kaasa vananemisele. Senesentsus on vajalik selleks, et vältida kahjustatud rakkude levikut ja paljunemist, mis vallandab immuunsüsteemi vastuse. See rakkude kontrollpunkt nõuab tõhusat rakkude asendussüsteemi, mis hõlmab nii vananevate rakkude puhastamist kui ka progenitorrakkude mobiliseerimist, et taastada optimaalne rakkude arv.(2)
Tihti on teatatud, et tuuma DNA kahjustused on sageli vananemise põhjuseks, peamiselt DNA kahesooneliste katkestuste (DSB) kujul, mis aktiveerivad DNA kahjustusreaktsiooni (DDR) raja. Pikaajaline DDR-i aktiveerimine aktiveerib senestsentsi. Üks või mõni DDR-signaaliga telomeer (kromosoomi otsad) on piisav, et käivitada replikatiivset rakkude vananemist. Onkogeenide aktiveerimine on samuti tugev senestsentsi vallandaja.(3)
Senesentsed rakud väljendavad olulisi muutusi oma sekretoomis, mis on eriti rikastatud proinflammatoorsete tsütokiinide ja maatriksmetalloproteinaaside osas. Seetõttu nimetatakse seda senestsentsiga seotud sekretoorse fenotüübiks (SASP).. Senesentsetel rakkudel on selgelt eristatavad fenotüübilised muutused, näiteks lamedam morfoloogia, muutunud geeniekspressioon ja põletikuvastaste molekulide sekretsioon. Ehkki vananemine on algselt kasvajat pärssiv mehhanism, mis peatab kahjustatud rakkude proliferatsiooni, aitab vananevate rakkude kogunemine aja jooksul kaasa kudede talitlushäiretele ja soodustab vananemisega seotud haigusi. (4)
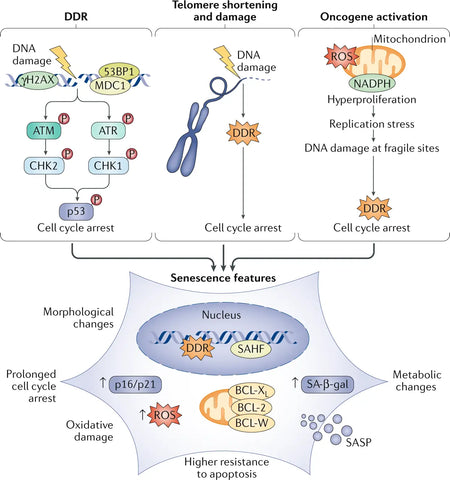
Pilt: Senestsentsi ajendid ja fenotüübid.
Allikas: Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Rakkude vananemine vananemisel: mehhanismidest ravivõimalusteni. Nature Reviews Molecular Cell Biology 22 (2): 75–95.
Arvestades vananevate rakkude kahjulikku mõju kudede homöostaasile ja tervisele, on nende rakkude sihistamine kujunenud paljutõotavaks ravistrateegiaks. Senolüütikumid on ühendid, mis on kavandatud indutseerima apoptoosi vananevates rakkudes, säästes samal ajal selektiivselt terveid rakke. Nad võivad leevendada põletikku, suurendada kudede taastumist ja vähendada ja viivitada vanusega seotud patoloogiate teket.(5)
Senolüütilised ühendid
Arvukad looduslikud ja sünteetilised ühendid on tuvastatud kui potentsiaalsed senolüütilised ühendid, kusjuures kvertsetiin (looduslik ühend) ja dasatiniib (sünteetiline ravim) on selle klassi esimesed kandidaadid. Lisaks kvertsetiinile ja dasatiniibile on mitmed teised ühendid, sealhulgas fisetiin, navitoklax ja fisetiin. ja ABT-263, on prekliinilistes mudelites näidanud paljulubavaid senolüütilisi omadusi. Selles artiklis käsitletakse 3 peamist potentsiaalset ja paljulubavat looduslikku senolüütilist ainet, mis on praegu saadaval.
Fisetin
Fisetiin on bioaktiivne flavonool (polüfenool), mille potentsiaali tervise ja pikaealisuse edendamiseks on märkimisväärselt uuritud, peamiselt rakkude vananemise leevendamise kaudu. Seda leidub peamiselt maasikates, õunades, persimoonis, sibulas, viinamarjades ja väikestes kogustes kurkides (vt pilti). Fisetiinil on mitmeid bioloogilisi toimeid, mis on tingitud tema ainulaadsest molekulaarstruktuurist (tasapinnaline struktuur ja mitu süsinikuringi).(6-7)
Fisetiini omaduste esialgne uurimine näitab selle tugevat antioksüdantset toimet, mis tuleneb tema võimest kõrvaldada reaktiivseid hapnikuliike (ROS). Seega mängib see olulist rolli rakkude kaitses oksüdatiivse stressi vastu.(8)

Pilt: Fisetiini toiduallikad.
Allikas: Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetiin: toidu antioksüdant tervise edendamiseks. Antioksüdandid & Redox Signaling 19 (2): 151–162.
Fisetiini senolüütiline aktiivsus on pikaealisuse uurimisel esmatähtis. Rakkude vananemine on seisund, kus rakud lõpetavad proliferatsiooni ja akumuleeruvad aja jooksul - see on seotud erinevate vanusega seotud haigustega (vt lähemalt eespool). On leitud, et fisetiin indutseerib neis vananevates rakkudes selektiivselt apoptoosi. On oletatud, et see selektiivne eemaldamine leevendab vananemisega seotud fenotüüpe, aidates seeläbi kaasa vananemisega seotud patoloogiate edasilükkamisele või ennetamisele. Võrreldes teise võimaliku senolüütilise ühendiga on fisetiin umbes kaks korda tugevam kui kvertsetiin (vt hiljem artiklis).(9-10)
Flavonoidide (nagu fisetiin) prooksüdantne aktiivsus on oluline kaalutlus senolüütiliste ainete sõelumisel. Vananevad rakud akumuleerivad suure hulga vaske ja rauda. Kvertsetiini või fisetiini selektiivne mehhanism on selgesõnaliselt seotud vase/raua poolt esilekutsutud oksüdatiivse kahjustusega senesentsetes rakkudes, tappes seega apoptoosiresistentsed rakud.(11)
Fisetiin mõjutab ka olulisi rakulisi signaaliradu, mis on vananemisprotsessi lahutamatu osa. See moduleerib sirtuiinide (eriti SIRT1), mTORi (inhibeerimine) ja JAK-STAT/NF-κB funktsiooni, mis on olulised rakkude ellujäämise, apoptoosi ja autofaagia reguleerimisel. Neid radu moduleerides võib Fisetin teoreetiliselt parandada rakkude funktsiooni, vähendada põletikku ja säilitada koe homöostaasi.(12-14)
Fisetiinil on näidatud ka neuroprotektiivseid omadusi. See leevendab neuronaalseid kahjustusi ja parandab kognitiivseid funktsioone, peamiselt oma antioksüdatiivse toime ja neuronaalsete signaaliradade modulatsiooni kaudu.(15-16)
Hoolimata nendest paljutõotavatest prekliinilistest tulemustest on oluline tunnistada, et enamik fisetiini uuringuid on piirdunud in vitro ja loomamudelitega. Nende tulemuste ülekandmiseks kliinilistesse rakendustesse inimestel on vaja rangeid kliinilisi uuringuid, et teha kindlaks Fisetini tõhusus, ohutus ja optimaalne annustamine. Õnneks on mõned kliinilised uuringud juba käimas ja tulemused peaksid olema kättesaadavad lähiaastatel.(17-18)
Kvertsetiin
Kvertsetiin on oluline antioksüdant, mis kuulub flavonoolide hulka. See esineb looduslikult paljudes köögiviljades, puuviljades, marjades, lehtedes ja teraviljades. Kvertsetiini leidub peamiselt kapparites, redistes, tillides, koriandris, kapsas, punases sibulas, brokoolis ja marjades, nagu jõhvikad ja jõhvikad. Kvertsetiin on üks olulisemaid ja levinumaid looduses esinevaid flavonoole.

Uuringud näitavad, et kvertsetiin toimib viirusevastase, mikroobivastase ja põletikuvastase vahendina.(19) Lisaks on uuringud näidanud kvertsetiini antihistamiinset toimet, mis tähendab, et see võib aidata ravida allergiat.(20-21) Kvertsetiini kõige olulisem mõju inimkehale on selle võime vähendada vaikivat põletikku.(22)
Kvertsetiini potentsiaali pikaealisuse edendamisel võib seostada selle antioksüdantsete omadustega. Antioksüdandina püüab kvertsetiin vabu radikaale, vähendades oksüdatiivset stressi organismis. Uuringud on näidanud, et kvertsetiin võib aktiveerida sirtuiini (eelkõige SIRT-1), mis reguleerib selliseid rakuprotsesse nagu DNA parandamine, geeniekspressioon ja ainevahetus. Sirtuiinide aktiveerimine on seotud erinevate organismide eluea pikenemisega.(23-24)
Samuti on näidatud, et kvertsetiin aktiveerib Nrf2 rada ja raku tuumades aktiveerib see erinevate antioksüdantide vastuselemendi (ARE) poolt juhitud geenide transkriptsiooni. Need geenid reguleerivad tsütoprotektiivsete ensüümide, näiteks glutatioon-S-transferaasi, NAD(P)H kinoondehüdrogenaasi 1 ja hemaatsügenaas-1 ekspressiooni.(25)
Tavaliselt võetakse kvertsetiini toidulisandeid annuses 500 mg kaks korda päevas. Kvertsetiini optimaalset annust ei ole siiski veel kindlaks määratud. Kvertsetiini soovitatav toidukogus on tavaliselt 5 kuni 40 mg päevas, kuid seda võib tarbida ka oluliselt suuremates kogustes (> 500 mg).
Kvertsetiini puhul on meie soovitus Purovitalise liposomaalne vorm.
Apigeniin
Apigeniin (4′,5,7,-trihüdroksüflavoon) on looduslikult esinev flavonoidiühend, mis leidub erinevates taimedes, sealhulgas peterselli, selleris ja tsitrusviljades. Eriti rohkesti on seda kummelite õites. Apigeniin võib aidata ennetada selliseid kroonilisi haigusi nagu diabeet, Alzheimeri tõbi, depressioon, unetus ja vähk, mille kasulikkust on täheldatud in vivo uuringutes (loomkatsed ja inimkatsed).(26)

Üks apigeniini kõige paljulubavamaid aspekte on selle võime edendada rakkude vastupanuvõimet. On näidatud, et apigeniin aktiveerib Nrf2 rada, mis on oluline organismi kaitses oksüdatiivse stressi ja põletiku vastu. Reguleerides antioksüdantsete ensüümide, nagu superoksiiddismutaas, katalaas ja glutatioonperoksidaas, ekspressiooni, aitab apigeniin kaitsta rakke reaktiivsete hapnikuliikide (ROS) põhjustatud kahjustuste eest.(27)
Lisaks oma antioksüdantsetele omadustele on apigeniinil tõestatud põletikuvastane toime. On leitud, et see pärsib põletikuvastaste tsütokiinide, nagu TNF-α, IL-1β ja IL-6, tootmist, moduleerides NF-κB signaalirada ((28) Apigeniini on uuritud ka selle võimalike vähivastaste omaduste osas. Uuringud on näidanud, et apigeniin võib indutseerida apoptoosi (programmeeritud rakusurma) erinevates vähirakuliinides, sealhulgas rinna-, eesnäärme- ja jämesoolevähirakkudes. Apigeniin soodustab ka autofaagiat, aidates seeläbi kõrvaldada düsfunktsionaalseid rakuelemente.(29-30)
Apigeniini on uuritud ka selle võime tõttu moduleerida vananemisega seotud radu. Üks selline rada on insuliini/IGF-1 signaalirada (IIS), mis teatavasti mängib rolli eluea reguleerimisel eri liikide puhul. On näidatud, et apigeniin inhibeerib IIS-i rada, mis võib jäljendada kalorite piiramise mõju, mis on hästi tõestatud sekkumine pikaealisuse edendamiseks.(31-32) Lisaks sellele inhibeerib apigeniin NAD+aasi CD38, mis on seotud metaboolse sündroomiga, suurendades intratsellulaarse NAD+ taset ja vähendades valkude globaalset atsetüleerimist.(33) Seoses vananemisega, eelkõige apigeniin aitab pärssida allesjäänud vananevatel rakkudel SASP (senesentsiga seotud sekretoorne fenotüüp; vt eespool) tootmist, et toetada rakkude ja kudede tervist.(34)
Mis puudutab doseerimist, siis apigeniini lisamise jaoks ei ole üldiselt soovitatavat annust. Siiski on loomamudelites kasutatud annuseid vahemikus 25 kuni 100 mg/kg kehakaalu kohta.(35) Toidulisandid on tavaliselt vahemikus 50 kuni 500 mg päevas. Kõige tõhusam ja ohutum annus ei ole siiski veel lõplikult kindlaks tehtud. Apigeniini peetakse üldiselt ohutuks, kuid suured annused võivad olla koostoimes teatavate ravimitega.
Kokkuvõte
Looduslike senolüütikumide potentsiaali analüüsi lõpetades on ilmne, et sellised ühendid nagu fisetiin, kvertsetiin ja apigeniin omavad märkimisväärset senolüütilist võimekust, mis võib vananemisprotsessi oluliselt mõjutada. Need ained on konkreetselt suunatud vananevatele rakkudele ja kõrvaldavad neid, tegeledes seega ühe põhilise vananemismehhanismi ja sellega seotud patoloogiatega. Nende bioaktiivsete ühendite integreerimine oma toiduvalikusse - mis pärinevad sellistest allikatest nagu maasikad, sibul ja kummel - kujutab endast strateegilist lähenemist rakufunktsiooni tõhustamiseks ja rakukahjustuste kuhjumise leevendamiseks aja jooksul.
Kuigi prekliinilised andmed on paljutõotavad, on nende tulemuste üleviimine praktilisteks kliinilisteks strateegiateks vaja täiendavaid empiirilisi uuringuid, et kinnitada tõhusust ja ohutust. Seetõttu on oluline jätkata nende ühendite uurimist rangete kliiniliste uuringute raames.
Teaduslikud viited:
- Sikora, E., Arendt, T., Bennett, M., & Narita, M. (2011). Rakulise vananemise allkirja mõju vananemisuuringutele. Vananemisuuringute ülevaated, 10(1), 146-152.
- He, S., & Sharpless, N. E. (2017). Senesentsus tervises ja haigustes. Cell, 169(6), 1000-1011.
- Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Rakkude vananemine vananemisel: mehhanismidest ravivõimalusteni. Nature Reviews Molecular Cell Biology 22 (2): 75–95.
- Kuilman, T. & Michaloglou, C. & Mooi, W. & Peeper, D. (2010). Vananemise olemus. Genes & Development 24 (22): 2463–2479.
- Kirkland, J. L., & Tchkonia, T. (2020). Senolüütilised ravimid: avastamisest tõlkimiseni. Journal of internal medicine, 288(5), 518-536.
- Sengupta, B. & Banerjee, A. & Sengupta, P. (2005). Taimse flavonoidi fisetiini koostoimed makromolekulaarsete sihtmärkidega: sissevaated fluorestsentsspektroskoopilistest uuringutest. Journal of Photochemistry and Photobiology B: Biology. 80 (2): 79–86.
- Bag, S. & Ghosal, S. & Karmakar, S. & Pramanik, G. & Bhowmik, S. (2023). Uncovering the Contrasting Binding Behavior of Plant Flavonoids Fisetin and Morin Having Subsidiary Hydroxyl Groups (- OH) with HRAS1 and HRAS2 i-Motif DNA Structures: Struktuurimuutuste ja positsiooniliste mõjude dekodeerimine. ACS Omega 8 (33): 30315–30329.
- Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetiin: toidu antioksüdant tervise edendamiseks. Antioksüdandid & Redox Signaling 19 (2): 151–162.
- Yousefzadeh, M. et al. (2018). Fisetiin on senoteraapia, mis pikendab tervist ja eluiga. EBioMedicine 36: 18-28.
- Wyld, L. et al. (2020). Senesentsus ja vähk: ülevaade senesentsuse ja senoteraapiate kliinilistest mõjudest. Cancer 12 (8): 2134.
- Wang, Y. & He, Y. & Rayman, M. & Zhang, J. (2021). Flavonoididest saadud uute senolüütiliste ainete perspektiivne selektiivne mehhanism. Journal of Agricultural and Food Chemistry 69 (42): 12418–12423.
- Wiciński, M. et al. (2023). Natural Phytochemicals as SIRT Activators-Focus on Potential Biochemical Mechanisms. Nutrients . 15 (16): 3578.
- Afroze, N. et al. (2022). Fisetiin pidurdab rakkude proliferatsiooni, indutseerib apoptoosi, leevendab oksüdatiivset stressi ja põletikku inimese vähirakkudes, HeLa. International Journal of Molecular Sciences 23 (3): 1707.
- Roy, T. et al. (2023). MTOR/IL-17A ja autofagia topelt sihistamine fisetiini abil leevendab psoriaasilaadset nahapõletikku. Frontiers in Immunology 13: 1075804.
- Samanta, S. et al. (2022). Fisetiini, loodusliku flavonoidi neuroprotektiivne toime neurodegeneratiivsete haiguste korral: Fookus oksüdatiivse stressi rollile. Frontiers in Pharmacology 13: 1015835.
- Singh, S. & Singh, A. & Garg, G. & Rizvi, S. I. (2018). Fisetiin kui kaloripiirangu mimeetikum kaitseb roti aju vananemisest tingitud oksüdatiivse stressi, apoptoosi ja neurodegeneratsiooni eest. Life Sciences 193: 171–179.
- Verdoorn, B. et al. (2021). Fisetiin COVID-19 jaoks kvalifitseeritud hooldusraviasutustes: Senolüütilised uuringud COVIDi ajastul. Journal of the American Geriatrics Society 69 (11): 3023–3033.
- Kirkland, J. (2024). Fisetiiniga leevendamine vanemaealistel naistel esineva nõrkuse, põletiku ja sellega seotud meetmete leevendamine (AFFIRM). ClinicalTrials.gov ID: NCT03430037.
- Chirumbolo, S. (2010). Kvertsetiini, flavonoolide ja flavoonide roll põletikurakkude funktsiooni moduleerimisel. Inflammation & Allergy-Drug Targets 9 (4): 263–285.
- Chirumbolo, S. (2011). Kvertsetiin kui potentsiaalne allergiavastane ravim: millised perspektiivid? Iran Journal of Allergy Asthma and Immunology. 10 (2): 139–140.
- Sagit, M. et al. (2017). Kvertsetiini efektiivsus allergilise riniidi eksperimentaalses rottide mudelis. European Archives of Oto-Rhino-Laryngology 274 (8): 3087–3095.
- Li, Y. et al. (2016). Kvertsetiin, põletik ja immuunsus. Nutrients 8 (3): 167.
- Costa, L. & Garrick, J. & Roquè, P. & Pellacani, C. (2016). Neuroprotektsiooni mehhanismid kvertsetiini poolt: Counteracting Oxidative Stress and More. Oxidative Medicine and Cellular Longevity (Oksüdatiivne meditsiin ja rakuline pikaealisus). 2016: 2986796.
- Cui, Z. et al. (2022). Kvertsetiini terapeutiline kasutamine vananemisega seotud haiguste puhul: SIRT1 kui potentsiaalne mehhanism. Frontiers in Immunology 13: 943321.
- Suraweera, T. & Rupasinghe, H. & Dellaire, G. & Xu, Z. (2020). Nrf2/ARE raja reguleerimine dieetiliste flavonoididega: Friend or Foe for Cancer Management? Antioksüdandid 9: 973.
- Salehi, B. et al. (2019). Apigeniini terapeutiline potentsiaal. International Journal of Molecular Sciences 20 (6): 1305.
- Paredes-Gonzalez, X. et al. (2015). NRF2-vahendatud geeniekspressiooni indutseerimine toidu fütokemikaalsete flavoonide apigeniini ja luteoliini poolt. Biopharmaceutics & Drug Disposition 36 (7): 440–451.
- Ginwala, R. & Bhavsar, R. & Chigbu, D. & Jain, P. & Khan, Z. (2019). Flavonoidide potentsiaalne roll krooniliste põletikuliste haiguste ravis, keskendudes eelkõige apigeniini põletikuvastasele aktiivsusele. Antioksüdandid 8 (2): 35.
- Shukla, S. & Gupta, S. (2010). Apigeniin: paljulubav molekul vähktõve ennetamiseks. Pharmaceutical Research 27: 962–978.
- Sung, B. & Chung, H. & Kim, N. (2016). Apigeniini roll vähi ennetamisel apoptoosi ja autofagia indutseerimise kaudu. Journal of Cancer Prevention 21 (4): 216-226.
- Pan, H. & Finkel, T. (2017). Võtmevalkud ja -radad, mis reguleerivad eluiga. Journal of Biological Chemistry 292 (16): 6452–6460.
- Shukla, S. & Gupta, S. (2009). Apigeniin pärsib inimese eesnäärmevähi insuliinilaadse kasvufaktori I retseptori signalisatsiooni: In vitro ja in vivo uuring. Molecular Carcinogenesis 48 (3): 243–252.
- Escande, C. et al. (2013). Flavonoid apigeniin on NAD+ ase CD38 inhibiitor: mõju raku NAD+ metabolismile, valkude atsetüleerimisele ja metaboolse sündroomi ravile. Diabetes . 62 (4): 1084–1093.
- Lim, H. & Park, H. & Kim, H. (2015). Flavonoidide mõju bleomütsiinist põhjustatud vananemisega seotud sekretoorse fenotüübi kujunemisele BJ fibroblastides. Biochemical Pharmacology 96 (4): 337–348.
- Salehi, B. et al. (2019). Apigeniini terapeutiline potentsiaal. International Journal of Molecular Sciences 20 (6): 1305.