Vastupidavuse uurimine geneetika kaudu on laienev huvivaldkond, mis sageli ristub psühholoogia, neurobioloogia ja genoomika valdkondadega. Kuigi vastupanuvõime - võime taastuda ebaõnnestumistest või stressist või nendega kohaneda - on mitmetahuline ja seda mõjutab geneetiliste, keskkonna- ja psühholoogiliste tegurite keeruline koostoime, on selle tunnuse geneetiliste komponentide valgustamiseks välja töötatud spetsiifilised DNA-testi.
Sissejuhatus
Geenid on DNA lõigud, mis sisaldavad juhiseid, mida organism vajab iga tuhande eluks vajaliku valgu tootmiseks. Iga geen koosneb tuhandetest "tähtede" kombinatsioonidest (mida nimetatakse alusteks), mis moodustavad teie geneetilise koodi. Kood annab juhised nõuetekohaseks arenguks ja toimimiseks vajalike valkude valmistamiseks.(1)
Geneetilised variatsioonid võivad mõjutada geeni ekspressiooni, mõjutades seeläbi ainevahetusprotsesse, mis on olulised rakkude tervise säilitamiseks ja selleks, kuidas me reageerime keskkonna sekkumistele, nagu toitumine, elustiil, toidulisandid ja ravimid.
Nende geneetiliste variatsioonide tundmine pakub ainulaadset teavet bioloogiliste süsteemide kohta, mis võimaldab tervishoiutöötajatel soovitada täpseid sekkumisi, mille eesmärk on aidata saavutada oma eesmärke ja saavutada optimaalne tervis.
Vastupidavuse geneetiliste markerite mõistmine
Vastupidavus-võime taastuda ebaõnnestumistest või muutustest või kohaneda nendega kergesti - on üha enam näha geneetika kaudu. Uurides geneetilisi markereid, püüavad teadlased ja arstid leida bioloogilisi aluseid, mis võivad selgitada, miks mõned inimesed taastuvad stressist ja traumast tõhusamalt kui teised.(2) See arenev uurimisvaldkond on keskendunud vastupidavusega seotud DNA-testidele, mis uurivad geneetilisi markereid, mis võivad olla vastutavad individuaalsete stressireaktsioonide erinevuste eest.
Selle uurimistöö keskmes on endokriinsüsteemi ja närvisüsteemi (eelkõige autonoomne närvisüsteem), mis on organismi stressile reageerimisel keskse tähtsusega. Eelkõige on keskne tähelepanu all hüpotalamuse-hüpofüüsi-neerupealise (HPA) telg, mis mängib olulist rolli organismi stressile reageerimise mehhanismi reguleerimisel. See keeruline hüpotalamuse, hüpofüüsi ja neerupealiste vaheline suhtlusvõrgustik korraldab peamiste stressihormoonide, näiteks kortisooli, tootmist ja reguleerimist.
Kortisool avaldab kaugeleulatuvat mõju paljudele kehafunktsioonidele ja vabaneb vastuseks stressile ja madalale vere glükoosisisaldusele. Normaalsetes tingimustes aitab kortisool taastada homöostaasi pärast stressiolukordi. Siiski võivad HPA-telge mõjutavad geenivariatsioonid põhjustada erinevusi kortisooli tootmises, reguleerimises ja organismist väljutamises. Need geneetilised variatsioonid võivad mõjutada inimese füsioloogilist vastupidavust - tema võimet säilitada või kiiresti taastada psühholoogiline ja füüsiline tervis pärast raskusi.(3)
Vastupidavuse DNA testid uurivad geenivariante, mis on seotud stressihormoonide retseptorite, stressihormoonide radadel osalevate valkude ja neid hormoone metaboliseerivate ensüümidega. Näiteks FKBP5 geeni variant, mis on seotud glükokortikoidiretseptori tundlikkuse reguleerimisega, mille kaudu kortisool avaldab oma mõju, võib muuta inimese stressireaktsiooni ja potentsiaalselt tema vastuvõtlikkust stressiga seotud häirete suhtes. Lisaks sellele on tähelepanu all ka geenid, mis kodeerivad neurotransmittereid - aju keemilisi sõnumitoojaid, mis aitavad kaasa meeleolu reguleerimisele ja kognitsioonile. Nende hulka kuuluvad sellised geenid nagu COMT, mis mängib olulist rolli dopamiini, naudingu ja tasu süsteemiga seotud neurotransmitteri, lagundamisel.(4)
Lisaks sellele, põletik on bioloogiline protsess, mis on tihedalt seotud stressi ja meeleoluhäiretega. Krooniline põletik, mida geneetilised variatsioonid võivad mõjutada, võib mõjutada aju funktsiooni ja käitumist.(5) Seega võib geneetiliste testidega püüda tuvastada ka põletikupõhiste tsütokiinide geenide, näiteks IL-6 ja TNF, variante, mis võivad eelsoodustada üksikisikuid pikaajalistele põletikureaktsioonidele ja mõjutada nende vaimset vastupidavust.
Nende geneetiliste markerite mõistmine on isikupärastatud sekkumiste nurgakivi. Geneetiliste eelsoodumuste tuvastamise kaudu saavad inimesed võtta ennetavaid meetmeid, et tugevdada oma vastupanuvõimet elustiili muutmise, psühholoogiliste strateegiate ja nende unikaalsele geneetilisele koostisele kohandatud ravimeetodite abil. See lähenemisviis on näide üleminekust täppismeditsiini suunas, kus üks-ühele-mõiste-mudel annab teed individuaalsemale ravile.
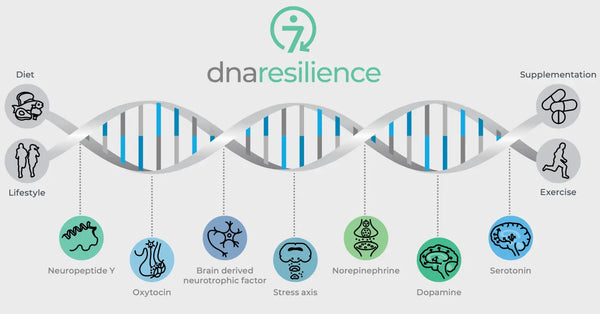
Pilt: Seitsme molekulaarse vastupanuvõime tee.
Vastupidavuse DNA-testide tüübid
1) Stressile reageerimise geenid
Stressile reageerimise geenid on meie organismi süsteemi kriitilised komponendid, mis tegelevad stressiteguritega toimetulekuga ja neile reageerimisega. Nad kodeerivad valke, mis reguleerivad erinevaid füsioloogilisi protsesse, sealhulgas stressireaktsioonis keskse tähtsusega hormooni kortisooli vabanemist ja toimet.
CRHR1 (kortikotropiini vabastava hormooni retseptor 1).
CRHR1 kodeerib kortikotropiini vabastava hormooni (CRH) retseptorit, mis on keskne hormoon, mis käivitab stressireaktsiooni. Kui CRH seondub CRHR1-ga, stimuleerib see adrenokortikotroopse hormooni (ACTH) tootmist ja vabanemist, mis paneb neerupealised tootma kortisooli. CRHR1 geeni variandid võivad mõjutada seda, kui tundlik on see retseptor CRH suhtes, mis võib muuta üldist stressireaktsiooni. Näiteks võivad mõned polümorfismid põhjustada kõrgendatud stressireaktsiooni, mis võib aidata kaasa ärevuse või depressiooni tekkimisele. Seevastu teised võivad reaktsiooni vähendada, mõjutades võimet toime tulla ägeda stressiga.(6-7)
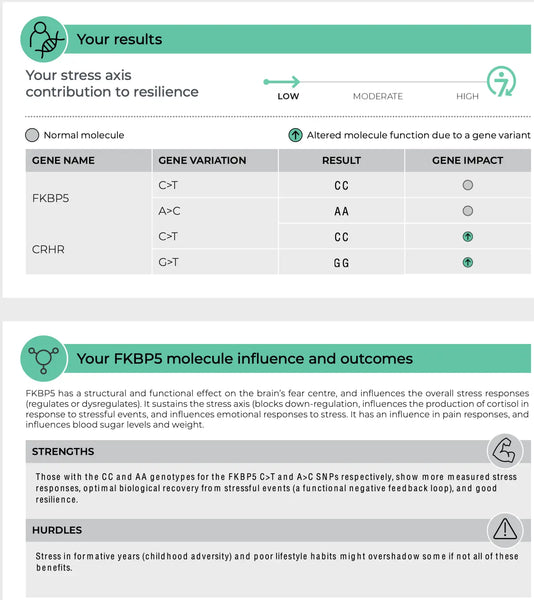
FKBP5 (FK506 seonduv valk 5)
FKBP5 geen mängib rolli glükokortikoidiretseptori tundlikkuse reguleerimisel, mis on retseptor, mille kaudu kortisool avaldab oma mõju. FKBP5 spetsiifilised polümorfismid on seotud HPA-telje muutunud tagasiside pärssimisega ja erineva reaktsiooniga glükokortikoididele. Näiteks võivad mõned FKBP5 variandid vähendada glükokortikoidiretseptori afiinsust kortisooli suhtes, mis võib viia stressivastuse halvenemiseni ja stressiga seotud psühhiaatriliste häirete, nagu PTSD või raske depressioon, suurenenud riskini.(8-9)
Pilt: Näidisleht DNA vastupidavuse test.
NR3C1 (tuumaretseptorite 3. alamperekonna C-rühma 1. liige)
NR3C1 kodeerib glükokortikoidiretseptorit ennast. Selle geeni variatsioonid võivad mõjutada seda, kuidas keha reageerib kortisoolile. NR3C1 spetsiifilised polümorfismid võivad mõjutada glükokortikoidiretseptorite tundlikkust või tihedust, mõjutades seda, kui tõhusalt kortisool suudab oma funktsioone täita. See võib põhjustada erinevaid reaktsioone, alates vaigistunud stressireaktsioonist, mis võib takistada inimest adekvaatselt reageerimast stressiteguritele, kuni liialdatud reaktsioonini, mis võib põhjustada kroonilisi stressisümptomeid ja isegi depressiooni.(10-12)
Stressireaktsiooni geenitestide tulemused võivad anda ülevaate inimese eelsoodumusest stressiga seotud terviseprobleemidele. Näiteks:
-
Kõrgendatud stressireaktsioon: Konkreetsete variantidega isikud võivad olla stressile reageerivamad ja neil võib stressiolukordades esineda kõrgem kortisoolitase.
-
Vähendatud stressireaktsioon: Seevastu mõnel inimesel võib olla nõrgem stressireaktsioon, mis võib olla kaitsev akuutsetes stressiolukordades, kuid võib ka takistada vajalike füsioloogiliste mehhanismide aktiveerimist vastuseks väljakutsetele.
2) Neurotransmitterfunktsiooni testid selgitavad
Neurotransmitterite funktsiooni testid on mõeldud selleks, et uurida geneetilisi tegureid, mis mõjutavad neurotransmitterite sünteesi, vabanemist ja lagunemist ajus. Kuna neurotransmitterid on keemilised sõnumitoojaid, mis reguleerivad meeleolu, kognitsiooni ja stressireaktsioone, võivad nende ainetega seotud geenide variatsioonid mõjutada oluliselt inimese psühholoogilist vastupidavust ja üldist vaimset tervist.
Neurotransmitterite funktsiooni uurimine vastupanuvõime ja stressireaktsiooni kontekstis ulatub kaugemale katehhoolamiinidest, nagu dopamiin. See hõlmab laiemat spektrit neurotransmitterite süsteeme, mis on seotud meeleolu reguleerimise, tähelepanelikkuse ja kognitiivsete funktsioonidega. Nende neurotransmitterite sünteesi, signaalimise ja lagundamisega on seotud mitmed geenid, sealhulgas dopamiini beeta-hüdroksülaas (DBH), dopamiini retseptorid (DRD2, DRD4) ja mitmesugused serotoniiniga seotud geenid.(13)
COMT (katekool-O-metüültransferaas).
COMT-geen on üks kõige põhjalikumalt uuritud neurotransmitterite funktsiooni kohta. See kodeerib ensüümi, mis lagundab katehhoolamiine - näiteks dopamiini, adrenaliini ja norepinefriini - neurotransmitterid, mis on kriitilise tähtsusega stressireaktsiooni, kognitsiooni ja emotsioonide reguleerimise jaoks.
COMT-geenis on tuntud polümorfismid, näiteks Val158Met-variant. See variant võib mõjutada ensüümi aktiivsuse taset erinevalt:(14-15)
- Kõrge aktiivsusega vorm (Val-variant): See ensüümi vorm lagundab dopamiini kiiremini, mis võib viia dopamiini madalama tasemeni prefrontaalses ajukoores, mis on aju piirkond, mis on seotud täidesaatva funktsiooni ja otsuste tegemisega. Selle variandiga isikud võivad stabiilsetes tingimustes ülesandeid paremini täita, kuid võivad olla stressi korral dopamiini väiksema kättesaadavuse tõttu tundlikumad kognitiivse languse suhtes.
- Madala aktiivsusega vorm (Met-variant): Seevastu COMT ensüümi see vorm metaboliseerib dopamiini aeglasemalt, mille tulemuseks on kõrgem dopamiini tase ajus. See võib parandada kognitiivseid funktsioone stressi korral, kuid võib suurendada ka stressiga seotud psühhopatoloogiate, näiteks ärevushäirete riski, kuna aju on potentsiaalselt liigse dopamiini tõttu ülestimuleeritud.
Dopamiini beeta-hüdroksülaas (DBH)
DBH on ensüüm, mis muudab dopamiini noradrenaliiniks, neurotransmitteriks, mis on seotud võitlus- või põgenemisreaktsiooniga. Geneetilised variatsioonid DBH geenis võivad mõjutada ensüümi aktiivsust, mõjutades dopamiini ja noradrenaliini taset ajus ja perifeerses närvisüsteemis.(16-18)
- Madal aktiivsus: Madalama DBH aktiivsusega seotud variandid võivad viia dopamiini kõrgema ja noradrenaliini madalama tasemeni, mis võib mõjutada kognitiivseid funktsioone, nagu tähelepanu ja otsuste langetamine, ning mõjutada seda, kuidas inimene reageerib stressile.
- Kõrge aktiivsus: Seevastu variandid, mille tulemuseks on suurem DBH aktiivsus, võivad vähendada dopamiini taset, suurendades samal ajal noradrenaliini taset, mis võib mõjutada stressireaktiivsust ja ärevust.
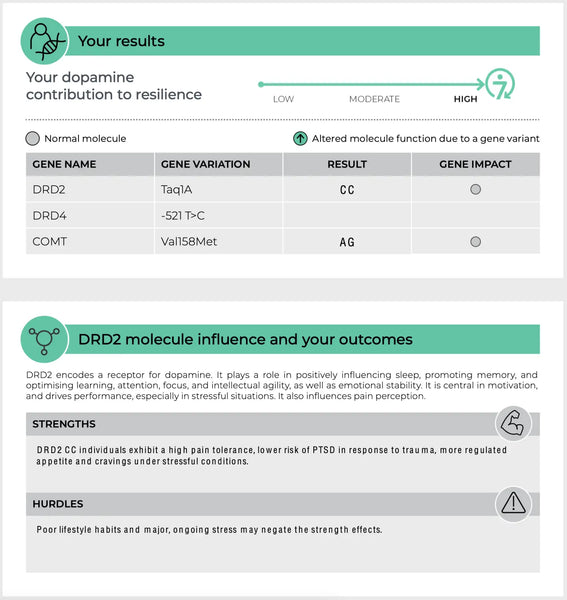
Dopamiini retseptorid (DRD2 ja DRD4)
DRD2 ja DRD4 on geenid, mis kodeerivad vastavalt dopamiini retseptoreid D2 ja D4. Need retseptorid on osa dopamiini süsteemist, mis reguleerib arvukaid funktsioone, sealhulgas meeleolu, tasu ja motoorikat (19-20)
- DRD2: DRD2 geeni variandid võivad mõjutada D2 retseptorite tihedust ja seondumisafiinsust. See võib mõjutada haavatavust stressi suhtes ja tasu saamisega seotud märguannete tõhusust, mis võib mõjutada selliseid haigusi nagu sõltuvus ja depressioon.
- DRD4: DRD4 geeni on teada, et selle kodeerivas piirkonnas on muutuv arv tandemkordusi (VNTR). Konkreetsed kordused on seotud selliste tunnustega nagu uudsuse otsimine ja tähelepanuhäirete risk. See polümorfism võib mõjutada sünaptilise dopamiini signaaliülekande tõhusust ja seda on uuritud käitumise ja psühholoogilise vastupidavuse kontekstis.
Pilt: Näidisleht DNA vastupidavuse test.
Serotoniini geenivariatsioonid
Serotoniin on veel üks oluline neurotransmitter, mis aitab reguleerida meeleolu, söögiisu ja une, mida kõiki võib stress mõjutada. Mitmed serotoniini signaalimisega seotud geenid pakuvad huvi:
- 5-HTT (SLC6A4): See geen kodeerib serotoniini transporterit, mis vastutab serotoniini tagasihaarde eest sünaptilisest lõhest. 5-HTTLPR polümorfismi selle geeni promootorpiirkonnas on uuritud seoses stressitundlikkuse ja meeleoluhäiretega.(21)
- MAOA: Monoamiini oksüdaas A geen vastutab serotoniini lagundamise eest. Selle geeni variatsioonid võivad mõjutada serotoniini taset ja neid on seostatud käitumisharjumuste ja stressi suhtes tundlikkusega.(22)
- TPH2: Trüptofaanhüdroksülaas-2 on ensüüm, mis on kriitilise tähtsusega serotoniini sünteesimisel ajus. TPH2 geneetilised variatsioonid võivad mõjutada serotoniini tootmist, mis võib mõjutada emotsionaalset reguleerimist ja stressile reageerimist.(23)
Nende testide tulemuste tõlgendamine võib olla keeruline. Näiteks ei tähenda variant, mida seostatakse stressiga seotud seisundite suurema riskiga, tingimata, et inimesel tekivad sellised seisundid, kuid see võib viidata suurenenud haavatavusele. Samamoodi ei garanteeri "vastupidavuse" variandi olemasolu kindlat vastupanuvõimet stressile, kuna keskkonnategurid ja elustiili valikud mängivad olulist rolli.
3) Põletik ja selle mõju ajule
Krooniline põletik võib kahjustada aju tervist. Arvatakse, et see aitab kaasa neurodegeneratiivsete haiguste arengule ja progresseerumisele ning võib mõjutada aju stressireaktsiooni, mis on tihedalt seotud vastupanuvõimega. Põletikuvastased tsütokiinid, nagu interleukiin-6 (IL-6) ja tuumornekroosifaktor (TNF), võivad läbida vere-aju barjääri ja suhelda meeleolu, motivatsiooni ja tähelepanelikkust reguleerivate radadega.(24)
Põletikuga seotud geenivariandid
IL-6 (interleukiin-6)
IL-6 on tsütokiin, mis mängib rolli põletikulises reaktsioonis ja on seotud erinevate bioloogiliste funktsioonidega, sealhulgas immuunvastusega, vereloomega ja luu ainevahetusega. Stressi ja vastupidavuse kontekstis on IL-6 seotud järgmisega:(25-26)
- Kõrgenenud IL-6 taset on seostatud suurema riskiga haigestuda depressiooni ja muudesse meeleoluhäiretesse.
- IL-6 geeni spetsiifilised geneetilised variandid võivad viia IL-6 suurenenud ekspressioonini, mis võib süvendada põletikuvastust ja muuta aju võimet tulla toime stressiga.
TNF (tuumorinekroosifaktor)
TNF on teine tsütokiin, mis on seotud süsteemse põletikuga. Sellel on mitmesuguseid rolle, sealhulgas immuunsüsteemi rakkude reguleerimine ning palaviku, apoptoosi ja põletiku indutseerimine.(27)
- TNF-i üleekspressiooni on seostatud erinevate krooniliste haigustega, sealhulgas reumatoidartriidi, põletikulise soolehaiguse ja psoriaasiga, samuti psühholoogilise stressi ja depressiooniga.
- TNF-geeni variandid võivad mõjutada TNF-i tootmise taset, mis võib otseselt mõjutada põletikulisi protsesse kogu kehas ja ajus.
4) Neurobioloogilised regulaatorid ja vastupanuvõimefaktorid
Geneetilised variatsioonid olulistes neurobioloogilistes regulaatorites reguleerivad ka vastupidavust stressile. Nende hulka kuuluvad oksütotsiin, ajust tulenev neurotroofiline faktor (BDNF) ja neuropeptiid Y (NPY). Oksütotsiin mängib rolli sotsiaalse käitumise ja stressireaktsioonide reguleerimisel. BDNF on oluline neuroplastilisuse ja kognitiivsete funktsioonide säilitamiseks stressi korral ning NPY moduleerib ärevust ja füsioloogilist stressireaktsiooni. Need molekulid mõjutavad üheskoos meie närvikontuuri ja psühholoogilist vastupidavust, andes ülevaate individuaalsetest erinevustest stressitaluvuses ja potentsiaalsetest võimalustest personaliseeritud biohacking strateegiate jaoks.
Oksütotsiin
Oksütotsiini nimetatakse sageli "armastushormooniks", sest see mängib rolli sotsiaalses sidemetes, emalikus käitumises ja intiimsuses. Samuti avaldab see anksiolüütilist mõju ning mõjutab sotsiaalset tunnetust ja käitumist.
- Geneetiline mõju: Oksütotsiiniretseptori geeni (OXTR) variatsioone on seostatud emotsionaalse regulatsiooni, sotsiaalse käitumise ja stressile reageerimisvõimega. OXTR-i spetsiifilised polümorfismid võivad mõjutada oksütotsiiniretseptorite sidumise tõhusust ja ekspressiooni taset, mis võib mõjutada inimese võimet stressiga toime tulla ja luua sotsiaalseid suhteid.(28)
- Mõju: Vastupidavuse testimise kontekstis võib OXTR-variantide hindamine anda ülevaate indiviidi eelsoodumusest sotsiaalsele ärevusele, empaatia tasemele ja potentsiaalsele vastupidavusele stressi suhtes, eriti mis hõlmab sotsiaalset dünaamikat.(29)
Aju tuletatud neurotroofiline faktor (BDNF)
BDNF on oluline valk, mis on seotud neuroplastilisusega, aju võimega reorganiseeruda ja moodustada uusi närviühendusi kogu elu jooksul. See on kriitilise tähtsusega õppimise, mälu ja neuronite regenereerimise jaoks.(30)
- Geneetilised variatsioonid: BDNF-i geenivariant Val66Met on üks enim uuritud polümorfisme. Met-alleeli on seostatud BDNF-i vähenenud aktiivsusest sõltuva sekretsiooniga, mis võib mõjutada kognitiivset funktsiooni ja vastupanuvõimet neuroloogilistele ja psühhiaatrilistele häiretele.(31)
- Mõju: BDNF-geeni variantide testimine võib aidata ennustada inimese neuroplastilisuse võimet stressile reageerimisel ja see võib mõjutada neuroloogilistest vigastustest või traumadest taastumist.(32)
Pilt: Näidisleht DNA vastupidavuse testi analüüs.
Neuropeptiid Y (NPY)
NPY on üks kõige sagedamini esinevatest peptiididest ajus ja osaleb stressireaktsioonide, ärevuse ja toidu tarbimise reguleerimises. Seda peetakse endogeenseks anksiolüütiliseks aineks.
- Geneetilised seosed: NPY geeni polümorfismid võivad põhjustada erinevusi NPY ekspressioonis ja sekretsioonis, mis võib mõjutada inimese stressitaluvust. Kõrgem NPY tase kaitseb üldiselt stressi mõju eest.
- Mõju NPY variantide geneetiline testimine võib potentsiaalselt näidata indiviidi stressitaluvust ja ennustada tema psühholoogilist reaktsiooni kroonilisele stressile ja traumale.(33)
Epigeneetika roll stressitaluvuse moduleerimisel
Valdkond epigeneetika uurib keerukuse kihti, mis ulatub kaugemale kui staatiline DNA järjestus. Epigeneetilised modifikatsioonid koosnevad DNA struktuuri keemilistest muutustest, nagu metülatsioon ja histoonide modifikatsioonid, mis võivad mõjutada geenide ekspressiooni, muutmata selle aluseks olevat geneetilist koodi. Need muutused on dünaamilised ja reageerivad keskkonnast tulenevatele stiimulitele, sealhulgas kroonilisele stressile. Pikaajaline stress võib põhjustada epigeneetilisi muutusi, mis mõjutavad stressireaktsioonis osalevate geenide toimimist, mis võib muuta uute stressiteguritega efektiivse toimetuleku raskemaks.(34-35)
Isikupärastatud meditsiini esirinnas olevad ettevõtted tegelevad nüüd epigeneetikaga, et selgitada välja, kuidas need muutused võivad aidata kaasa inimese suutlikkusele stressile vastu seista ja sellest taastuda. Epigeneetilisi markereid analüüsides saavad teadlased ülevaate geeniekspressiooniprofiili hetkeseisust, mis tuleneb nii geneetilisest eelsoodumusest kui ka keskkonnamõjudest. Sellised testid võimaldavad tuvastada epigeneetilisi muutusi vastuseks kroonilisele stressile, andes ülevaate molekulaarsetest mehhanismidest, mis aitavad kaasa inimese stressireaktsioonile või selle puudumisele.
Lisaks sellele avab nende epigeneetiliste muutuste mõistmine ukse personaliseeritud sekkumistele. Ebasoodsate epigeneetiliste muutuste tagasipööramiseks võib soovitada konkreetseid elustiili muutusi, toitumise kohandamist ja ravistrateegiaid. Selline personaliseeritud lähenemisviis mitte ainult ei suurenda inimese vastupanuvõimet, vaid aitab ka kaasa laiemale arusaamisele sellest, kuidas stress mõjutab meie bioloogilisi süsteeme epigeneetilisel tasandil, mis võib viia stressiga seotud häirete uute ravimeetodite ja ennetavate strateegiate väljatöötamiseni. Kaardistades stressile reageerimise epigeneetilist maastikku, saame hakata joonistama terviklikumat pilti teguritest, mis aitavad kaasa meie ainulaadsele võimele tulla toime eluliste väljakutsetega.
Vastupidavuse DNA-testide eelised ja piirangud
Need testid võivad pakkuda inimestele paremat arusaamist nende kaasasündinud vastupanuvõimest ja stressireaktsioonist. Sellised teadmised võivad anda teavet individuaalsete strateegiate kohta stressiga toimetulekuks ja vaimse tervise parandamiseks. Siiski on oluline läheneda nendele testidele ettevaatlikult:
- Complex Trait: Vastupidavust ei määra üks geen, vaid see on kompleksne tunnus, mida mõjutavad paljud geenid ja keskkonnategurid.
- Keskkonna mõju: Geneetika ei toimi isoleeritult. Elukogemused, tugisüsteemid ja elustiili valikud on vastupanuvõime puhul olulised.
- Ennustav jõud: Kuigi need testid võivad anda ülevaateid, ei ole need lõplikud ennustajad inimese võimele tulla toime eluprobleemidega.
Kokkuvõte
Vastupidavusega seotud DNA-testid kujutavad endast intrigeerivat piiritlust selle mõistmisel, kuidas meie geneetiline koostis võib mõjutada stressiga toimetulekut ja õnnetustest taastumist. Kuigi need võivad anda väärtuslikke teadmisi, tuleks neid vaadelda kui ühte osa hiiglaslikust mosaiikpildist, mis moodustab inimese vastupanuvõime. Kõigil neist testidest huvitatud isikutel on soovitatav konsulteerida tervishoiuteenuse osutaja või geneetilise nõustajaga, et tõlgendada tulemusi oma tervise ja elustiili laiemas kontekstis.
- Hankige oma Integral DNA test siit!
- Broneeri konsultatsioon oma labori- ja geenitestide tõlgendamiseks dr Sovijärvega siin.
Teaduslikud viited:
- Bobrow, M., & Grimbaldeston, A. H. (2000). Meditsiinigeneetika, inimese genoomiprojekt ja rahvatervis: Ettekanne Liverpooli Ülikoolis 9. detsembril 1996 ja avaldamiseks vastu võetud 17. veebruaril 2000. Journal of Epidemiology & Community Health, 54(9), 645-649.
- Cicchetti, D. (2010). Vastupidavus äärmusliku stressi tingimustes: mitmetasandiline perspektiiv. World psychiatry, 9(3), 145.
- Luecken, L. J., & Gallo, L. C. (Eds.). (2008). Tervisepsühholoogia füsioloogiliste uurimismeetodite käsiraamat. Sage.
- Southwick, S. M., Vythilingam, M., & Charney, D. S. (2005). Depressiooni ja stressitaluvuse psühhobioloogia: mõju ennetusele ja ravile. Annu. Rev. Clin. Psychol., 1, 255-291.
- Michaud, M., Balardy, L., Moulis, G., Gaudin, C., Peyrot, C., Vellas, B., ... & Nourhashemi, F. (2013). Proinflammatoorsed tsütokiinid, vananemine ja vanusega seotud haigused. Journal of the American Medical Directors Association, 14(12), 877-882.
- Aguilera, G., Nikodemova, M., Wynn, P. C., & Catt, K. J. (2004). Kortikotropiini vabastava hormooni retseptorid: kaks aastakümmet hiljem. Peptides, 25(3), 319-329.
- Subbannayya, T., Balakrishnan, L., Sudarshan, G., Advani, J., Kumar, S., Mahmood, R., ... & Prasad, T. K. (2013). Kortikotropiini vabastava hormooni signaalitee integreeritud kaart. Journal of cell communication and signaling, 7, 295-300.
- Binder, E. B. (2009). Glükokortikoidiretseptori ko-šaperooni FKBP5 roll afektiivsete ja ärevushäirete patogeneesis ja ravis. Psychoneuroendocrinology, 34, S186-S195.
- Ising, M., Depping, A. M., Siebertz, A., Lucae, S., Unschuld, P. G., Kloiber, S., ... & Holsboer, F. (2008). Polümorfismid FKBP5 geeni piirkonnas moduleerivad psühhosotsiaalsest stressist taastumist tervetel kontrollidel. European Journal of Neuroscience, 28(2), 389-398.
- Vitellius, G., Trabado, S., Bouligand, J., Delemer, B., & Lombès, M. (2018, juuni). Glükokortikoidide signalisatsiooni patofüsioloogia. In Annales d'endocrinologie (Vol. 79, No. 3, pp. 98-106). Elsevier Masson.
- Van West, D., Van Den Eede, F., Del-Favero, J., Souery, D., Norrback, K. F., Van Duijn, C., ... & Claes, S. (2006). Glükokortikoidiretseptori geenipõhine SNP-analüüs korduva suure depressiooniga patsientidel. Neuropsühhofarmakoloogia, 31(3), 620-627.
- Schneider, K. K., Frings, C., Meyer, J., & Schote, A. B. (2016). Glükokortikoidiretseptori geeni (NR3C1) roll aversiivsete stiimulite töötlemisel. Neuroscience Research, 107, 8-13.
- Azadmarzabadi, E., Haghighatfard, A., & Mohammadi, A. (2018). Madal vastupidavus stressile on seotud kandidaatgeeni ekspressiooni muutustega dopamiinergilises signaaliradades. Psychogeriatrics, 18(3), 190-201.
- Heinz, A., & Smolka, M. N. (2006). Katekooli O-metüültransferaasi genotüübi mõju afektiivsete stiimulite ja kognitiivsete ülesannete poolt esile kutsutud aju aktiveerimisele. Reviews in the Neurosciences, 17(3), 359-368.
- Mier, D., Kirsch, P., & Meyer-Lindenberg, A. (2010). COMT geneetilise variatsiooni pleiotroopse toime närvisubstraadid: metaanalüüs. Molecular psychiatry, 15(9), 918-927.
- Mustapic, M., Maihofer, A. X., Mahata, M., Chen, Y., Baker, D. G., O'Connor, D. T., & Nievergelt, C. M. (2014). Katehhoolamiini biosünteetiline ensüüm dopamiini β-hüdroksülaas (DBH): esimene kogu genoomi hõlmav otsing positsioone iseloomustavaid variante, mis toimivad aditiivselt proksimaalses promootoris. Human molecular genetics, 23(23), 6375-6384.
- Vincent, S., & Robertson, D. (2002). Laiem vaade: katehhoolamiini kõrvalekalded. Clinical Autonomic Research, 12, I44-I49.
- Hoenicka, J., Aragüés, M., Ponce, G., Rodríguez-Jiménez, R., Jiménez-Arriero, M. A., & Palomo, T. (2007). Dopamiinergilistest geenidest psühhiaatriliste häireteni. Neurotoksilisuse uuringud, 11, 61-71.
- Hill, S. Y., Hoffman, E. K., Zezza, N., Thalamuthu, A., Weeks, D. E., Matthews, A. G., & Mukhopadhyay, I. (2008). Dopamiinergilised mutatsioonid: Perekonnasiseseid seoseid ja seoseid mitmekordse alkoholisõltuvuse perekondades. American Journal of Medical Genetics Part B: Neuropsühhiaatriline geneetika, 147(4), 517-526.
- He, Y., Martin, N., Zhu, G., & Liu, Y. (2018). Uudsuse otsimise kandidaatgeenid: assotsiatsiooniuuringute metaanalüüs: DRD4: ekson III ja: COMT: Val158Met. Psühhiaatriline geneetika, 28(6), 97-109.
- Avula, R., Rand, A., Black, J. L., & O'kane, D. J. (2011). Mitme polümorfismi samaaegne genotüpiseerimine inimese serotoniinitransporteri geenis ja uute alleelivariantide avastamine. Translational psychiatry, 1(8), e32-e32.
- Tivol, E. A., Shalish, C., Schuback, D. E., Hsu, Y. P., & Breakefield, X. O. (1996). Inimese MAOA geeni mutatsioonianalüüs. American journal of medical genetics, 67(1), 92-97.
- Waider, J., Araragi, N., Gutknecht, L., & Lesch, K. P. (2011). Trüptofaanhüdroksülaas-2 (TPH2) kognitiivse kontrolli ja emotsioonide reguleerimise häiretes: perspektiiv. Psühhoneuroendokrinoloogia, 36(3), 393-405.
- Bauer, M. E., & Teixeira, A. L. (2021). Neuroinflammatsioon meeleoluhäiretes: regulatiivsete immuunrakkude roll. Neuroimmunomodulatsioon, 28(3), 99-107.
- Anderson, G., Kubera, M., Duda, W., Lasoń, W., Berk, M., & Maes, M. (2013). Suurenenud IL-6 trans-signalisatsioon depressioonis: keskendumine trüptofaani kataboliidi rajale, melatoniinile ja neuroprogressioonile. Farmakoloogilised aruanded, 65(6), 1647-1654.
- Perry, B. I., Upthegrove, R., Kappelmann, N., Jones, P. B., Burgess, S., & Khandaker, G. M. (2021). Immunoloogiliste valkude/tunnuste seosed skisofreenia, suure depressiooni ja bipolaarse häirega: kahesuunaline kahesuunaline mendeli randomiseerimise uuring. Aju, käitumine ja immuunsus, 97, 176-185.
- Bradley, J. (2008). TNF-vahendatud põletikuline haigus. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 214(2), 149-160.
- Loth, E., Poline, J. B., Thyreau, B., Jia, T., Tao, C., Lourdusamy, A., ... & IMAGEN Consortium. (2014). Oksütotsiiniretseptori genotüüp moduleerib ventraalset striataalset aktiivsust sotsiaalsetele vihjetele ja reageerimist stressirohketele elusündmustele. Bioloogiline psühhiaatria, 76(5), 367-376.
- Myers, A. J., Williams, L., Gatt, J. M., McAuley-Clark, E. Z., Dobson-Stone, C., Schofield, P. R., & Nemeroff, C. B. (2014). Oksütotsiiniretseptori geeni varieerumine on seotud suurenenud ärevuse, stressi ja depressiooni riskiga isikutel, kes on varases elus stressiga kokku puutunud. Journal of psychiatric research, 59, 93-100.
- Cowansage, K. K., LeDoux, J. E., & Monfils, M. H. (2010). Ajust tulenev neurotroofiline faktor: dünaamiline neuraalse plastilisuse väravavaht. Current molecular pharmacology, 3(1), 12-29.
- Chen, Z. Y., Jing, D., Bath, K. G., Ieraci, A., Khan, T., Siao, C. J., ... & Lee, F. S. (2006). Geneetiline variant BDNF (Val66Met) polümorfism muudab ärevusega seotud käitumist. science, 314(5796), 140-143.
- Phillips, C. (2017). Aju tuletatud neurotroofiline faktor, depressioon ja füüsiline aktiivsus: neuroplastilise seose loomine. Neuraalne plastilisus, 2017.
- Schmeltzer, S. N., Herman, J. P., & Sah, R. (2016). Neuropeptiid Y (NPY) ja posttraumaatiline stressihäire (PTSD): translatiivne ajakohastamine. Eksperimentaalne neuroloogia, 284, 196-210.
- Lux, V. (2016, märts). Epigeneetiline programmeerimine psühhobioloogilises arengus: Tõendid topeltaktiveerimise teooria ja varajase elustressi vahendava rolli kohta. In Qatar Foundation Annual Research Conference Proceedings Volume 2016 Issue 1 (Vol. 2016, No. 1, p. HBOP3415). Hamad bin Khalifa University Press (HBKU Press).
- Chukwuma Sr, C. (2022). Epigeneetika ja selle olemus inimese kasvu, arengu ja haiguste mõistmisel. J Med Res, 8(5), 165-172.