Mitokondrid on elutähtsad organellid, mis asuvad eukarüootiliste rakkude tsütoplasmas. Hästi toimivate mitokondrite abil toimivad kõik keha protsessid, alates liikumisest ja treeningust kuni seedimise ja taastumiseni, paremini. Nad mängivad olulist rolli energia tootmisel ja paljudes teistes rakuprotsessides. Mitokondrid pakuvad koha oksüdatiivsele fosforüülimisele, mis toodab ATP-d, raku peamist energiaallikat. Struktuuriliselt saab hinnata mitokondrite välismembraani ja kõrgelt volditud sisemembraani kaudu, mis moodustab nende ainevahetuseks vajalikke kambreid. Lisaks energiatootmisele teostavad mitokondrid lisaks apoptoosile (programmeeritud surm) ka muid tegevusi, nagu kaltsiumisignalisatsioon ja raku ainevahetuse reguleerimine, mis muudab nad raku homöostaasi säilitamiseks elutähtsaks.
Mitokondrite funktsiooni põhialused
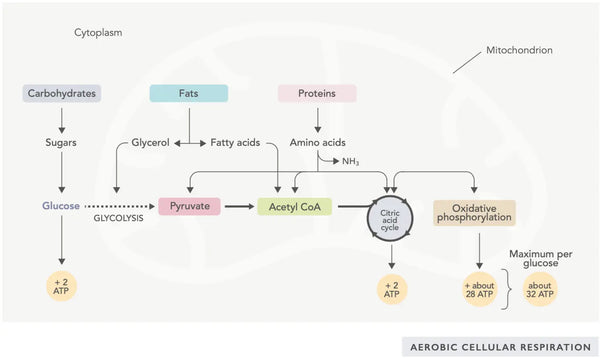
ATP tootmine (peamine rakkude poolt kasutatav energiamolekul) on mitokondrite tegevuse põhiline omadus. See protsess toimub kahe peamise biokeemilise tee kaudu: sidrunhappe tsükkel (TCA tsükkel või Krebsi tsükkel) ja elektronitranspordi ahel (ETC).
Sidrunhappe tsükkel
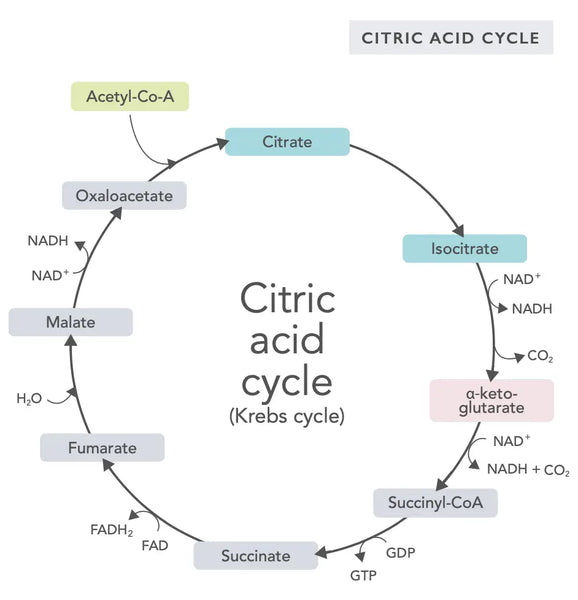
Sidrunhappe tsükkel ehk Krebsi tsükkel (mis on nimetatud selle avastanud Nobeli preemia laureaadi Hans Adolf Krebsi järgi) toimub raku mitokondrites.(1)Sidrunhappe tsükli peamine ainevahetusühend on rasvhapetest, süsivesikutest ja valkudest toodetud äädikhape (atsetüülkoensüüm A).(2)
Sidrunhappetsükli erinevate reaktsioonide käigus (vt joonis) moodustuvad vesinikuioonid ja elektronid, mis seejärel kantakse mitokondri sisemusse oksüdatiivseks fosforüülimiseks (energia sidumine ATP-molekulideks oksüdatsiooni teel) ja elektronitranspordi ahelasse. Reaktsiooni käigus vabaneb NADH ja väikesed kogused ATP-d ja süsinikdioksiidi.
Sidrunhappetsükkel hõlmab kümmet etappi, millest igaüht mõjutavad B-vitamiinid, teatavad mineraalained, nagu magneesium ja raud, ning maksa peamine antioksüdant glutatioon. Reaktsioone pärsivad raskemetallid, nagu elavhõbe, arseen ja alumiinium.
Energiarikkad NADH-molekulid püüavad enamiku sidrunhappe tsükli käigus tekkivat energiat. Iga atsetüülkoensüüm A molekuli kohta tekib kolm NADH-molekuli, mida kasutatakse energia saamiseks järgmises reaktsioonis (oksüdatiivne fosforüleerimine).
Sidrunhappetsükli regulatsiooni määravad erinevate aminohapete kättesaadavus ja tagasiside inhibeerimine (näiteks kui tekib liiga palju NADH-d, inhibeeritakse mitmeid sidrunhappetsükli ensüüme, mis aeglustab reaktsioone).
Oksaloatsetaat on ühend, mis täidab ootamatut energiatootmisvajadust (näiteks ajus või lihastes). Oksaloatsetaadi toidulisandi võtmine võib olla kasulik ja see võib isegi suurendada aju mitokondrite taastumist, vähendada vaikset põletikku organismis ja suurendada närvirakkude arvu.(3)
Lihtsalt öeldes sisaldab keha geniaalseid süsteeme, mis muudavad tarbitud toidu elektronideks, mida kasutatakse energiaks erinevateks vajadusteks.
Oksüdatiivne fosforüülimine
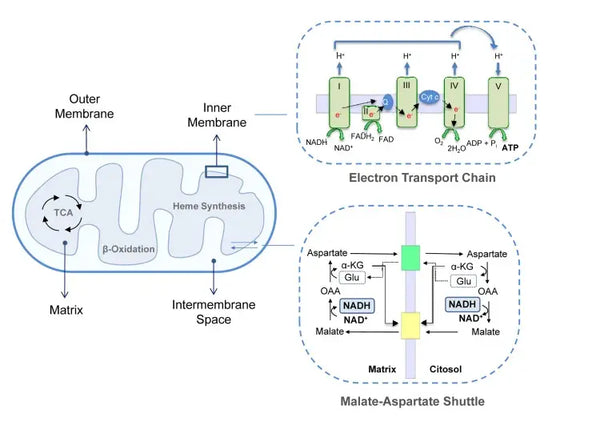
Oksüdatiivne fosforüleerimine koosneb elektronitranspordi ahelast ja ATP-süntaasist. Oksüdatiivne fosforüleerimine toodab aeroobsetes tingimustes kõige rohkem energiat (ATP). See on jätkuks sidrunhappe tsüklile.
Elektronitranspordi ahelas vabanevad vesinikioonid (H+) mitokondriaalse membraanidevahelise ruumi. Membraanidevahelisest ruumist vabanenud vesinikioonid liiguvad ATP-süntaasi kaudu tagasi mitokondrisse. Kasutades protsessi käigus vabanenud energiat, muundab ATP-süntaas energiaks kasutatud ADP taas ATP-ks.
Ubikinoon (koensüüm Q10) aitab kaasa elektronitranspordi ahelale. Seda on aastakümneid kasutatud toidulisandina. Madal rakkude ubikinooni tase võib olla erinevate haiguste soodustavaks teguriks, mis on tingitud ebapiisavast aeroobsest energiatootmisest rakkudes. Lisaks sellele on kolesterooliravimite (statiinide) kasutamine ubikinooni puudujääki soodustav tegur.(4)
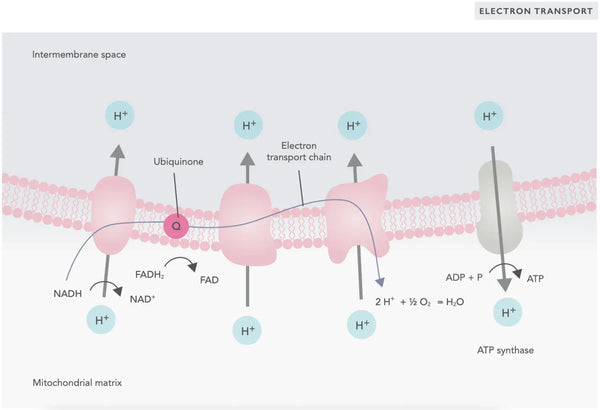
See kooskõlastatud reaktsioonide kogum toodab ATP-d ja loob prootonite gradienti üle mitokondri sisemise membraani, mis on tuntud kui kemiosmoos. Selles gradientis salvestatud energia juhib ATP sünteesi, sidudes elektronide voolu läbi ETC ja rakuenergia tootmise.(5)
Mitokondriaalse tõhususe mõjutajad
Mitokondriide tõhusust, mis on ilmselgelt oluline raku optimaalse toimimise jaoks, mõjutavad erinevad tegurid. Allpool on kirjeldatud kõige olulisemaid neist.
Geneetiline koostis
Mitokondrid omavad eraldi ja individuaalset DNA-d (mitokondriaalne DNA, mtDNA), mis erineb tuuma-DNA-st. MtDNA kodeerib elektronitranspordi ahela olulisi komponente ja mitokondriaalseid valke. Mutatsioonid mtDNAs võivad põhjustada valkude talitlushäireid, mis häirivad elektronitranspordi ahelat ja ATP sünteesi. Selle tulemuseks võib olla vähenenud energiatootmine ja suurenenud reaktiivsete hapnikuliikide (ROS) teke, mis aitab kaasa mitokondri ja rakkude talitlushäiretele.(6)
Oksüdatiivne stress
Mitokondrid on märkimisväärne ROSi allikas, mis on hapniku metabolismi kõrvalproduktid. Kuigi madal ROSi tase toimib rakkude signaalimisel, võib liigne ROS põhjustada mitokondriliste valkude, lipiidide ja DNA oksüdatiivset kahjustust. See oksüdatiivne stress kahjustab mitokondriide terviklikkust ja funktsiooni, pärsib ATP tootmist ja viib kahjuliku tsükli käigus ROSi edasise tootmiseni. Antioksüdantide, sealhulgas superoksiiddismutaasi ja glutatioonperoksidaasi kaitsevõime mängib kriitilist rolli selle kahjustuse leevendamisel.(7-8)
Toitainete kättesaadavus
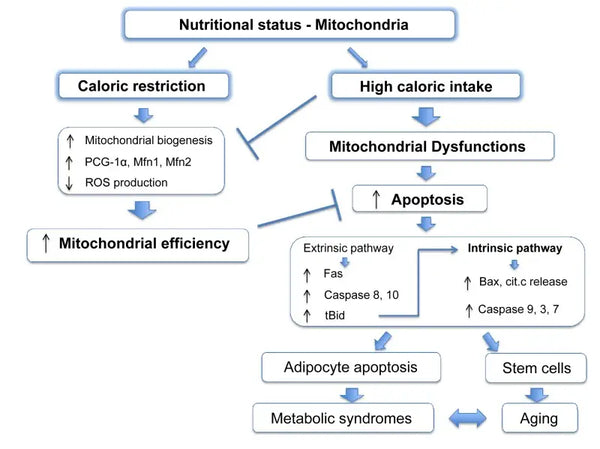
Mitokondrid vajavad energia tootmiseks spetsiifilisi substraate. Glükoos ja rasvhapped on peamised allikad ATP tootmiseks vastavalt glükolüüsi ja β-oksüdatsiooni kaudu. Nende substraatide kättesaadavus mõjutab otseselt mitokondrite funktsiooni. Näiteks toitainete ülejäägi tingimustes, näiteks glükoosi suure kättesaadavuse korral, võivad mitokondrid toota liigselt ATP-d ja ROSi, mis võib põhjustada ainevahetuse häireid.(9-10)
Seevastu toitainete nappus võib piirata mitokondriaalse energiatootmise mahtu, mis mõjutab raku funktsiooni ja ellujäämist. Vastupidiselt mõnele loomkatsete aruandele kaloripiirangu kasulikkuse kohta mitokondrite biogeneesile, näib, et see ei suurenda mitokondrite biogeneesi. Küll aga säilitab see mitokondriaalse funktsiooni, kaitstes olemasolevate rakukomponentide terviklikkust ja funktsiooni.(11-12)
Elustiili tegurid
Harjutus
Füüsiline aktiivsus mõjutab mitokondrite kvantiteeti ja kvaliteeti. Harjutus stimuleerib mitokondriaalse biogeneesi, mille tulemusel suureneb mitokondrite tihedus ja energiatootmise tõhusus.(13) Eriti vastupidavustreening suurendab mitokondrite oksüdatiivset võimekust, parandades nende võimet kasutada hapnikku ATP tootmiseks (loe lähemalt artiklist hiljem).
Toitumine
Toitumise komponendid mõjutavad oluliselt mitokondrite funktsiooni. Makrotoitainete suhe, kaloraaž ja konkreetsed toitained (nagu antioksüdandid, vitamiinid ja mineraalained) mõjutavad mitokondrite ainevahetust. Mitokondrite funktsiooni toetavaid toitaineid sisaldav toitumine võib suurendada energiatootmist ja vähendada oksüdatiivset stressi (vt hiljem). Aktiveerimine ketoosi võib samuti suurendada mitokondriaalse biogeneesi ja parandada mitokondrite tõhusust.(14-15)
Keskkonnategurid
Kokkupuude keskkonnastressoritega, nagu toksiinid, saasteained, raskemetallid (nt plii, elavhõbe, arseen ja kaadmium) ning kiirgus, võib negatiivselt mõjutada mitokondrite funktsiooni. Need stressitegurid võivad põhjustada oksüdatiivseid kahjustusi, häirida elektronitranspordi ahela aktiivsust ja kahjustada mitokondrite dünaamikat, sealhulgas fusiooni- ja fissiooniprotsesse.(16)
Tehnoloogilised sekkumised
Fotobiomodulatsioon (või punase valguse ravi)
Fotobiomodulatsioon on mitteioniseeriva fotoonienergia kasutamine fotokeemiliste muutuste esilekutsumiseks rakustruktuurides, mis on vastuvõtlikud fotoonidele, eriti mitokondrites. Arvatakse, et punase valguse ja NIR-valguse ravi toimib peamiselt fotoaktseptorite kaudu. Punase valguse lained tungivad läbi naha ja jõuavad raku mitokondritesse, suurendades rakkude energiatootmist. Selle tulemuseks on erinevad sündmused, näiteks mitokondriaalse hingamise kiirendamine tsütokroom c oksüdaasi kaudu(17). Lugege fotobiomodulatsiooni kasulikkuse kohta tervisele siit.
Infrapunasaun
Infrapunasaunades kasutatakse infrapunakiirgust, mis õhu asemel soojendab otse kehakudesid. Infrapunasaunade kiirgussagedus on 3-12 μm, mis kuulub kauginfrapunakiirguse (FIR) alla. On leitud, et infrapunavalgusel on koe tasandil mõju, eelkõige mitokondrite hingamisahelale raku energiatootmise protsessis ja kudede verevarustusele, laiendades veresooni ja parandades vereringet.(18)
Impulsselektromagnetvälja (PEMF) ravi.
PEMF-ravi kasutab elektromagnetvälju erinevate füsioloogiliste protsesside edendamiseks. Uuringud näitavad, et PEMF võib parandada mitokondrite funktsiooni, suurendades rakkude hapnikutarbimist ja tõhustades ATP tootmist. PEMF-ravi mõjutab otseselt mitokondreid, viies rakud tagasi tervislikumasse energia- ja elektrilaengusseisundisse.(19-20) Loe põhjalikku juhendit PEMF-ravi kohta siit.
Hüperbaarne hapnikuteraapia (HBOT)
HBOT hõlmab puhta hapniku sissehingamist rõhu all olevas keskkonnas. Kliiniliselt on tõestatud, et hüperbaarne hapnikuteraapia taaselustab mitokondrid ja suurendab ATP moodustamist, pakkudes raku hingamiseks vajalikku suprafüsioloogilist hapniku kogust. Hiljutises uuringus teatati, et HBO suurendas mitokondrite biogeneesi ja autofaagiat, suurendades osaliselt reaktiivsete hapnikuliikide tootmist. Selle protsessi käigus tekkisid uued terved mitokondrid ja vanad düsfunktsionaalsed mitokondrid hävitati. Selles uuringus leiti ka mitokondrite DNA transkriptsiooni ja replikatsiooni suurenenud aktiveerimine.(21-22) Lisateavet HBOTi kohta leiate siit.
Mitokondrite funktsiooni toitumis- ja toidulisandite toetamine
Toitumise roll mitokondrite tervise säilitamisel on keskse tähtsusega, kusjuures teatud toitained on eriti olulised optimaalse mitokondrite funktsiooni jaoks. Nende hulka kuuluvad järgmised allpool loetletud ained.
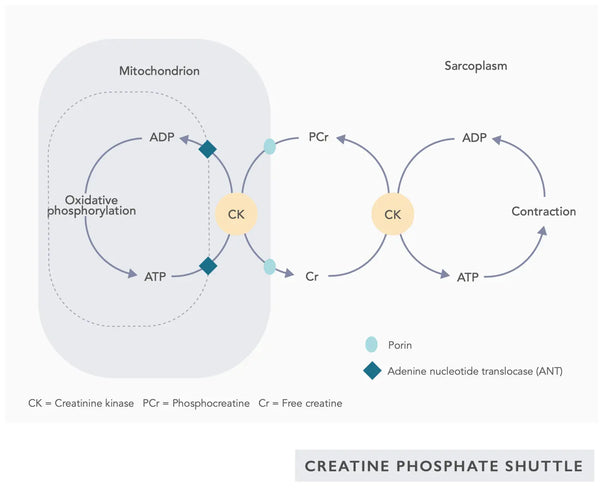
- Koensüüm Q10 (CoQ10): Ubikinoon on rasvlahustuv ja sarnaneb vitamiiniga. Ubikinoon toimib elektronikandjana elektronide ülekandeahelas mitokondrites (vt joonis paremal) ja soodustab ATP eraldumist. Ubikinooni tase väheneb erinevates kudedes vananemisega.(23)
- Magneesium: Osaleb ATP sünteesis ja on oluline mitokondrite terviklikkuse ja funktsiooni säilitamiseks.(24)
- B-vitamiinid: Sealhulgas B1 (tiamiin), B2 (riboflaviin), B3 (niatsiin), B5 (pantoteenhape), B6, B7 (biotiin) ja B12. Need B-vitamiinid on olulised mitokondriaalse energia metabolismi erinevate aspektide jaoks.(25)
- Alfa-lipoehape: ALA on võimas antioksüdant, mis aitab ka teisi antioksüdante taastada. Sellel on roll energia ainevahetuses ja see võib parandada mitokondrite funktsiooni.(26)
- Karnitiin (eriti atsetüül-L-karnitiin): Transpordib rasvhappeid mitokondritesse beeta-oksüdatsiooniks, mis on energia tootmisel ülioluline, eriti lihasrakkudes.(27)
- Kreatiin: Kreatiin on organismis looduslikult esinev ühend, mis aitab rakkude, eriti lihasrakkude energiaga varustamisel, suurendades adenosiintrifosfaadi (ATP) moodustumist. Kreatiini lisamine võib suurendada mitokondrite tõhusust, eriti kõrge intensiivsusega treeningul.(28)
- Pürrookinoliinkvinoon (PQQ): PQQ on antioksüdant, mis suurendab PGC-1 valgu sisalduse kaudu mitokondriaalse biogeneesi ja toetab mitokondriaalse funktsiooni.(29)
- Omega-3-rasvhapped (EPA ja DHA): Oomega-3-rasvad on olulised mitokondriaalse membraani voolavuse ja funktsiooni säilitamiseks. Neid leidub peamiselt kalaõlis ja rasvases kalas.(30)
- Nikotiinamiidribosiid (NR) ja Nikotiinamiidmononukleotiid (NMN): Need NAD+ lähteained on olulised mitokondrite toimimiseks ja energiatootmiseks. NR-i või NMN-i lisamine võib aidata tõsta NAD+ taset ja seega parandada mitokondrite tõhusust.(31) Lisateavet NAD+ optimeerimise kohta leiate siit.
- Kurkumiin: Kurkumiin on kurkumi aktiivne ühend. On näidatud, et see kaitseb mitokondreid oksüdatiivsete kahjustuste eest ja parandab nende funktsiooni.(32)
- Seleen: Oluline mikroelement, mis mängib rolli mitokondrite kaitsmisel oksüdatiivse stressi eest. Seleen reguleerib ka mitokondriaalse biogeneesi.(33)
Harjutus ja mitokondriaalne biogenees.
Regulaarne kehaline aktiivsus on kriitiline tegur mitokondrite biogeneesi edendamisel, mis viib uute mitokondrite tekkimiseni, suurendades seeläbi nende hulka ja funktsionaalset võimekust rakkudes. Erinevad treeningu vormid avaldavad mitokondrite dünaamikale erinevat mõju. Kaks kõige olulisemat treeningvormi on aeroobne treening ja vastupidavustreening.
Aeroobne treening
Skeletilihasrakkude mitokondriaalne tihedus suureneb märgatavalt aeroobse treeningu ajal (nt jooksmine, jalgrattasõit ja ujumine).
Mitokondriaalse biogeneesi reguleerib PGC-1α (peroksisoomi proliferaator-aktiveeritud retseptori gamma koaktivaator 1-alfa), mis on oluline regulatiivne valk, mille ekspressiooni aeroobne treening stimuleerib. PGC-1α kaasaktiveerib tuumaregulatsioonifaktorid (NRF) ja mitokondriaalse transkriptsioonifaktor A (TFAM), mis on vajalikud mtDNA transkribeerimiseks ja mitokondrite replikatsiooniks. See toob kaasa oksüdatiivse fosforüleerimise tõhususe suurenemise, parema vastupidavuse ja suurema ATP tootmise lihasrakkudes.(34)
Kõrge intensiivsusega intervalltreening (HIIT) on eriti efektiivne mitokondrite arvu ja maksimaalse hapnikutarbimise (VO2max) suurendamiseks.(35-36)
Vastupidavustreening
Mitokondrite funktsioon ja tõhusus on vastupidavustreeningu (nt raskuste tõstmine ja keharaskusharjutused) peamised eesmärgid. See käivitab muutused mitokondriaalse valgu sünteesis, suurendades praeguste mitokondrite kvaliteeti ja tõhusust. Jõutreening suurendab ka elektronitranspordi ahelate ja Krebsi tsükli ensüümide tootmist, parandades veelgi rakkude võimekust ATP sünteesiks. See võib suurendada ka mitokondrite arvu ja suurust lihasrakkudes, kuigi mitte samal määral kui aeroobne treening.(37-38)
Nende treeningviiside kombineeritud mõju mitokondrite biogeneesile ja funktsioonile rõhutab füüsilise aktiivsuse tähtsust mitokondrite tervise säilitamisel ja parandamisel. Regulaarne aeroobne ja vastupidavustreening suurendab igakülgselt rakkude mitokondrite tihedust, tõhusust ja energia metabolismi. Need kohandused on olulised sportliku soorituse jaoks ning on olulised tervise säilitamisel, haiguste ennetamisel ja mitokondriaalse düsfunktsiooniga seotud seisundite haldamisel.
Siiski tuleb märkida, et samaaegne treenimine nii jõu kui ka vastupidavuse jaoks viib väiksema kohanemiseni, kuna valgukinaasid PKB ja AMPK blokeerivad üksteise allavoolu signalisatsiooni, takistades samaaegset treeningu mõju.(39)
Mitofagia ja rakutervis
Mitofagia viitab selektiivsele autofaagia tüübile, mis mängib olulist rolli rakutingimustes, olles võimeline lagundama ainult kahjustatud või mittefunktsionaalsed mitokondrid. See mehhanism on oluline mitokondrite ja raku tervise seisukohalt, takistades mRNA-de tekkimist, mis kodeerivad defektset allüksuste kokkupanekut, säästes seeläbi edasisi kriise rakufunktsioonides ja arvukaid patoloogiaid.(40)
Kahjustatud mitokondrite kõrvaldamine mitofaagia abil aitab vähendada oksüdatiivset stressi, apoptoosi ja põletikku (mis on seotud erinevate patoloogiatega). Häiritud mitofagia soodustab düsfunktsionaalsete mitokondrite kogunemist neurodegeneratsioonihäirete, näiteks Parkinsoni ja Alzheimeri tõve patogeneesis. Samamoodi põhjustab mitofaagia kadumine ainevahetushäirete korral mitokondria metabolismi muutusi, mille tulemuseks on insuliiniresistentsus ja 2. tüüpi diabeet.(41-42)
On näidatud, et kalorite piiramine soodustab mitofaagiat. See on osaliselt tingitud sirtuiinide (SIRT1), AMP-aktiveeritud valgukinaasi (AMPK) ja transkriptsioonifaktori EB aktiveerimisest, mis toetavad nii raku energiakriisile reageerimist kui ka mitofagia käivitumist. Konkreetselt reguleerivad sirtuiinid mitofaagia masinavärgi faktorite funktsiooni, vaigistades kahjustatud mitokondrid.(43)
Kalorite piiramise molekulaarset mõju jäljendavad sellised ühendid nagu resveratrool (polüfenool punases veinis ja mõnedes marjades) ja paljud teised polüfenoolid. Resveratrool soodustab SIRT1 ja AMPK aktiveerimist, suurendades mitofaagiat, mis vastutab mitokondrite funktsiooni paranemise ja rakkude tervise taastamise eest.(44-45)
Mitofaagiat saab suurendada vahelduva paastumisega. Seda paranemist leevendab tõenäoliselt ainevahetuse üleminek glükoosipõhiselt energialt ketoonipõhisele energiale paastu ajal ja see nihe vallandab mitofaagiat (.46-47)
Mitokondriaalne düsfunktsioon kui vananemise tunnusmärk
Gerontoloogia ja rakubioloogia uuringute keskmes on arusaamine, kuidas mitokondrid vananemisprotsessis kaasa aitavad. Organismide vananedes sagenevad mitokondriide düsfunktsioonid, mis mängivad rolli vananemise füsioloogilises küljes.
Vananevad mitokondrid näitavad vähenenud ATP tootmist, mis mõjutab rakkude heaoluks vajalikke energiapõhiseid protsesse. Lisaks sellele segavad seda energiatootmise vähenemist veelgi enam vananemisega seotud struktuurimuutused mitokondrites, näiteks mitokondriaalse membraanipotentsiaali ebanormaalne koostis ja sisemiste mitokondriliste seinte terviklikkus.(48)
Seisukoht mitokondriaalse DNA (mtDNA) elektronitranspordi ahela lähedal, kus toimuvad reaktiivsed hapnikuliigid, mõjutab selle tundlikkust mutatsioonide suhtes. Aja jooksul kogunevad aga mutatsioonid, mille tulemuseks on mitokondriaalne düsfunktsioon. Erinevalt tuuma-DNA-st, mis on kaitseks seotud histoonidega ja millel on olemas mitmesugused remondimehhanismid, puudub mtDNA-l histoonide kaitsev kate ja tal puuduvad mitmesugused remondimeetodid, mistõttu ta võib kergesti kahjustuda.(49)
Rakkudes toodavad mitokondrid reaktiivseid hapnikuliike (ROS). Kuigi ROS on raku jaoks kriitiline vahend, et suhelda oma keskkonnaga ja kohandada end selles, on nende molekulide kõrge tase piiratud range kontrolliga. Liigne tootmine erinevate vanusega seotud seisundite korral põhjustab rakkude oksüdatiivset stressi. See hävitab erinevaid rakukomponente, olgu need siis valgud, lipiidid või DNA. Mitokondrid on isegi oksüdatiivsete kahjustuste peamine vastuvõtja, tekitades nõiaringi, kuna kahjustatud mitokondrid tekitavad ainult rohkem ROSi, suurendades seeläbi raku vananemist.(50-52)
Mitokondriide dünaamika on otsustava tähtsusega mitokondriide funktsiooni jaoks, mis aitab säilitada fusiooni ja lõhustumise protsessi. Vananemisega on see dünaamika siiski häiritud ja mitokondrid fusiooni asemel fragmenteeruvad. Need muutused mõjutavad mitokondrite funktsiooni ja nende positsiooni rakkudes.(53)
Mitokondriaalse funktsiooni kadumine ei ole passiivne vananemisega seotud nähtus, vaid aktiivne osaleja vanusest sõltuvate haiguste patogeneesis. Mitokondriaalne düsfunktsioon on seotud selliste haigustega nagu neurodegeneratiivsed haigused, südame-veresoonkonna haigused ja ainevahetushäired. Nende häirete puhul on vähenenud või defektne energiatootmine, suurenenud oksüdatiivne stress ja võimetus kahjustatud mitokondrite puhastamiseks olulised haiguse patogeneesis ja kulgemises.(54)
Järeldus
Mitokondriaalse tervise ja selle vananemisega kaasneva languse optimeerimine on keeruline ülesanne, kuid õnneks on meil palju võimalusi. Peamised sekkumised hõlmavad regenereerimise jaoks kriitiliste substraatide, sealhulgas koensüüm Q10, magneesiumi ja B-vitamiinide toitlustamise toetamist; regulaarset osalemist erinevates treeningdistsipliinides, et suurendada mitokondriaalse biogeneesi; ja elustiili muudatusi, nagu kalorite piiramine või vahelduv paastumine, et mõjutada mitofaagia mehhanisme.
Mitokondriaalse düsfunktsiooni kui ühe vananemisega seotud teguri tunnistamine muudab need strateegiad oluliseks rakkude tervise toetamiseks ja vananemisega seotud lagunemise vastu võitlemiseks. Integratiivsed lähenemisviisid, mis kasutavad teaduspõhiste teadmiste jõudu koos kohaldatavate elustiili muudatustega, võivad luua soodsad tingimused ennetamiseks ja mitokondriaalse kulumise aeglustamiseks, mis üldiselt teenib inimese heaolu ja pikaealisust.
Teaduslikud viited
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900-81), kaasaegse meditsiini pioneer, vahepealse ainevahetuse arhitekt. Journal of Medical Biography 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biochemistry. 5. väljaanne. Peatükk 17, Sidrunhappe tsükkel. New York: W. H. Freeman.
- Wilkins, H. et al. (2014). Oksaloatsetaat aktiveerib aju mitokondriaalse biogeneesi, tõhustab insuliinirada, vähendab põletikku ja stimuleerib neurogeneesi. Human Molecular Genetics 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Primaarne ja sekundaarne koensüüm Q10 puudulikkus: terapeutilise täiendamise roll. Nutrition Reviews 71 (3): 180–188. Ülevaade.
- Saraste, M. (1999). Oksüdatiivne fosforüülimine fin de siecle'is. Science . 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Inimese mitokondrilised tRNAd: biogenees, funktsioon, struktuurilised aspektid ja haigused. Annual Review of Genetics 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Kas mitokondrid on peamine reaktiivsete hapnikuliikide tekitaja rakkudes? Journal of Experimental Biology 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Reaktiivsed hapnikuliigid raku signalisatsioonis. American Journal of Physiology - Lung Cellular and Molecular Physiology. 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Bioenergia tootmise mehhanismid mitokondrites. Mitokondrid ja nende roll südame-veresoonkonna haigustes. 99–121.
- Bottje, W. (2019). Oksüdatiivne ainevahetus ja efektiivsus: mitokondrite õrn tasakaalustatus. Linnuteadus 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Toitainete kättesaadavus seob mitokondrid, apoptoosi ja rasvumist. Aging (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). Krooniline kaloripiirang säilitab mitokondriofunktsiooni vananemise ajal, suurendamata mitokondriobiogeneesi. Cell Metabolism 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Skeletilihaste mitokondriaalse kohanemise molekulaarsed mehhanismid treeninguga. The FASEB Journal 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Mitokondriaalse biogeneesi regulatsioon. Essays in Biochemistry 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Ketoonipõhine ainevahetusravi: kas suurenenud NAD+ on esmane mehhanism? Frontiers in Molecular Neuroscience 10: 377.
- Fowler, B. (1978). Plii, elavhõbeda, kaadmiumi ja arseeni üldine subellulaarne mõju. Environmental Health Perspectives 22:37-41.
- Hamblin, M. (2018). Mehhanismid ja mitokondriaalne redox-signalisatsioon fotomodulatsioonis. Fotokeemia ja fotobioloogia 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Kaug-infrapunakiirgus: selle bioloogiline mõju ja meditsiinilised rakendused. Fotoonika ja laserid meditsiinis. 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). Elektromagnetiline stimulatsioon suurendab osteogeensete rakkude mitokondrilist funktsiooni ja soodustab luumurru taastumist. Scientific Reports 11 (1): 19114.
- Tai, Y. et al. (2020). Magnetväljad moduleerivad ainevahetust ja soolestiku mikrobioomi korrelatsioonisPgc-1 alfa ekspressiooniga: In vitro magnetilise mitohormetilise uuringu järelmeetmed. The FASEB Journal 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). Hüperbaarse hapniku mõju mitokondriaalsele ja glükolüütilisele energia metabolismile: kaloristaasi kontseptsioon. Cell Stress and Chaperones 25 (4): 667-677.
- Chen, W. et al. (2020). Hüperbaarne hapnik kaitseb müokardi isheemia-reperfusioonikahjustuse eest mitokondrite düsfunktsiooni ja autofagia inhibeerimise kaudu. Molecular Medicine Reports 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). Uubikinooni valmistamise keerukus. Trends in Endocrinology & Metabolism. 30 (12): 929-943.
- Volpe, S. (2013). Magneesium haiguste ennetamisel ja üldises tervises. Advances in Nutrition 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O'Brien, P. (2006). Mitokondriaalne funktsioon ja toksilisus: B-vitamiinide perekonna roll mitokondriaalse energia metabolismis. Chemico-biological Interactions 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Lipoehappe metabolism ja mitokondriaalne redoksregulatsioon. Journal of Biological Chemistry 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Karnitiin inimese lihaste bioenergeetikas: kas karnitiini lisamine võib parandada füüsilist koormust? Molecules 25 (1): 182.
- Wax, B. et al. (2021). Kreatiin treeningu ja spordi soorituse jaoks, koos taastumise kaalutlustega tervete populatsioonide jaoks. Nutrients 13 (6): 1915.
- Hwang, P. et al. (2020). Pürrolokinoliinkvinooni (PQQ) lisamise mõju aeroobse treeningu sooritusele ja mitokondriaalse biogeneesi indeksitele treenimata meestel. Journal of the American College of Nutrition 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Mitokondriaalse membraani koostise ja bioenergeetika mõjutamine omega-3 toidulisandi abil. The Journal of Physiology 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). Nikotiinamiidribosiid suurendab inimese vananenud skeletilihase NAD + metaboloomi ja indutseerib transkriptoomilisi ja põletikuvastaseid signatuure. Cell Reports 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Kurkumiin, mitokondriaalne biogenees ja mitofagia: hiljutiste andmete uurimine ja tulevaste vajaduste näitamine. Biotehnoloogia edusammud 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Seleen, mikrotoitaine, mis moduleerib südame-veresoonkonna tervist redoks-ensümoloogia kaudu. Nutrients 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). PGC-1α, mitokondriaalse biogeneesi sõlmpunkti regulaatori reguleerimine. The American Journal of Clinical Nutrition 93 (4): 884S-890S.
- Helgerud, J. et al. (2007). Aeroobsed kõrge intensiivsusega intervallid parandavad VO2maxi rohkem kui mõõdukas treening. Medicine and Science in Sports and Exercise 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Sarnased metaboolsed kohandused treeningu ajal pärast väikese mahuga sprindiintervalltreeningut ja traditsioonilist vastupidavustreeningut inimestel. Journal of Physiology 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Vastupidavus- ja vastupidavustreeningu erinev mõju toitunud olekus signaalmolekulide fosforüülimisele ja valgusünteesile inimese lihastes. The Journal of Physiology 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Vastupidavustreening muudab inimese skeletilihaste mitokondrilist funktsiooni. Medicine and Science in Sports and Exercise 47 (9): 1922-1931.
- Baar, K. (2006). Treening vastupidavuse ja jõu saavutamiseks: õppetunnid rakusignalisatsioonist. Medicine & Science in Sports & Exercise 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Mitofaagia teed mitokondrite kvaliteedikontrolliks ja puhastamiseks. Cell Death & Differentiation 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitokondrid ja autofaagia-põletik-rakusurm-telg organismi vananemisel. Science . 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitofagia: Paljutõotav terapeutiline sihtmärk neuroprotektsiooniks vananemise ja vanusega seotud haiguste ajal. British Journal of Pharmacology 180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Kaloripiirang: kas AMPK on võtmeandur ja efektor? Physiology 26 (4): 214-224.
- Um, J. et al. (2010). AMP-aktiveeritud valgukinaasi puudulikud hiired on resistentsed resveratrooli metaboolse mõju suhtes. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Viinamarjast saadud antioksüdandi vananemisvastaseid omadusi reguleerib mitokondriaalse fusiooni ja lõhustumise tasakaal, mis viib mitofaagia vallandumiseni, mida vallandab Sirt1-Sirt3-Foxo3-PINK1-PARKINi signaalvõrgustik. Oksüdatiivne meditsiin ja rakkude pikaealisus 2014: 345105.
- Longo, V. & Panda, S. (2016). Paastumine, ööpäevased rütmid ja ajaliselt piiratud toitumine terves elueas. Cell Metabolism 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I& Sahebkar, A. (2020). Paastumise või kalorite piiramise mõju mitofaagia indutseerimisele: kirjanduse ülevaade. Journal of Cachexia, Sarcopenia and Muscle 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Oksüdatiivne stress, mitokondriaalse DNA mutatsioon ja antioksüdantsete ensüümide kahjustus vananemisel. Experimental Biology and Medicine 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). mtDNA mutatsioonid ja nende roll vananemises, haigustes ja kohtuteaduses. Aging and Disease 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Reaktiivsete hapnikuliikide tekitamine mitokondrite poolt. Antioksüdandid 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Reaktiivsed hapnikuliigid ja mitokondrid: Rakulise homöostaasi sõlmpunkt. Redox Biology 6: 472-485.
- Correia-Melo, C. et al. (2016). Mitokondrid on vajalikud vananemisprotsessi fenotüübi pro-vananemise tunnuste jaoks. The EMBO Journal 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Mitokondriaalse fusiooni ja lõhustumise valgud kui uued terapeutilised sihtmärgid kardiovaskulaarsete haiguste raviks. European Journal of Pharmacology 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitofagia: esilekerkiv roll vananemises ja vanusega seotud haigustes. Frontiers in Cell and Developmental Biology. 8: 200.