Tudo o que precisa de saber sobre o envelhecimento e os processos anti-envelhecimento. Como reverter o envelhecimento? Quais são as 9 caraterísticas do envelhecimento? Leia mais para descobrir!
Em 2013, Carlos López-Otín e os seus colegas publicaram um artigo inovador, onde tentaram identificar e categorizar as marcas celulares e moleculares do envelhecimento. Eles propuseram nove marcas candidatas que são geralmente consideradas como contribuindo para o processo de envelhecimento e que, em conjunto, determinam o fenótipo do envelhecimento. López-Otín et al. definiram que, idealmente, uma marca deve preencher os três critérios seguintes: deve manifestar-se durante o envelhecimento normal, o seu agravamento experimental deve acelerar o envelhecimento e a sua melhoria experimental deve retardar o processo de envelhecimento normal e, consequentemente, aumentar o tempo de vida saudável.
As nove caraterísticas originais do envelhecimento
A chave para retardar ou mesmo inverter o envelhecimento não se baseia apenas na ideia de aumentar o tempo de vida, mas tempo de saúde (o período de vida passado em boa saúde, livre das doenças crónicas e incapacidades do envelhecimento). Até à data, não se verificou uma compressão tão grande da morbilidade porque reduzimos mais a mortalidade do que prevenimos a morbilidade. O tempo de vida saudável (ter anos de vida saudáveis) aumentará quando a morbilidade (a condição de sofrer de uma doença ou de um problema de saúde) for reduzida, mais eficazmente através do aumento da idade de início da doença.
Envelhecimento bem sucedido e saudável pode ser definido da seguinte forma:
- Baixa probabilidade de doença ou incapacidade
- Elevada capacidade cognitiva e física
- Envolvimento ativo na vida
As nove caraterísticas do envelhecimento propostas estão agrupadas em três categorias:
- 1. Caraterísticas primárias (causas de danos)
- Os factores desencadeantes cujas consequências nefastas se acumulam progressivamente com o tempo. Todas inequivocamente negativas.
- 2. Caraterísticas antagónicas (respostas aos danos)
- Efeitos opostos aos das caraterísticas primárias. Em níveis baixos, medeiam efeitos benéficos, mas em níveis elevados, tornam-se deletérios (por exemplo, senescência).
- 3. Caraterísticas integrativas (responsáveis pelo fenótipo)
- O resultado final dos dois grupos de caraterísticas anteriores é a acumulação de danos que não podem ser compensados pelos mecanismos homeostáticos dos tecidos. Estes são, em última análise, responsáveis pelo declínio funcional associado ao envelhecimento.
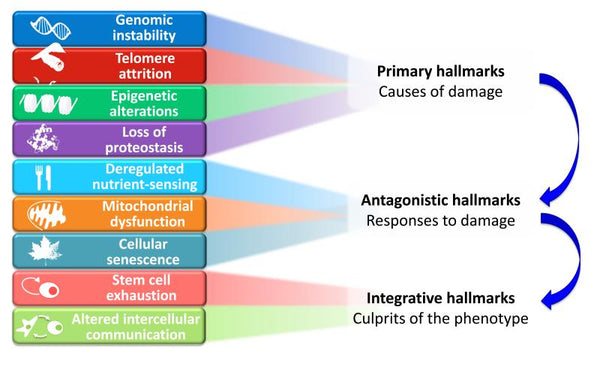
Imagem: Interligações funcionais entre as caraterísticas do envelhecimento.
Fonte: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). As marcas do envelhecimento. Células 153 (6): 1194–1217.
1. Instabilidade genómica
A integridade e a estabilidade do ADN são continuamente postas em causa por agentes físicos, químicos e biológicos externos, bem como por ameaças internas, que incluem erros de replicação do ADN, reacções hidrolíticas espontâneas e a produção de espécies reactivas de oxigénio. Estes factores acabam por conduzir ao acumulação de danos genéticos ao longo da vida.
Formas de melhorar a estabilidade genómica (Ponto de Interesse #1):
- Micronutrientes antioxidantes (selénio, zinco, vitamina C, vitamina E) -> limitam as lesões do ADN
- Corrige mesmo as deficiências ligeiras de folato, vitamina B12, niacina e zinco -> impacto significativo na taxa de danos espontâneos nos cromossomas
- Ganoderma lucidum (reishi) glucanos
- Polifenóis -> eliminam os radicais livres
- Exercício moderado e "auto-regulado
- Evitar o seguinte:
- Exposição a radiações e produtos químicos
- Exposição a metais pesados
- Níquel, cádmio e arsénico, em particular
- Fumar cigarros
- Estar sentado demasiado tempo
- Consumo excessivo de álcool, bebidas energéticas e leite
2. Atrofiamento dos telómeros
Telómeros são particularmente susceptíveis à deterioração relacionada com a idade. O encurtamento dos telómeros é observado durante o envelhecimento normal tanto em humanos como em ratos. Os telómeros são ligados por um complexo multiproteico chamado shelterinque impede o acesso das proteínas de reparação do ADN aos telómeros (sem este complexo, os telómeros seriam "reparados" como quebras de ADN que conduziriam a fusões cromossómicas). Os danos no ADN dos telómeros são notavelmente constantes e altamente eficazes na indução da senescência.
Formas de reduzir encurtamento dos telómeros (Marcador #2):
- Aumentar a ingestão de antioxidantes na dieta
- Consumo elevado de ácidos gordos ómega 3, em particular
- Otimizar vitamina Dvitamina B12, e folato níveis no sangue
- Dieta mediterrânica
- Evitar os seguintes alimentos:
- Fumar
- Obesidade
- Exposição a toxinas e poluição
- Equilibrar os níveis de stress
- Equilibrar a rotina de exercícios e as sessões intensas de exercício
- Meditação da bondade amorosa & meditação da atenção plena prática (e meditação em geral)
- Oxigenoterapia hiperbárica (HBOT)
- Ervas Gynostemma, gotu kola e astragalus (possivelmente eficaz)
- O que não funciona: restrição calórica a longo prazo
3. Alterações epigenéticas
Muitos tipos de alterações epigenéticas afectam todas as células e tecidos ao longo da vida (causadas por factores como a alimentação, os produtos químicos, os medicamentos, a luz solar, o calor/frio, o exercício físico, etc.). As alterações epigenéticas pressupõem alterações em padrões de metilação do ADN, modificação pós-traducional das histonas e remodelação da cromatina.Membros da família sirtuína de proteínas desacetilases dependentes de NAD e ADP ribosiltransferases têm sido amplamente estudados como potenciais factores anti-envelhecimento - nos seres humanos, pelo menos três membros da família das sirtuínas, SIRT1, SIRT3 e SIRT6, contribuem para um envelhecimento saudável.
Formas de gerir alteração epigenética (Hallmark #3):
- Otimizar as vias de metilação (folato, B12, B6, TMG)
- Activadores das vias da sirtuína (SIRT1, SIRT3, SIRT6):
- Espermidina (inibe as histonas desacetilases)
- Restrição calórica intermitente e jejum intermitente
- Exercício regular (intenso)
- Otimização do sono (a perda de sono provoca alterações epigenéticas prejudiciais)
- Metformina (os efeitos secundários são a advertência); de preferência (di-hidro)berberina
- Alfa-cetoglutarato (CaAKG)
- Obter regularmente doses horméticas de calor, frio, luz solar, etc. ("o veneno está na dose")
- Medicamentos epigenéticos em desenvolvimento que têm como alvo a DNA metiltransferase, a histona desacetilase, a histona metiltransferase e a cromatina
Suplementos recomendados:
Purovitalis Liposomal Quercetin
Purovitalis Liposomal Resveratrol
4. Perda de proteostase
A proteostase inclui mecanismos para a estabilização de proteínas corretamente dobradas (especialmente a família de proteínas de choque térmico) e mecanismos para a degradação das proteínas pelo proteasoma ou pelo lisossoma. Vários estudos demonstraram que a proteostase é alterada com o envelhecimento levando à expressão crónica de proteínas desdobradas, mal dobradas ou agregadas. Estas contribuem para o desenvolvimento de algumas doenças degenerativas relacionadas com a idaderelacionadas com a idade, como a doença de Alzheimer.
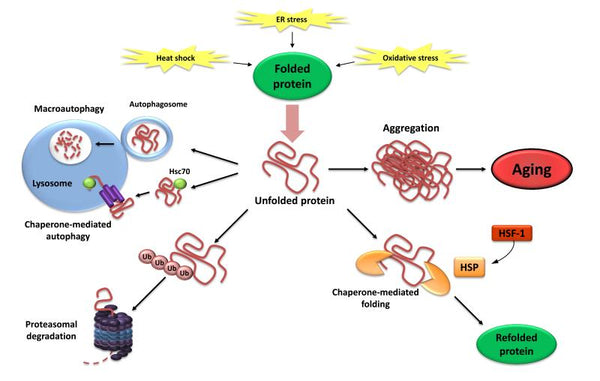
Imagem: Perda de Proteostase. A incapacidade de redobrar ou degradar as proteínas desdobradas pode levar à sua acumulação e agregação, resultando em efeitos proteotóxicos.
Fonte: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). As marcas do envelhecimento. Células 153 (6): 1194–1217.
Formas de melhorar a estabilidade da proteostase (Hallmark #4):
Em geral, a melhor maneira de proteger o corpo contra a perda de proteostase é ativar a autofagia.
- Jejum, restrição calórica intermitente (a longo prazo não é útil!), cetose, exercício físico (em jejum é o melhor), treino de resistência, frio & exposição ao calorsono profundo (e melatonina)
- Sulforafano, café, curcumina, polifenóis, EVOO, resveratrol, chá verde, espermidina
- Nutrientes e suplementos senolíticos:
- Quercetina, fisetina, luteolina, curcumina, piperlongumina, hidrogénio molecular (H2) etc.
- Activadores da AMPK:
- Berberina (DHB ainda melhor), resveratrol (e pterostilbeno), hesperidina, ginsenósidos, quercetina, curcumina, naringenina, ginostemma, crocina (no açafrão), ácido salvianólico B, ácido alfa-lipóico, etc.
- Metformina e rapamicina (Nb. posefeitos secundários possíveis)
- Indutores de Hsp70 (proteína de choque térmico 70):
- Sauna e exposição ao calor
- Shikonin (das raízes da planta shikonin)
- Medicamentos senolíticos específicos (como o Dasatinib e o Navitoclax)
5. Deteção desregulada de nutrientes
A sinalização do IGF-1 e da insulina é conhecida como a via IISque é a via de controlo do envelhecimento mais conservada na evolução. Para além da via IIS que participa na deteção da glicose, existem três sistemas adicionais relacionados e interconectados de deteção de nutrientesmTOR (deteção de concentrações elevadas de aminoácidos), AMPK (deteção de estados de baixa energia através da deteção de níveis elevados de AMP) e sirtuínas (deteção de estados de baixa energia através da deteção de níveis elevados de NAD+). Em resumo, há fortes indícios de que sinalização anabólica (mTOR, insulina elevada) acelera o envelhecimento e a diminuição da sinalização de nutrientes (AMPK, insulina baixa) prolonga a longevidade.
Formas de gerir a deteção desregulada de nutrientes (Hallmark #5):
Na prática, todas as formas anteriores de gerir os sinais distintivos 1-4 são abrangidas pela sensibilização e re-regulação da deteção de nutrientes. Estas incluem:
- restrições alimentares
- ativação da AMPK
- ativação da sirtuína
- hormese
- redução do stress oxidativo e da inflamação
- aumento da autofagia
6. Disfunção mitocondrial
Verificou-se que a disfunção mitocondrial aumenta o processo de envelhecimento. Quando um organismo envelhece, a eficácia da cadeia de respiração das células diminui, o que leva à fuga de electrões e à redução da produção de ATP. A eficiência reduzida da bioenergética mitocondrial com o envelhecimento pode resultar de múltiplos mecanismos que se intersectamincluindo biogénese reduzida das mitocôndrias, acumulação de mutações e deleções no mtDNA, stress oxidativo nas proteínas mitocondriais, desestabilização da cadeia respiratória, alterações na composição lipídica das membranas mitocondriais e alterações na dinâmica mitocondrial.
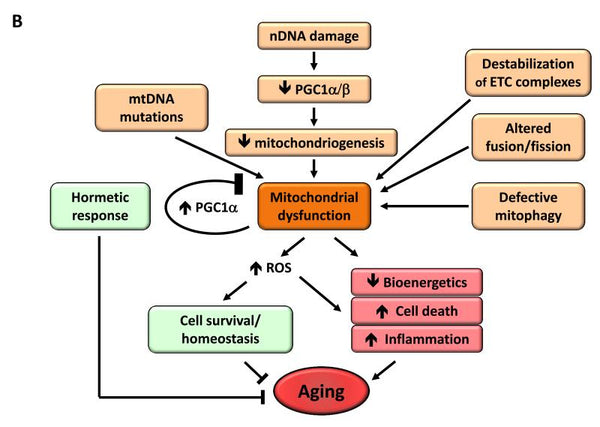
Imagem: A disfunção mitocondrial e o seu efeito no envelhecimento.
Fonte: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). As marcas do envelhecimento. Cell 153 (6): 1194–1217.
Formas de gerir a disfunção mitocondrial (Ponto de referência #6):
- Ativar a mito-hormose com:
- Restrição calórica intermitente
- Jejum intermitente
- Exercício físico
- Exposição ao frio
- Fitonutrientes (como os flavonóides)
- Visam a via Nrf2 (homeostase e integridade estrutural) com:
- Exposição ao calor e ao frio
- Exercício físico
- Jejum intermitente e cetose
- Sulforafano, polifenóis, quercetina, curcumina, etc.
- Hidrogénio molecular (H2) -> recomendação de produtos
- Melhorar a biogénese e a reparação mitocondrial (ativação do PGC-1α):
- Exercício físico
- Cetose e corpos cetónicos
- Acetil-L-carnitina
- Polifenóis, quercetina
- Rhodiola rosea (salidrósidos)
- Coenzima Q10, pirroloquinolina quinona (PQQ), mononucleótido de nicotinamida (NMN), ácido alfa-lipóico (ALA)
7. Senescência celular
Uma vez que o número de células senescentes aumenta com o envelhecimento, tem-se pressuposto que a senescência contribui para o envelhecimento. No entanto, a senescência é necessária para evitar que a distribuição e a proliferação de células danificadas desencadeiem uma resposta do sistema imunitário. Este ponto de controlo celular requer um sistema de substituição celular eficiente que envolve tanto a eliminação de células senescentes como a mobilização de células progenitoras para restaurar o número ideal de células. As células senescentes expressam alterações substanciais no seu secretoma, que é particularmente enriquecido em citocinas pró-inflamatórias e metaloproteinases da matriz. É por isso referido como o "fenótipo secretor associado à senescência".
Formas de combater a senescência celular (Hallmark #7):
As células senescentes acabam por deixar de se multiplicar, mas não morrem quando deveriam, como acontece com as células normais. Em vez disso, permanecem e continuam a libertar substâncias químicas que podem desencadear inflamações e respostas imunitárias.
Compostos senolíticos que visam seletivamente as células senescentes incluem:
- Fisetina (também chamado "o último senolítico")
- Quercetina
- Teaflavinas
- Apigenina
- Tocotrienóis (forma de vitamina E)
- Piperlongumina
- Hidrogénio molecular (H2)
8. Esgotamento das células estaminais
As células estaminais adultas são capazes de se auto-renovar e de se diferenciar em vários tipos de células num tecido. Embora os fenótipos e os mecanismos variem muito, todas as populações de células estaminais diminuem de função com a idade. A depleção de células estaminais é a consequência unificadora de vários danos associados ao envelhecimento e constitui provavelmente um dos principais responsáveis pelo envelhecimento celular. Estudos realizados em ratos idosos revelaram uma diminuição global da atividade do ciclo celular das células estaminais hematopoiéticas (HSCs)que se correlaciona com a acumulação de danos no ADN e sobreexpressão de proteínas inibidoras do ciclo celular (por exemplo, p16INK4a). O encurtamento dos telómeros também foi considerado uma causa importante do declínio das células estaminais no envelhecimento.
Formas de contrariar o esgotamento das células estaminais (Hallmark #8):
- Terapia com células estaminais (autóloga vs alogénica e vários tipos de células)
- As terapias com células estaminais são ainda um "oeste selvagem" - existem potenciais efeitos secundários e riscoscomo o crescimento de tumores e cancro.
- Fotobiomodulação ("terapia da luz vermelha")
- A PBM estimula diferentes tipos de células estaminais para aumentar a sua migração, proliferação e diferenciação in vitro e in vivo.
- Restaura as células estaminais envelhecidas através da eliminação de metabolitos tóxicos:
- Ativar as sirtuínas - SIRT1 e SIRT 3 (ver nº 3 e nº 4)
- N-acetilcisteína (NAC)
- Melhora a estabilidade da proteostase (ver nº 4)
- Melhorar a função mitocondrial (ver #6)
- Utilizar senolíticos (ver #7)
- Restaurar a memória epigenética (ver #3)
- Otimizar os níveis de vitamina D
- Spirulina (estudo in vitro)
9. Alteração da comunicação intercelular
O envelhecimento celular ocorre também ao nível da comunicação intercelular. Estas incluem a sinalização neuro-hormonal (aumento das reacções inflamatórias), a vigilância imunitária (agentes patogénicos e células pré-malignas) e as alterações do ambiente extracelular. O envelhecimento devido à inflamação é designado por inflammaging. Pode resultar de múltiplas causas, tais como a acumulação de lesões tecidulares pró-inflamatórias, a incapacidade de um sistema imunitário disfuncional para eliminar eficazmente os agentes patogénicos e as células hospedeiras disfuncionais e a ocorrência de uma resposta autofágica deficiente. As alterações do envelhecimento num tecido podem levar à deterioração específica do envelhecimento do tecido vizinho: as células senescentes induzem a senescência nas suas células adjacentes através de contactos célula-célula mediados por junções de hiato e de processos que envolvem espécies reactivas de oxigénio. Este fenómeno é também designado por efeito espetador das células senescentes.
Formas de melhorar imunicação intercelular (Ponto de Interesse #9):
- Reduzir a inflamação geral no corpo
- Um estilo de vida global anti-inflamatório
- Utilizar hidrogénio molecular (H2)
- Múltiplos efeitos anti-envelhecimento no organismo (incluindo a redução da inflamação)
- Diminuição do stress oxidativo no organismo e redução das espécies reactivas de oxigénio (ROS)
- Aumentar a autofagia no organismo (ver anteriormente)
- Tratar a disbiose intestinal e melhorar a diversidade e a saúde geral do microbiota intestinal
- Tratar a possível síndrome do intestino permeável
10. Rigidez da matriz extracelular (ECM)
Para além destas nove caraterísticas do envelhecimento definidas em 2013, há uma décima caraterística em gestação. Dois investigadores, Alexander Fedintsev e Alexey Moskalev, publicaram um artigo em 2021 que analisa mais de perto a rigidez da matriz extracelular (MEC): a acumulação de ligações cruzadas entre moléculas de longa duração, como o colagénio e a elastina. Sugerem que o endurecimento da MEC é causado por reacções químicas não enzimáticas de glicação, carbamilação e carbonilação e que pode mesmo ser a causa a montante de várias caraterísticas aceites do envelhecimento, como a senescência celular. Estas alterações conduzem à formação de aductos e ligações cruzadas que, por sua vez, causam inflamação, fibrose, perturbação do relógio circadiano dos tecidos, envelhecimento das células estaminais, etc. Foi previamente estabelecido que os produtos finais de glicação avançada (AGEs) têm um significado patogénico para vários tecidos e vias do organismo. Os organismos com uma longevidade extraordinariamente longa (como as baleias-baleia) têm taxas excecionalmente baixas de acumulação de AGEs.
Potenciais terapêuticas para a rigidez da matriz extracelular (ECM) (Hallmark #10):
Nos músculos esqueléticos humanos, o comprometimento funcional relacionado com a idade deve-se ao aumento da rigidez da MEC, causado principalmente pela acumulação de colagénio.
- Terapia manual e pressão mecanicista
- Terapia osteopáticaacupunctura, libertação miofascial
- Uma combinação de tratamentos sintéticos e inibidores naturais de AGE que actuam em sinergia em diferentes fases da formação
- Os produtos naturais incluem a carnosina, o ácido alfa-lipóico, a taurina, a vitamina C, a benfotiamina e a piridoxamina -> recomendação de produtos
- Polifenóis, terpenóides e polissacáridos
- Reduzir também a ingestão de produtos finais de glicação avançada nos alimentos
- Estimular a elastogénese (novos medicamentos?)
- Antagonistas RAGE (recetor de produtos finais de glicação avançada) [diferentes péptidos]
///







