Tutto quello che c'è da sapere sull'invecchiamento e sui processi anti-invecchiamento. Come invertire l'invecchiamento? Quali sono i 9 segni distintivi dell'invecchiamento? Continuate a leggere per scoprirlo!
Nel 2013, Carlos López-Otín e i suoi colleghi hanno pubblicato un documento innovativo in cui hanno cercato di identificare e classificare i segni distintivi cellulari e molecolari dell'invecchiamento.. Hanno proposto nove caratteristiche candidate che generalmente si ritiene contribuiscano al processo di invecchiamento e che insieme determinano il fenotipo dell'invecchiamento. López-Otín et al. hanno definito che un segno distintivo dovrebbe idealmente soddisfare i tre criteri seguenti: dovrebbe manifestarsi durante il normale invecchiamento, il suo aggravamento sperimentale dovrebbe accelerare l'invecchiamento e il suo miglioramento sperimentale dovrebbe ritardare il normale processo di invecchiamento e quindi aumentare la durata della vita in buona salute.
I nove segni originali dell'invecchiamento
La chiave per rallentare o addirittura invertire l'invecchiamento non si basa sull'idea di aumentare solo la durata della vita, ma l'apertura della salute (il periodo di vita trascorso in buona salute, senza le malattie croniche e le disabilità dell'invecchiamento). Finora non c'è stata una grande compressione della morbilità perché abbiamo ridotto la mortalità più di quanto abbiamo prevenuto la morbilità. L'healthspan (avere anni di vita in buona salute) aumenterà quando la morbosità (la condizione di soffrire di una malattia o di una condizione medica) sarà diminuita, più efficacemente attraverso l'innalzamento dell'età di insorgenza.
Invecchiamento sano e di successo può essere definito come segue:
- Bassa probabilità di malattia o disabilità
- Elevata capacità di funzionamento cognitivo e fisico
- Impegno attivo nella vita
I nove segni distintivi dell'invecchiamento proposti sono raggruppati in tre categorie:
- 1. Caratteristiche primarie (cause di danno)
- I fattori scatenanti le cui conseguenze dannose si accumulano progressivamente nel tempo. Tutte inequivocabilmente negative.
- 2. Caratteristiche antagoniste (risposte al danno)
- Effetti opposti a quelli dei segni distintivi primari. A bassi livelli, mediano effetti benefici, ma ad alti livelli diventano deleteri (ad esempio, la senescenza).
- 3. Caratteri distintivi integrativi (responsabili del fenotipo)
- Il risultato finale dei due precedenti gruppi di segni distintivi e l'accumulo di danni che non possono essere compensati dai meccanismi omeostatici dei tessuti. Questi sono in ultima analisi responsabili del declino funzionale associato all'invecchiamento.
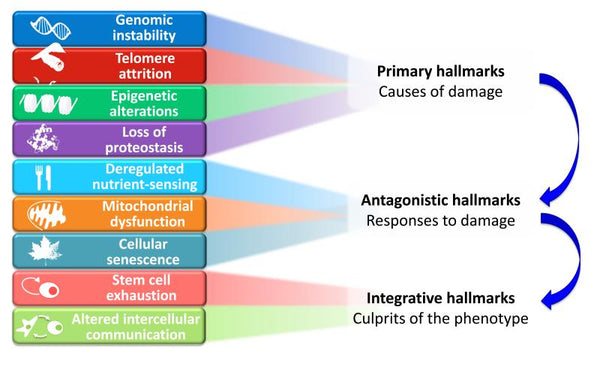
Immagine: Interconnessioni funzionali tra i segni distintivi dell'invecchiamento.
Fonte: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). I tratti distintivi dell'invecchiamento. Cellula 153 (6): 1194–1217.
1. Instabilità genomica
L'integrità e la stabilità del DNA sono continuamente messe a dura prova da agenti fisici, chimici e biologici esterni, oltre che da minacce interne, tra cui errori di replicazione del DNA, reazioni idrolitiche spontanee e produzione di specie reattive dell'ossigeno. Questi fattori finiscono per portare al accumulo di danni genetici nel corso della vita.
Modi per migliorare la stabilità genomica (Hallmark #1):
- Micronutrienti antiossidanti (selenio, zinco, vitamina C, vitamina E) -> limitano le lesioni del DNA
- Risolve anche lievi carenze di folati, vitamina B12, niacina e zinco -> impatto significativo sul tasso di danno cromosomico spontaneo
- Ganoderma lucidum (reishi) glucani
- Polifenoli -> eliminano i radicali liberi
- Esercizio moderato e "autoregolato"
- Evitare quanto segue:
- Esposizione a radiazioni e sostanze chimiche
- Esposizione a metalli pesanti
- Nichel, cadmio e arsenico, in particolare
- Fumo di sigaretta
- Stare seduti troppo a lungo
- Uso eccessivo di alcol, bevande energetiche e latte
2. Attrito dei telomeri
Telomeri sono particolarmente suscettibili al deterioramento dovuto all'età. L'accorciamento dei telomeri si osserva durante il normale invecchiamento. sia negli esseri umani che nei topi. I telomeri sono legati da un complesso multiproteico chiamato shelterinache impedisce l'accesso delle proteine di riparazione del DNA ai telomeri (senza di esso i telomeri verrebbero "riparati" come rotture del DNA che portano a fusioni cromosomiche). Il danno al DNA a livello dei telomeri è notevolmente costante e altamente efficiente nell'indurre la senescenza.
Modi per ridurre l'accorciamento dei telomeri (Segno distintivo n. 2):
- Aumentare l'assunzione di antiossidanti con la dieta
- Assunzione elevata di acidi grassi omega-3, in particolare
- Ottimizzare la vitamina D, vitamina B12 e folato livelli di vitamina B12 e folato nel sangue
- Dieta mediterranea
- Evitare quanto segue:
- fumare
- Obesità
- Esposizione a tossine e inquinamento
- Equilibrare i livelli di stress
- Bilanciare la routine di esercizio fisico e gli allenamenti intensi
- Meditazione di amorevolezza & meditazione di consapevolezza pratica (e meditazione in generale)
- Ossigenoterapia iperbarica (HBOT)
- Erbe ginostemma, gotu kola e astragalo (possibilmente efficace)
- Cosa non funziona: restrizione calorica a lungo termine
3. Alterazioni epigenetiche
Molti tipi di alterazioni epigenetiche interessano tutte le cellule e i tessuti nel corso della vita. (causate da fattori quali dieta, sostanze chimiche, farmaci, luce solare, caldo/freddo, esercizio fisico, ecc.) I cambiamenti epigenetici presuppongono alterazioni modelli di metilazione del DNA, modificazioni post-traslazionali degli istoni e rimodellamento della cromatina.I membri della famiglia delle sirtuine, deacetilasi proteiche NAD-dipendenti e ADP ribosiltransferasi, sono stati coinvolti in un processo di epigenetica. sono stati ampiamente studiati come potenziali fattori anti-invecchiamento; nell'uomo, almeno tre membri della famiglia delle sirtuine, SIRT1, SIRT3 e SIRT6, contribuiscono a un invecchiamento sano.
Modi per gestire l'alterazione epigenetica (Hallmark #3):
- Ottimizzare le vie di metilazione (folato, B12, B6, TMG)
- Attivatori delle vie della sirtuina (SIRT1, SIRT3, SIRT6):
- Spermidina (inibisce le istone deacetilasi)
- Restrizione calorica intermittente e digiuno intermittente
- Esercizio fisico regolare (intenso)
- Ottimizzazione del sonno (la perdita di sonno causa alterazioni epigenetiche dannose)
- Metformina (gli effetti collaterali sono l'avvertenza); preferibilmente (diidro)berberina
- Alfa-chetoglutarato (CaAKG)
- Assumere regolarmente dosi ormonali di calore, freddo, luce solare, ecc. ("il veleno è nella dose")
- Farmaci epigenetici in fase di sviluppo che hanno come bersaglio le DNA metiltransferasi, le istone deacetilasi, le istone metiltransferasi e la cromatina
Integratori consigliati:
Quercetina liposomiale Purovitalis
Purovitalis Resveratrolo liposomiale
4. Perdita di proteostasi
La proteostasi comprende meccanismi per la stabilizzazione delle proteine correttamente ripiegate (in particolare la famiglia delle proteine heat-shock) e meccanismi per la degradazione delle proteine da parte del proteasoma o del lisosoma.. Numerosi studi hanno dimostrato che la proteostasi è alterata dall'invecchiamento che porta all'espressione cronica di proteine dispiegate, mal ripiegate o aggregate. Queste contribuiscono allo sviluppo di alcune malattie degenerative legate all'etàcome il morbo di Alzheimer.
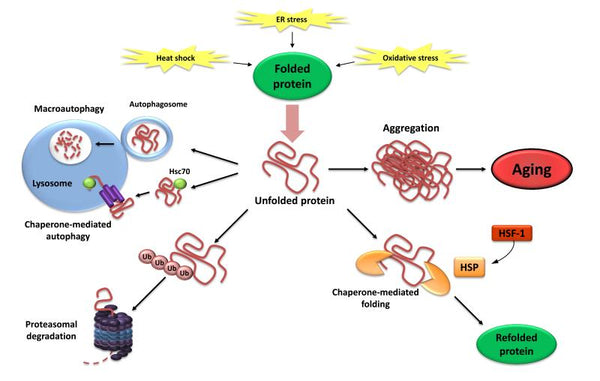
Immagine: Perdita della proteostasi. Il mancato ripiegamento o degradazione delle proteine dispiegate può portare al loro accumulo e aggregazione, con conseguenti effetti proteotossici.
Fonte: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). I tratti distintivi dell'invecchiamento. Cellula 153 (6): 1194–1217.
Modi per migliorare la stabilità della proteostasi (Hallmark #4):
In generale, il modo migliore per proteggere l'organismo dalla perdita della proteostasi è attivando l'autofagia.
- Digiuno, restrizione calorica intermittente (a lungo termine non è utile!), chetosi, esercizio fisico (meglio se a digiuno), allenamento di resistenza, freddo & esposizione al calore, sonno profondo (e melatonina)
- Sulforafano, caffè, curcumina, polifenoli, EVOO, resveratrolo, tè verde, spermidina
- Nutrienti e integratori senolitici:
- Quercetina, fisetina, luteolina, curcumina, piperlongumina, idrogeno molecolare (H2) ecc.
- Attivatori dell'AMPK:
- Berberina (meglio ancora se DHB), resveratrolo (e pterostilbene), esperidina, ginsenosidi, quercetina, curcumina, naringenina, ginostemma, crocina (nello zafferano), acido salvianolico B, acido alfa-lipoico, ecc.
- Metformina e rapamicina (Nb. pos.possibili effetti collaterali)
- Induttori della proteina Hsp70 (heat-shock protein 70):
- Sauna ed esposizione al calore
- Shikonin (dalle radici della pianta shikonin)
- Farmaci senolitici specifici (come Dasatinib e Navitoclax)
5. Deregolamentazione del rilevamento dei nutrienti
La segnalazione dell'IGF-1 e dell'insulina è nota come il via IISche è la via di controllo dell'invecchiamento più conservata nell'evoluzione. Oltre alla via IIS, che prende parte al rilevamento del glucosio, ci sono tre ulteriori sistemi di rilevamento dei nutrienti correlati e interconnessimTOR (rilevamento di alte concentrazioni di aminoacidi), AMPK (rilevamento di stati a bassa energia tramite alti livelli di AMP) e sirtuine (rilevamento di stati a bassa energia tramite alti livelli di NAD+). Per riassumere, ci sono forti evidenze che segnalazione anabolica (mTOR, insulina alta) accelera l'invecchiamento e la diminuzione della segnalazione dei nutrienti (AMPK, insulina bassa) prolunga la longevità.
Modi per gestire la segnalazione deregolata dei nutrienti (segno distintivo n. 5):
In pratica, tutti i modi precedenti per gestire i segni distintivi 1-4 sono coperti dalla sensibilizzazione e dalla riregolazione del rilevamento dei nutrienti. Questi includono:
- restrizioni dietetiche
- attivazione dell'AMPK
- attivazione della sirtuina
- ormesi
- riduzione dello stress ossidativo e dell'infiammazione
- aumento dell'autofagia
6. Disfunzione mitocondriale
È stato riscontrato che la disfunzione mitocondriale aumenta il processo di invecchiamento. Quando un organismo invecchia, l'efficacia della catena di respirazione delle cellule diminuisce, il che porta alla perdita di elettroni e alla riduzione della generazione di ATP.. La ridotta efficienza della bioenergetica mitocondriale con l'invecchiamento può derivare da molteplici meccanismi che si intersecanotra cui la ridotta biogenesi dei mitocondri, l'accumulo di mutazioni e delezioni nel mtDNA, lo stress ossidativo delle proteine mitocondriali, la destabilizzazione della catena respiratoria, i cambiamenti nella composizione lipidica delle membrane mitocondriali e le alterazioni della dinamica mitocondriale.
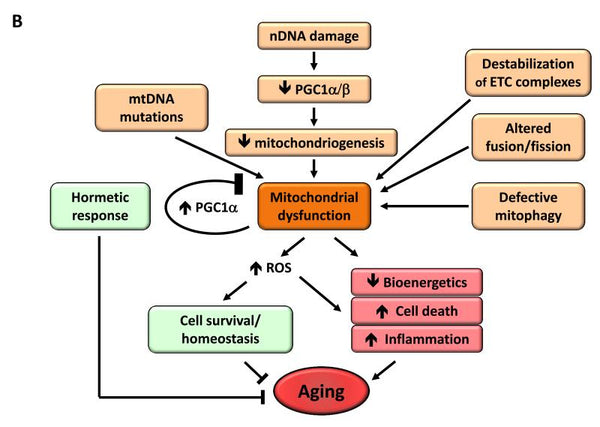
Immagine: La disfunzione mitocondriale e il suo effetto sull'invecchiamento.
Fonte: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). I segni distintivi dell'invecchiamento. Cellula 153 (6): 1194–1217.
Come gestire la disfunzione mitocondriale (Punto di riferimento n. 6):
- Attivare la mitotomia con:
- Restrizione calorica intermittente
- Digiuno intermittente
- Esercizio fisico
- Esposizione al freddo
- Fitonutrienti (come i flavonoidi)
- Mirano alla via Nrf2 (omeostasi e integrità strutturale) con:
- Esposizione al calore e al freddo
- Esercizio fisico
- Digiuno intermittente e chetosi
- Sulforafano, polifenoli, quercetina, curcumina, ecc.
- Idrogeno molecolare (H2) -> raccomandazione di prodotto
- Migliorare la biogenesi e la riparazione mitocondriale (attivando PGC-1α):
- Esercizio fisico
- Chetosi e corpi chetonici
- Acetil-L-carnitina
- Polifenoliquercetina
- Rhodiola rosea (salidrosidi)
- Coenzima Q10, pirrolochinolina chinone (PQQ), nicotinamide mononucleotide (NMN), acido alfa-lipoico (ALA)
7. Senescenza cellulare
Poiché il numero di cellule senescenti aumenta con l'invecchiamento, è stato presupposto che la senescenza contribuisca all'invecchiamento. La senescenza è tuttavia necessaria per prevenire la distribuzione e la proliferazione di cellule danneggiate che innescano una risposta del sistema immunitario. Questo checkpoint cellulare richiede un efficiente sistema di sostituzione cellulare che prevede sia l'eliminazione delle cellule senescenti sia la mobilitazione di cellule progenitrici per ripristinare il numero ottimale di cellule. Le cellule senescenti esprimono alterazioni sostanziali nel loro secretoma, che è particolarmente arricchito in citochine proinfiammatorie e metalloproteinasi di matrice. Si parla quindi di "fenotipo secretorio associato alla senescenza".
Modi per combattere la senescenza cellulare (segno distintivo n. 7):
Le cellule senescenti smettono di moltiplicarsi, ma non muoiono quando dovrebbero, come fanno le cellule normali. Al contrario, rimangono e continuano a rilasciare sostanze chimiche che possono scatenare infiammazioni e risposte immunitarie.
Composti senolitici che colpiscono selettivamente le cellule senescenti includono:
- Fisetina (chiamata anche "il senolitico per eccellenza")
- Quercetina
- Teaflavine
- Apigenina
- Tocotrienoli (forma di vitamina E)
- Piperlongumina
- Idrogeno molecolare (H2)
8. Esaurimento delle cellule staminali
Le cellule staminali adulte sono in grado di auto-rinnovarsi e di differenziarsi in più tipi di cellule all'interno di un tessuto. Sebbene i fenotipi e i meccanismi varino ampiamente, tutte le popolazioni di cellule staminali diminuiscono di funzione con l'età. L'esaurimento delle cellule staminali è la conseguenza unificante di vari danni associati all'invecchiamento e probabilmente costituisce uno dei responsabili ultimi dell'invecchiamento cellulare.. Studi condotti su topi invecchiati hanno rivelato una diminuzione complessiva dell'attività del ciclo cellulare delle cellule staminali. cellule staminali ematopoietiche (CSE)che si correla con l'accumulo di danni al DNA e con il sovraespressione di proteine inibitrici del ciclo cellulare. (ad esempio, p16INK4a). Anche l'accorciamento dei telomeri è stato individuato come una causa importante del declino delle cellule staminali nell'invecchiamento.
Modi per contrastare l'esaurimento delle cellule staminali (Punto di riferimento #8):
- Terapia con cellule staminali (autologhe o allogeniche e vari tipi di cellule)
- Le terapie con cellule staminali sono ancora un "selvaggio west". i potenziali effetti collaterali e i rischi sono presenticome la crescita di tumori e cancro.
- Fotobiomodulazione ("terapia della luce rossa")
- La PBM stimola diversi tipi di cellule staminali a migliorare la loro migrazione, proliferazione e differenziazione in vitro e in vivo.
- Ripristina le cellule staminali invecchiate agendo sui metaboliti tossici:
- Attiva le sirtuine - SIRT1 e SIRT 3 (vedere i punti #3 e #4).
- N-acetilcisteina (NAC)
- Migliora la stabilità della proteostasi (vedi #4).
- Migliorare la funzione mitocondriale (vedi #6)
- Utilizzare i senolitici (vedere #7)
- Ripristinare la memoria epigenetica (vedi #3)
- Ottimizzare i livelli di vitamina D
- Spirulina (studio in vitro)
9. Comunicazione intercellulare alterata
L'invecchiamento cellulare avviene anche a livello di comunicazione intercellulare. Tra questi vi sono la segnalazione neuro-ormonale (aumento delle reazioni infiammatorie), l'immunosorveglianza (agenti patogeni e cellule premaligne) e i cambiamenti dell'ambiente extracellulare. L'invecchiamento dovuto all'infiammazione è chiamato inflammaging.. Può derivare da molteplici cause, come l'accumulo di danni tissutali proinfiammatori, l'incapacità di un sistema immunitario disfunzionale di eliminare efficacemente gli agenti patogeni e le cellule ospiti disfunzionali e il verificarsi di una risposta autofagica carente. I cambiamenti dell'invecchiamento in un tessuto possono portare a un deterioramento specifico del tessuto vicino: le cellule senescenti inducono la senescenza nelle cellule adiacenti attraverso contatti cellula-cellula mediati da gap-junction e processi che coinvolgono specie reattive dell'ossigeno. Questo fenomeno è anche chiamato effetto bystander delle cellule senescenti.
Modi per migliorare intercellulare (segno distintivo n. 9):
- Ridurre l'infiammazione generale dell'organismo
- Un approccio globale allo stile di vita antinfiammatorio
- Utilizzare l'idrogeno molecolare (H2)
- Molteplici effetti anti-invecchiamento nell'organismo (compresa la riduzione dell'infiammazione)
- Riduzione dello stress ossidativo nell'organismo e delle specie reattive dell'ossigeno (ROS)
- Aumentare l'autofagia nell'organismo (vedi sopra).
- Trattare la disbiosi intestinale e migliorare la diversità e la salute generale del microbiota intestinale.
- Trattare l'eventuale sindrome del leaky gut
10. Rigidità della matrice extracellulare (ECM)
Oltre a questi nove segni distintivi dell'invecchiamento definiti nel 2013, ne esiste un decimo in via di definizione. Due ricercatori, Alexander Fedintsev e Alexey Moskalev, hanno pubblicato nel 2021 un articolo che analizza più da vicino l'irrigidimento della matrice extracellulare (ECM): l'accumulo di legami incrociati tra molecole a lunga vita come collagene ed elastina. I ricercatori suggeriscono che l'irrigidimento della ECM è causato dalle reazioni chimiche non enzimatiche di glicazione, carbamilazione e carbonilazione e che potrebbe addirittura essere la causa a monte di diversi segni distintivi dell'invecchiamento, come la senescenza cellulare.. Questi cambiamenti portano alla formazione di addotti e legami incrociati che a loro volta causano infiammazione, fibrosi, alterazione dell'orologio circadiano dei tessuti, invecchiamento delle cellule staminali e così via. È stato precedentemente stabilito che i prodotti finali della glicazione avanzata (AGE) hanno un significato patogeno per vari tessuti e vie dell'organismo. Gli organismi con una durata di vita straordinariamente lunga (come le balene bowhead) presentano tassi eccezionalmente bassi di accumulo di AGEs.
Potenziali terapeutici per la rigidità della matrice extracellulare (ECM) (Hallmark #10):
Nei muscoli scheletrici umani, la compromissione funzionale legata all'età è dovuta all'aumento della rigidità della ECM, causata principalmente dall'accumulo di collagene.
- Terapia manuale e pressione meccanicistica
- Terapia osteopatica, agopuntura, rilascio miofasciale
- Una combinazione di sostanze sintetiche e inibitori naturali degli AGE che agiscono in modo sinergico in diverse fasi di formazione
- I prodotti naturali includono la carnosina, l'acido alfa-lipoico, la taurina, la vitamina C, la benfotiamina e la piridossamina -> raccomandazione di prodotto
- Polifenoli, terpenoidi e polisaccaridi
- Ridurre inoltre l'assunzione di prodotti finali della glicazione avanzata dagli alimenti.
- Stimolare l'elastogenesi (nuovi farmaci?)
- Antagonisti del RAGE (recettore per i prodotti finali della glicazione avanzata) [diversi peptidi].
///







