Mitokondrier er vitale organeller placeret i cytoplasmaet i eukaryote celler. Med velfungerende mitokondrier fungerer alle processer i kroppen, fra bevægelse og motion til fordøjelse og restitution, bedre. De spiller en vigtig rolle i energiproduktionen og mange andre cellulære processer. Mitokondrier er stedet for oxidativ fosforylering, som producerer ATP, cellens primære energikilde. Strukturelt kan mitokondrier evalueres gennem en ydre membran og en stærkt foldet indre membran, der danner rum, der er nødvendige for deres metabolisme. Ud over energiproduktion udfører mitokondrier andre aktiviteter såsom calciumsignalering og regulering af cellulær metabolisme ud over apoptose (programmeret død), hvilket gør dem afgørende for opretholdelse af cellulær homeostase.
Grundlæggende om mitokondriernes funktion
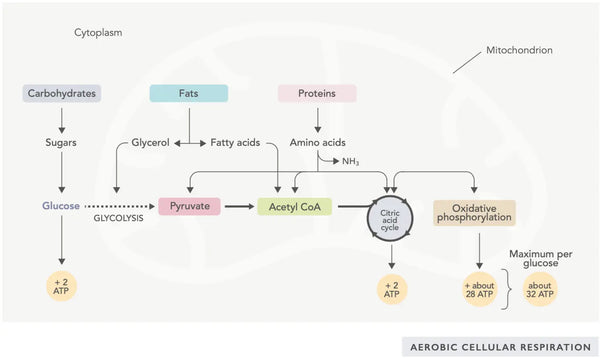
ATP-generering (det primære energimolekyle, der bruges af celler) er det grundlæggende træk ved mitokondrieaktivitet. Denne proces foregår via to biokemiske hovedveje: citronsyrecyklussen (TCA-cyklussen eller Krebs' cyklus) og elektrontransportkæden (ETC).
Citronsyrecyklus
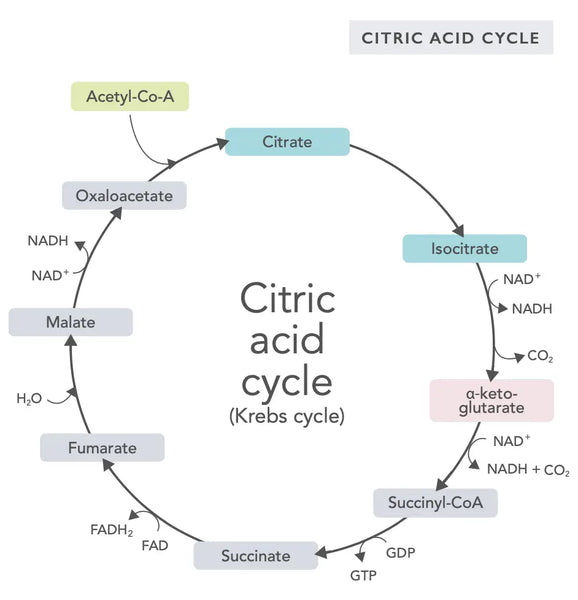
Citronsyrecyklussen eller Krebs' cyklus (opkaldt efter nobelprisvinderen Hans Adolf Krebs, som opdagede den) foregår i cellens mitokondrier.(1)Den primære metaboliske forbindelse i citronsyrecyklussen er eddikesyre (acetylcoenzym A), der produceres af fedtsyrer, kulhydrater og proteiner.(2)
De forskellige reaktioner i citronsyrecyklussen (se billede) danner hydrogenioner og elektroner, som derefter overføres til den indre mitokondriemembran til oxidativ fosforylering (binding af energi til ATP-molekyler gennem oxidation) og elektrontransportkæden. Reaktionen frigiver NADH og små mængder af ATP og kuldioxid.
Citronsyrecyklussen består af ti trin, som hver især påvirkes af B-vitaminer, visse mineraler som magnesium og jern og leverens vigtigste antioxidant, glutathion. Reaktionerne hæmmes af tungmetaller som kviksølv, arsenik og aluminium.
De energirige NADH-molekyler opsamler det meste af den energi, der genereres i citronsyrecyklussen. For hvert acetylcoenzym A-molekyle dannes der tre NADH-molekyler, som derefter bruges til energi i den følgende reaktion (oxidativ fosforylering).
Reguleringen af citronsyrecyklussen bestemmes af tilgængeligheden af forskellige aminosyrer og feedback-hæmning (hvis der f.eks. produceres for meget NADH, hæmmes flere enzymer i citronsyrecyklussen, hvilket bremser reaktionerne).
Oxaloacetat er en forbindelse, der opfylder et pludseligt behov for at producere energi (f.eks. i hjernen eller musklerne). Det kan være nyttigt at tage et tilskud af oxaloacetat, og det kan endda øge regenereringen af mitokondrier i hjernen, reducere stille inflammation i kroppen og øge antallet af nerveceller.(3)
Kort sagt har kroppen et genialt system, som omdanner indtaget mad til elektroner, der bruges som energi til forskellige behov.
Oxidativ fosforylering
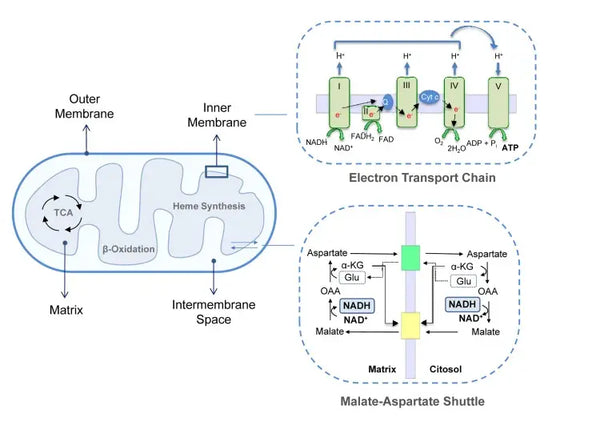
Oxidativ fosforylering består af elektrontransportkæden og ATP-syntase. Oxidativ fosforylering producerer mest energi under aerobe forhold (ATP). Det er en fortsættelse af citronsyrecyklussen.
I elektrontransportkæden frigives hydrogenioner (H+) til mitokondriets intermembranrum. De hydrogenioner, der frigives fra det intermembrane rum, bevæger sig tilbage til mitokondriet gennem ATP-syntase. Ved hjælp af den energi, der frigives i processen, omdanner ATP-syntase den ADP, der blev brugt til energi, til ATP igen.
Ubiquinon (coenzym Q10) bidrager til elektrontransportkæden. Det har været brugt i årtier som kosttilskud. Lave ubiquinonniveauer i cellerne kan være en disponerende faktor for forskellige sygdomme på grund af utilstrækkelig aerob energiproduktion i cellerne. Desuden er brugen af kolesterolmedicin (statiner) en medvirkende faktor til ubiquinonmangel.(4)
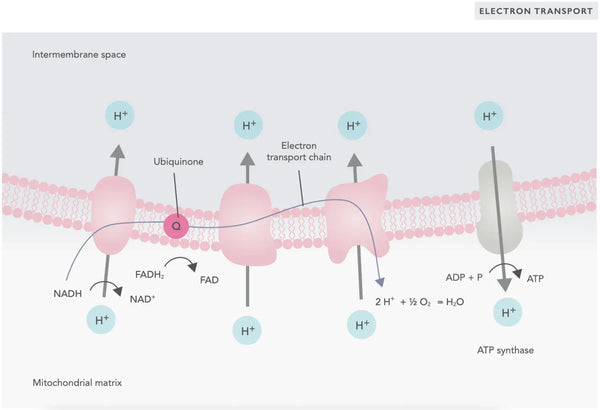
Dette koordinerede sæt af reaktioner genererer ATP og etablerer en protongradient over den indre mitokondriemembran, en proces, der er kendt som kemiosmose. Den energi, der er lagret i denne gradient, driver syntesen af ATP og forbinder strømmen af elektroner gennem ETC med genereringen af cellulær energi.(5)
Faktorer, der påvirker mitokondriernes effektivitet
Mitokondriernes effektivitet, som naturligvis er afgørende for optimal cellefunktion, påvirkes af forskellige faktorer. Nedenfor beskrives de vigtigste af dem.
Genetisk sammensætning
Mitokondrier har et separat og individuelt DNA (mitokondrie-DNA, mtDNA), der adskiller sig fra kerne-DNA'et. MtDNA koder for vigtige komponenter i elektrontransportkæden og mitokondrieproteiner. Mutationer i mtDNA kan føre til dysfunktionelle proteiner, der forstyrrer elektrontransportkæden og ATP-syntesen. Det kan resultere i reduceret energiproduktion og øget dannelse af reaktive iltarter (ROS), hvilket bidrager til mitokondriel og cellulær dysfunktion.(6)
Oxidativ stress
Mitokondrier er en betydelig kilde til ROS, som er biprodukter af iltmetabolismen. Mens lave niveauer af ROS fungerer i cellulær signalering, kan overdreven ROS forårsage oxidativ skade på mitokondrielle proteiner, lipider og DNA. Denne oxidative stress kompromitterer mitokondriernes integritet og funktion, hæmmer ATP-produktionen og fører til yderligere ROS-produktion i en skadelig cyklus. Antioxidantforsvar, herunder superoxiddismutase og glutathionperoxidase, spiller en afgørende rolle i at afbøde denne skade.(7-8)
Tilgængelighed af næringsstoffer
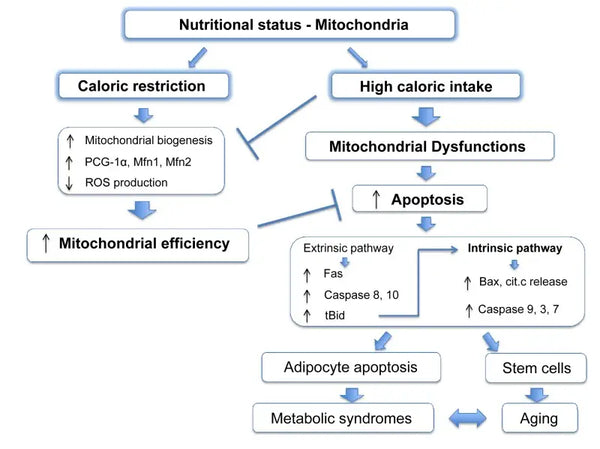
Mitokondrier kræver specifikke substrater til energiproduktion. Glukose og fedtsyrer er primære kilder til ATP-generering via henholdsvis glykolyse og β-oxidation. Tilgængeligheden af disse substrater har direkte indflydelse på mitokondriernes funktion. Under forhold med næringsstofoverskud, som f.eks. høj tilgængelighed af glukose, kan mitokondrier producere for store mængder ATP og ROS, hvilket potentielt kan føre til metaboliske forstyrrelser.(9-10)
Omvendt kan mangel på næringsstoffer begrænse mitokondriernes energiproduktion og dermed påvirke cellernes funktion og overlevelse. I modsætning til nogle rapporter fra dyreforsøg om fordelene ved kaloriebegrænsning på mitokondriel biogenese, ser det ud til, at det ikke øger den mitokondrielle biogenese. Men det bevarer mitokondriefunktionen ved at beskytte integriteten og funktionen af eksisterende cellulære komponenter.(11-12)
Livsstilsfaktorer
Motion
Fysisk aktivitet påvirker mitokondriernes kvantitet og kvalitet. Motion stimulerer mitokondriernes biogenese, hvilket fører til en stigning i mitokondriernes tæthed og effektivitet i energiproduktionen.(13) Især udholdenhedstræning øger mitokondriernes oxidative kapacitet og forbedrer deres evne til at udnytte ilt til ATP-produktion (læs mere i detaljer senere i artiklen).
Kost
Kostens komponenter har stor indflydelse på mitokondriernes funktion. Forholdet mellem makronæringsstoffer, kalorieindtag og specifikke næringsstoffer (som antioxidanter, vitaminer og mineraler) påvirker mitokondriernes stofskifte. Kost, der er rig på næringsstoffer, som understøtter mitokondriefunktionen, kan øge energiproduktionen og reducere oxidativt stress (se senere). Aktivering ketose kan også øge den mitokondrielle biogenese og forbedre den mitokondrielle effektivitet.(14-15)
Miljømæssige faktorer
Udsættelse for miljømæssige stressfaktorer, såsom toksiner, forurenende stoffer, tungmetaller (f.eks. bly, kviksølv, arsenik og cadmium) og stråling, kan påvirke mitokondriefunktionen negativt. Disse stressfaktorer kan fremkalde oxidativ skade, forstyrre elektrontransportkædens aktivitet og forringe mitokondriernes dynamik, herunder fusions- og fissionsprocesser.(16)
Teknologiske interventioner
Fotobiomodulation (eller terapi med rødt lys)
Fotobiomodulation er brugen af ikke-ioniserende fotonisk energi til at udløse fotokemiske ændringer i cellulære strukturer, der er modtagelige for fotoner, især i mitokondrier. Terapi med rødt lys og NIR-lys menes hovedsageligt at virke gennem fotoacceptorer. Røde lysbølger trænger ind i huden og når cellens mitokondrier, hvilket øger cellernes energiproduktion. Forskellige begivenheder fører til dette, for eksempel acceleration af mitokondriernes respiration via cytokrom c-oxidase.(17) Læs om de sundhedsmæssige fordele ved fotobiomodulation her.
Infrarød sauna
Infrarøde saunaer bruger infrarød stråling, som opvarmer kroppens væv direkte i stedet for luft. Frekvensen af den stråling, der udsendes af infrarøde saunaer, er 3-12 μm, hvilket falder ind under langt-infrarødt (FIR). Langt infrarødt lys har vist sig at have effekter på vævsniveau, især på mitokondriernes respirationskæde i cellernes energiproduktionsproces og blodforsyningen til vævene ved at udvide blodkarrene og forbedre cirkulationen.(18)
Pulserende elektromagnetisk felt-terapi (PEMF)
PEMF-terapi bruger elektromagnetiske felter til at fremme forskellige fysiologiske processer. Forskning tyder på, at PEMF kan forbedre mitokondriefunktionen ved at øge cellernes iltforbrug og forbedre produktionen af ATP. PEMF-terapi påvirker mitokondrierne direkte og bringer cellerne tilbage til en sundere energi- og elektrisk ladningstilstand.(19-20) Læs den omfattende guide om PEMF-terapi her.
Hyperbar iltbehandling (HBOT)
HBOT indebærer, at man indånder ren ilt i et miljø under tryk. Det er klinisk bevist, at hyperbar iltbehandling revitaliserer mitokondrierne og øger ATP-dannelsen ved at tilføre suprafysiologiske mængder af ilt, som er nødvendig for cellernes respiration. En nylig undersøgelse rapporterede, at HBO øgede mitokondriernes biogenese og autofagi ved delvist at øge produktionen af reaktive oxygenarter. Denne proces producerede nye sunde mitokondrier, og gamle dysfunktionelle mitokondrier blev ødelagt. Undersøgelsen viste også en øget aktivering af mitokondriernes DNA-transkription og -replikation.(21-22) Læs mere om HBOT her.
Ernæringsmæssig og supplerende støtte til mitokondriefunktionen
Ernæringens rolle i opretholdelsen af mitokondriernes sundhed er afgørende, og visse næringsstoffer er særligt vigtige for en optimal mitokondriefunktion. Disse omfatter følgende, der er anført nedenfor.
- Coenzym Q10 (CoQ10): Ubiquinon er fedtopløseligt og ligner et vitamin. Ubiquinon fungerer som elektronbærer i elektronoverførselskæden i mitokondrier (se figuren til højre) og fremmer udskillelsen af ATP. Ubiquinon-niveauerne falder i forskellige væv med alderen.(23)
- Magnesium: Involveret i ATP-syntese og afgørende for at opretholde mitokondriernes integritet og funktion.(24)
- B-vitaminer: Herunder B1 (thiamin), B2 (riboflavin), B3 (niacin), B5 (pantothensyre), B6, B7 (biotin) og B12. Disse B-vitaminer er afgørende for forskellige aspekter af mitokondriernes energimetabolisme.(25)
- Alfa-liponsyre: ALA er en kraftig antioxidant, som også hjælper med at regenerere andre antioxidanter. Det spiller en rolle i energimetabolismen og kan forbedre mitokondriefunktionen.(26)
- Carnitin (især acetyl-L-carnitin): Transporterer fedtsyrer ind i mitokondrierne til beta-oxidation, som er afgørende for energiproduktionen, især i muskelceller.(27)
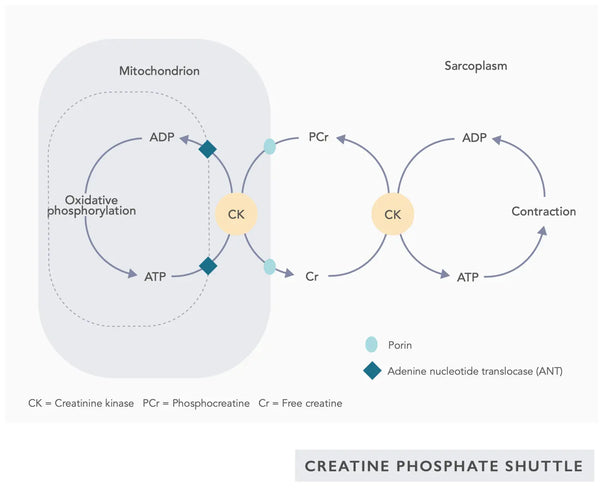
- Kreatin: Kreatin er en naturligt forekommende forbindelse i kroppen, som hjælper med at levere energi til celler, især muskelceller, ved at øge dannelsen af adenosintrifosfat (ATP). Kreatintilskud kan forbedre mitokondriernes effektivitet, især ved højintensiv træning.(28)
- Pyrroloquinolinkinon (PQQ): PQQ er en antioxidant, der øger den mitokondrielle biogenese via PGC-1-proteinindholdet og understøtter den mitokondrielle funktion.(29)
- Omega-3-fedtsyrer (EPA og DHA): Omega-3 er afgørende for at opretholde mitokondriemembranens fluiditet og funktion. De findes hovedsageligt i fiskeolie og fede fisk.(30)
- Nicotinamid-ribosid (NR) og Nicotinamid-mononukleotid (NMN): Disse NAD+-forstadier er afgørende for mitokondriernes funktion og energiproduktion. Tilskud med NR eller NMN kan hjælpe med at hæve NAD+-niveauerne og dermed forbedre mitokondriernes effektivitet.(31) Læs mere om optimering af NAD+ her.
- Curcumin: Curcumin er den aktive forbindelse i gurkemeje. Det har vist sig at beskytte mitokondrier mod oxidativ skade og forbedre deres funktion.(32)
- Selen: Selen: Et essentielt sporstof, der spiller en rolle i beskyttelsen af mitokondrier mod oxidativ stress. Selen opregulerer også mitokondriernes biogenese.(33)
Træning og mitokondriel biogenese
Regelmæssig fysisk aktivitet er en afgørende faktor for at fremme den mitokondrielle biogenese, som fører til dannelsen af nye mitokondrier og dermed øger deres mængde og funktionelle kapacitet i cellerne. Forskellige former for motion har forskellige effekter på mitokondriernes dynamik. De to vigtigste træningsformer er aerob træning og styrketræning.
Aerob træning
Mitokondrietætheden i skeletmuskelceller øges mærkbart under aerob træning (f.eks. løb, cykling og svømning).
Mitokondriebiogenesen reguleres af PGC-1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha), et essentielt reguleringsprotein, hvis udtryk aerob træning stimulerer. PGC-1α coaktiverer nukleare respiratoriske faktorer (NRF'er) og mitokondriel transkriptionsfaktor A (TFAM), som er nødvendige for at transkribere mtDNA og replikere mitokondrier. Det fører til øget effektivitet i den oxidative fosforylering, bedre udholdenhed og større ATP-produktion i muskelcellerne.(34)
Højintensiv intervaltræning (HIIT) er særlig effektiv. til at øge antallet af mitokondrier og den maksimale iltoptagelse (VO2max).(35-36)
Modstandstræning
Mitokondriernes funktion og effektivitet er det primære mål for modstandstræning (f.eks. vægtløftning og øvelser med kropsvægt). Det udløser ændringer i mitokondriernes proteinsyntese, hvilket forbedrer de nuværende mitokondriers kvalitet og effektivitet. Styrketræning øger også produktionen af enzymer i elektrontransportkæderne og Krebs' cyklus, hvilket yderligere forbedrer cellernes kapacitet til ATP-syntese. Det kan også øge antallet og størrelsen af mitokondrier i muskelcellerne, men ikke i samme grad som aerob træning.(37-38)
Den kombinerede effekt af disse træningsformer på mitokondriernes biogenese og funktion understreger vigtigheden af fysisk aktivitet for at opretholde og forbedre mitokondriernes sundhed. Regelmæssig aerob træning og udholdenhedstræning forbedrer cellernes mitokondrietæthed, effektivitet og energimetabolisme. Disse tilpasninger er afgørende for atletisk præstation og har betydning for vedligeholdelse af sundhed, sygdomsforebyggelse og håndtering af tilstande, der er forbundet med mitokondriel dysfunktion.
Man skal dog være opmærksom på, at træning af både styrke og udholdenhed på samme tid fører til mindre tilpasning, da proteinkinaserne PKB og AMPK blokerer for hinandens downstream-signalering, hvilket hindrer den samtidige træningseffekt.(39)
Mitofagi og cellulær sundhed
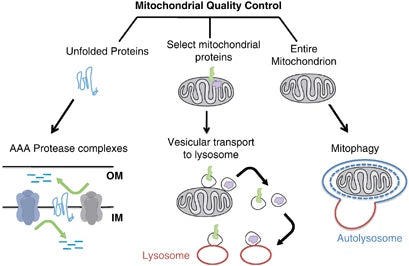
Mitofagi er en selektiv form for autofagi, der spiller en vigtig rolle i cellulære forhold ved kun at nedbryde beskadigede eller ikke-fungerende mitokondrier. Denne mekanisme er afgørende for mitokondriernes og cellens sundhed, idet den forhindrer mRNA'er, der koder for defekt samling af underenheder, i at opstå og dermed forhindrer yderligere kriser i cellulære funktioner og adskillige patologier.(40)
Eliminering af beskadigede mitokondrier gennem mitofagi hjælper med at reducere oxidativ stress, apoptose og inflammation (forbundet med forskellige patologier). Nedsat mitofagi fremmer ophobningen af dysfunktionelle mitokondrier i patogenesen af neurodegenerationssygdomme som Parkinsons og Alzheimers sygdom. Ved stofskiftesygdomme fører tab af mitofagi ligeledes til ændringer i mitokondriernes stofskifte, hvilket resulterer i insulinresistens og type 2-diabetes.(41-42)
Det har vist sig, at kaloriebegrænsning fremmer mitofagi. Det skyldes til dels aktiveringen af sirtuiner (SIRT1), AMP-aktiveret proteinkinase (AMPK) og transkriptionsfaktoren EB, der understøtter både cellulær energikriserespons og igangsætning af mitofagi. Specifikt regulerer sirtuiner funktionen af faktorer i mitofagimaskineriet ved at lukke ned for beskadigede mitokondrier.(43)
De molekylære effekter af kaloriebegrænsning efterlignes af stoffer som resveratrol (en polyfenol i rødvin og nogle bær) og mange andre polyfenoler. Resveratrol fremmer SIRT1- og AMPK-aktivering og øger mitofagi, der er ansvarlig for forbedring af mitokondriernes funktion og genoprettelse af cellernes sundhed.(44-45)
Mitofagi kan forbedres med periodisk faste. Denne forbedring mindskes sandsynligvis af det metaboliske skift fra glukosebaseret til ketonbaseret energi under faste, og dette skift udløser mitofagi.46-47)
Mitokondriel dysfunktion som et kendetegn ved aldring
At forstå, hvordan mitokondrier bidrager til aldringsprocessen, er i centrum for forskning i gerontologi og cellebiologi. Når organismer ældes, bliver mitokondriel dysfunktion mere almindelig, hvilket spiller en rolle i den fysiologiske side af aldring.
De aldrende mitokondrier udviser nedsat produktion af ATP, hvilket påvirker de energidrevne processer, der er nødvendige for cellernes velbefindende. Desuden forstyrrer de strukturelle ændringer i mitokondrierne, der er forbundet med alder, dette fald i energiproduktionen endnu mere, såsom unormal sammensætning af mitokondriernes membranpotentiale og den indre mitokondrievægs integritet.(48)
Positionen af mitokondrie-DNA (mtDNA) nær elektrontransportkæden, hvor reaktive iltarter opstår, påvirker dets sårbarhed over for mutationer. Men mutationerne opbygges med tiden, hvilket resulterer i mitokondriel dysfunktion. I modsætning til kerne-DNA, som er bundet til histoner for at beskytte og har en række reparationsmekanismer til rådighed, mangler mtDNA en beskyttende belægning af histoner og har ikke en bred vifte af reparationsmetoder, så det kan let blive beskadiget.(49)
I cellerne producerer mitokondrier reaktive iltarter (ROS). Selvom ROS fungerer som et kritisk middel for cellen til at kommunikere med og tilpasse sig sit miljø, er produktionen af høje niveauer af disse molekyler begrænset af stram kontrol. Overdreven produktion i forskellige aldersrelaterede tilstande resulterer i, at cellerne lider af oxidativ stress. Det ødelægger forskellige cellulære komponenter, hvad enten det er proteiner, lipider eller DNA. Mitokondrierne er endda den primære modtager af oxidativ skade, hvilket skaber en ond cirkel, da beskadigede mitokondrier kun genererer mere ROS og dermed øger den cellulære stress. senescens.(50-52)
Mitokondriernes dynamik er afgørende for mitokondriernes funktion, som hjælper med at opretholde fusions- og fissionsprocessen. Men denne dynamik forstyrres med alderen, og mitokondrierne undergår fragmentering i stedet for fusion. Disse ændringer påvirker mitokondriernes funktion og deres position i cellerne.(53)
Tabet af mitokondriefunktion er ikke et passivt aldringsrelateret fænomen, men en aktiv deltager i patogenesen af aldersafhængige sygdomme. Mitokondriel dysfunktion er blevet forbundet med tilstande som neurodegenerative sygdomme, hjerte-kar-sygdomme og stofskiftesygdomme. Ved disse lidelser er reduceret eller defekt energiproduktion, øget oxidativ stress og manglende evne til at fjerne beskadigede mitokondrier afgørende for sygdommens patogenese og forløb.(54)
Konklusion
Optimering af mitokondriesundhed og dens forringelse med alderen er en udfordrende opgave, men heldigvis er der meget, vi kan gøre ved det. De vigtigste interventioner involverer ernæringsmæssig støtte til kritiske substrater til regenerering, herunder coenzym Q10, magnesium og B-vitaminer; regelmæssig deltagelse i forskellige træningsdiscipliner for at øge den mitokondrielle biogenese; og livsstilsændringer såsom kaloriebegrænsning eller periodisk faste for at påvirke mitofagimekanismer.
Anerkendelsen af mitokondrie-dysfunktion som en af de faktorer, der er involveret i aldring, gør disse strategier vigtige for at støtte cellernes sundhed og bekæmpe aldersrelateret nedbrydning. Integrative tilgange, der udnytter kraften i videnskabeligt baseret viden i kombination med relevante livsstilsændringer, kan skabe gunstige betingelser for forebyggelse og opbremsning af mitokondrie-slid, der generelt tjener individets trivsel og levetid.
Videnskabelige referencer
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900-81), pioner inden for moderne medicin, arkitekt for intermediær metabolisme. Tidsskrift for medicinsk biografi 17 (3): 149–154.
- Berg, J. & Tymoczko, J. & Stryer, L. (2002). Biokemi. 5. udgave. Kapitel 17, Citronsyrecyklussen. New York: W. H. Freeman.
- Wilkins, H. et al. (2014). Oxaloacetat aktiverer hjernens mitokondriebiogenese, forbedrer insulinvejen, reducerer inflammation og stimulerer neurogenese. Human molekylær genetik 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Primær og sekundær coenzym Q10-mangel: rollen som terapeutisk tilskud. Anmeldelser af ernæring 71 (3): 180–188. Anmeldelse.
- Saraste, M. (1999). Oxidativ fosforylering ved slutningen af århundredet. Videnskab 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Humane mitokondrielle tRNA'er: biogenese, funktion, strukturelle aspekter og sygdomme. Årlig gennemgang af genetik 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Er mitokondrier den vigtigste bidragyder til reaktive iltarter i celler? Tidsskrift for eksperimentel biologi 224 (5): jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Reaktive oxygenarter i cellesignalering. American Journal of Physiology-Lung Cellular and Molecular Physiology 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Mekanismer for produktion af bioenergi i mitokondrier. Mitokondrier og deres rolle i hjerte-kar-sygdomme 99–121.
- Bottje, W. (2019). Oxidativ metabolisme og effektivitet: mitokondriernes delikate balancegang. Fjerkrævidenskab 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Tilgængelighed af næringsstoffer forbinder mitokondrier, apoptose og fedme. Aldring (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). Kronisk kalorirestriktion bevarer mitokondriefunktionen i senescens uden at øge mitokondriebiogenesen. Celle Metabolisme 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Molekylære mekanismer for mitokondriel tilpasning til træning i skeletmuskler. The FASEB Journal 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Regulering af mitokondriel biogenese. Essays i biokemi 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Ketonbaseret metabolisk terapi: Er øget NAD+ en primær mekanisme? Grænser i molekylær neurovidenskab 10: 377.
- Fowler, B. (1978). Generelle subcellulære effekter af bly, kviksølv, cadmium og arsenik. Perspektiver på miljø og sundhed 22:37-41.
- Hamblin, M. (2018). Mekanismer og mitokondriel redox-signalering i fotobiomodulation. Fotokemi og fotobiologi 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Fjerninfrarød stråling (FIR): dens biologiske virkninger og medicinske anvendelser. Fotonik og lasere i medicin 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). Elektromagnetisk stimulering øger mitokondriefunktionen i osteogene celler og fremmer reparation af knoglebrud. Videnskabelige rapporter 11 (1): 19114.
- Tai, Y. et al. (2020). Magnetiske felter modulerer stofskiftet og tarmmikrobiomet i sammenhæng medPgc-1 alfa-ekspression: Opfølgning på en in vitro magnetisk mitohormetisk undersøgelse. FASEB-tidsskriftet 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). Effekten af hyperbar ilt på mitokondriel og glykolytisk energimetabolisme: kaloristasekonceptet. Cellestress og chaperoner 25 (4): 667-677.
- Chen, W. et al. (2020). Hyperbar ilt beskytter mod myokardie-iskæmi-reperfusionsskade ved at hæmme mitokondriernes dysfunktion og autofagi. Rapporter om molekylær medicin 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). Kompleksiteten i at lave ubiquinon. Trends i endokrinologi og metabolisme 30 (12): 929-943.
- Volpe, S. (2013). Magnesium i sygdomsforebyggelse og generel sundhed. Fremskridt inden for ernæring 4 (3): 378S-383S.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O'Brien, P. (2006). Mitokondriefunktion og toksicitet: B-vitaminfamiliens rolle i mitokondriernes energimetabolisme. Kemisk-biologiske interaktioner 163 (1-2): 94-112.
- Solmonson, A. & DeBerardinis, R. (2018). Liposyremetabolisme og mitokondriel redoxregulering. Tidsskrift for biologisk kemi 293 (20): 7522-7530.
- Gnoni, A. & Longo, S. & Gnoni, G. & Giudetti, A. (2020). Carnitin i human muskelbioenergetik: kan carnitintilskud forbedre fysisk træning? Molekyler 25 (1): 182.
- Wax, B. et al. (2021). Kreatin til træning og sportspræstation, med overvejelser om restitution for sunde befolkninger. Næringsstoffer 13 (6): 1915.
- Hwang, P. et al. (2020). Virkninger af tilskud med pyrroloquinolinkinon (PQQ) på aerob træningspræstation og indekser for mitokondriel biogenese hos utrænede mænd. Tidsskrift for det amerikanske ernæringskollegium 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Påvirkning af mitokondriemembranens sammensætning og bioenergetik gennem omega-3-tilskud. Tidsskrift for fysiologi 592 (Pt 9): 1913-1914.
- Elhassan, Y. e al. (2019). Nicotinamid-ribosid øger den ældre menneskelige skeletmuskels NAD+-metabolom og inducerer transkriptomiske og antiinflammatoriske signaturer. Celle-rapporter 28 (7): 1717-1728.
- de Oliveira, M. et al. (2016). Curcumin, mitokondriel biogenese og mitofagi: Udforskning af nyere data og angivelse af fremtidige behov. Bioteknologiske fremskridt 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Selen, et mikronæringsstof, der modulerer kardiovaskulær sundhed via redox-enzymologi. Næringsstoffer 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Regulering af PGC-1α, en nodal regulator af mitokondriel biogenese. Det amerikanske tidsskrift for klinisk ernæring 93 (4): 884S-890S.
- Helgerud, J. et al (2007). Aerobe højintensitetsintervaller forbedrer VO2max mere end moderat træning. Medicin og videnskab i sport og motion 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Lignende metaboliske tilpasninger under træning efter sprintintervaller med lav volumen og traditionel udholdenhedstræning hos mennesker. Tidsskrift for fysiologi 586 (1): 151–160.
- Wilkinson, S. et al (2008). Forskellige effekter af udholdenhedstræning og styrketræning i mæt tilstand på signalmolekylers fosforylering og proteinsyntese i menneskets muskler. Tidsskrift for fysiologi 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Modstandstræning ændrer mitokondriefunktionen i menneskets skeletmuskulatur. Medicin og videnskab i sport og motion 47 (9): 1922-1931.
- Baar, K. (2006). Træning af udholdenhed og styrke: lærdom fra cellesignalering. Medicin og videnskab i sport og motion 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Mitofagiens veje til kvalitetskontrol og rydning af mitokondrier. Celledød og differentiering 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitokondrier og aksen autofagi-inflammation-celledød i organismers aldring. Videnskab 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitofagi: Et lovende terapeutisk mål for neurobeskyttelse under aldring og aldersrelaterede sygdomme. Britisk tidsskrift for farmakologi 180 (12): 1542-1561.
- Cantó, C., & Auwerx, J. (2011). Kaloriebegrænsning: Er AMPK en vigtig sensor og effektor? Fysiologi 26 (4): 214-224.
- Um, J. et al. (2010). Mus med mangel på AMP-aktiveret proteinkinase er resistente over for de metaboliske virkninger af resveratrol. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Antialdringsegenskaberne ved en antioxidant, der stammer fra vindruer, reguleres af mitokondriernes balance mellem fusion og fission, hvilket fører til mitofagi udløst af et signalnetværk af Sirt1-Sirt3-Foxo3-PINK1-PARKIN. Oxidativ medicin og cellulær levetid 2014: 345105.
- Longo, V. & Panda, S. (2016). Faste, cirkadiske rytmer og tidsbegrænset fodring i sund levetid. Cellemetabolisme 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I & Sahebkar, A. (2020). Effekten af faste eller kaloriebegrænsning på mitofagi-induktion: en litteraturgennemgang. Journal of Cachexia, Sarcopenia and Muscle 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Oxidativt stress, mitokondriel DNA-mutation og svækkelse af antioxidantenzymer ved aldring. Eksperimentel biologi og medicine 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). mtDNA Mutations and Their Role in Aging, Diseases and Forensic Sciences. Aldring og sygdom 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Mitokondriernes dannelse af reaktive iltarter. Antioxidanter 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Reaktive iltarter og mitokondrier: Et knudepunkt for cellulær homeostase. Redox-biologi 6: 472-485.
- Correia-Melo, C. et al. (2016). Mitokondrier er nødvendige for aldringsfremmende træk ved den senescente fænotype. EMBO-tidsskriftet 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Mitokondrielle fusions- og fissionsproteiner som nye terapeutiske mål for behandling af hjerte-kar-sygdomme. Europæisk tidsskrift for farmakologi 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitofagi: en ny rolle i aldring og aldersrelaterede sygdomme. Frontiers in Cell and Developmental Biology 8: 200.