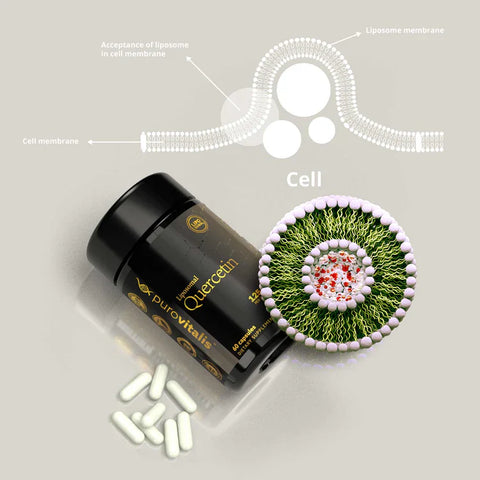
Lær vigtige tilskudsfærdigheder med vores guide til de tre bedste naturlige senolytika, der kan forynge cellerne og forbedre helbredet. Når vi bliver ældre, kan cellulær senescens - hvor cellerne holder op med at dele sig og ophobes i kroppen - føre til forskellige aldersrelaterede sygdomme. Visse naturlige forbindelser er dog blevet identificeret som kraftfulde senolytika der er i stand til selektivt at fjerne disse ældede celler. Denne artikel ser nærmere på videnskaben bag disse bemærkelsesværdige stoffer, og hvordan man kan indarbejde dem i de daglige rutiner for at opnå aldersbekæmpende sundhedsfordele.
Indledning
Aldring er en kompleks biologisk proces, der er kendetegnet ved et gradvist fald i fysiologisk funktion og øget modtagelighed for sygdomme. Mens aldring længe er blevet betragtet som et uundgåeligt aspekt af livet, har de seneste fremskridt inden for biogerontologi afdækket cellulære og molekylære mekanismer, der ligger til grund for den. Cellulær senescens har vist sig at være en fremtrædende bidragyder til aldersrelaterede patologier blandt disse mekanismer. Det er en irreversibel vækststandsning, der udløses af forskellige stressfaktorer.(1)
Fordi antallet af senescente celler stiger med alderen, er det blevet antaget, at senescens bidrager til aldring. Senescens er nødvendig for at forhindre distribution og spredning af beskadigede celler, hvilket udløser en reaktion fra immunsystemet. Dette cellulære kontrolpunkt kræver et effektivt celleudskiftningssystem, der involverer både fjernelse af senescente celler og mobilisering af progenitorceller for at genoprette det optimale antal celler.(2)
Kerne-DNA-skader rapporteres ofte som en underliggende årsag til senescens, hovedsageligt i form af DNA-dobbeltstrengsbrud (DSB'er), der aktiverer DNA-skaderesponsen (DDR). Langvarig DDR-aktivering aktiverer senescens. En eller nogle få DDR-signalerende telomerer (kromosomender) er tilstrækkelige til at udløse replikativ cellesenescens. Onkogen aktivering er også en stærk senescensudløser.(3)
Senescente celler udtrykker betydelige ændringer i deres sekretom, som især er beriget med proinflammatoriske cytokiner og matrixmetalloproteinaser. Det kaldes derfor den senescens-associerede sekretoriske fænotype (SASP).. Senescente celler udviser tydelige fænotypiske ændringer, såsom affladet morfologi, ændret genekspression og udskillelse af proinflammatoriske molekyler. Mens senescens oprindeligt fungerer som en tumorundertrykkende mekanisme ved at standse spredningen af beskadigede celler, bidrager ophobningen af senescente celler over tid til vævsdysfunktion og fremmer aldringsrelaterede sygdomme. (4)
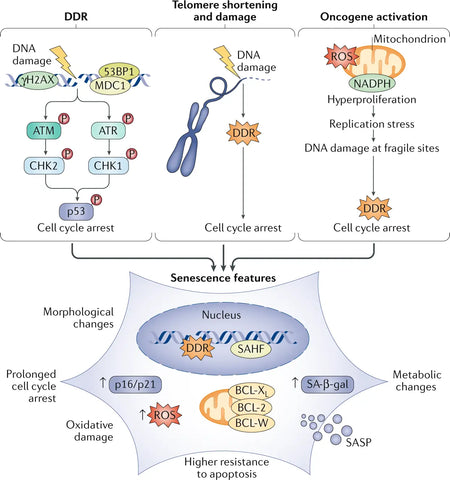
Billede: Senescensdrivere og -fænotyper.
Kilde: Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Cellulær senescens i aldring: fra mekanismer til terapeutiske muligheder. Nature Reviews Molecular Cell Biology 22 (2): 75–95.
I betragtning af de skadelige virkninger af senescente celler på vævshomeostase og sundhedsspændvidde er målretning mod disse celler dukket op som en lovende terapeutisk strategi. Senolytika er stoffer, der er designet til at fremkalde apoptose i senescente celler, mens de selektivt skåner sunde celler. De har potentiale til at lindre inflammation, forbedre vævsregenerering og forsinke udbruddet af aldersrelaterede patologier.(5)
Senolytiske forbindelser
Talrige naturlige og syntetiske forbindelser er blevet identificeret som potentielle senolytikamed quercetin (en naturlig forbindelse) og dasatinib (et syntetisk lægemiddel) som tidlige kandidater i denne klasse. Ud over quercetin og dasatinib er flere andre forbindelser, herunder fisetin, navitoclax og ABT-263, har vist lovende senolytiske egenskaber i prækliniske modeller. Denne artikel dækker de 3 mest potentielle og lovende naturlige senolytika, der er tilgængelige i dag.
Fisetin
Fisetin er en bioaktiv flavonol (en polyfenol), der er blevet undersøgt grundigt for sit potentiale til at fremme sundhed og lang levetid, primært ved at mindske cellulær senescens. Det findes primært i jordbær, æbler, kaki, løg, druer og i små mængder i agurk (se billedet). Fisetin har en række biologiske aktiviteter, der kan tilskrives dets unikke molekylære struktur (en plan struktur og flere kulstofringe).(6-7)
Den første udforskning af Fisetins egenskaber afslører dets potente antioxidantkapacitet, som stammer fra dets evne til at fjerne reaktive iltarter (ROS). Det spiller således en afgørende rolle i det cellulære forsvar mod oxidativ stress.(8)

Billede: Kostkilder til fisetin.
Kilde: Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetin: en kostantioxidant til sundhedsfremme. Antioxidanter og redox-signalering 19 (2): 151–162.
Fisetins senolytiske aktivitet udgør et primært fokus i levetidsforskningen. Cellulær senescens er en tilstand, hvor celler ophører med at sprede sig og akkumuleres over tid - det er involveret i forskellige aldersrelaterede sygdomme (se før for flere detaljer). Fisetin har vist sig selektivt at fremkalde apoptose i disse senescente celler. Det antages, at denne selektive clearance kan afhjælpe senescens-associerede fænotyper og dermed bidrage til at forsinke eller forebygge aldersrelaterede patologier. Sammenlignet med en anden mulig senolytisk forbindelse er Fisetin ca. to gange mere potent end quercetin (se senere i artiklen).(9-10)
Den prooxidante aktivitet af flavonoider (som fisetin) er en vigtig overvejelse, når man screener for senolytika. Senescente celler akkumulerer høje niveauer af kobber og jern. Den selektive mekanisme for quercetin eller fisetin er eksplicit forbundet med kobber/jern-promoveret oxidativ skade i senescente celler og dræber dermed apoptose-resistente celler.(11)
Fisetin påvirker også vigtige cellulære signalveje, som er en integreret del af aldringsprocessen. Det modulerer funktionen af sirtuiner (især SIRT1), mTOR (hæmning) og JAK-STAT/NF-κB, som er afgørende for regulering af cellulær overlevelse, apoptose og autofagi. Ved at modulere disse veje kan Fisetin teoretisk set forbedre cellefunktionen, reducere inflammation og opretholde vævshomeostase.(12-14)
Fisetin har også vist sig at have neurobeskyttende egenskaber. Det mindsker neuronal skade og forbedrer kognitive funktioner, primært gennem sin antioxidative virkning og modulering af neuronale signalveje.(15-16)
På trods af disse lovende prækliniske resultater er det vigtigt at erkende, at det meste forskning i Fisetin har været begrænset til in vitro- og dyremodeller. Hvis disse resultater skal omsættes til kliniske anvendelser på mennesker, kræver det grundige kliniske forsøg for at fastslå Fisetins effektivitet, sikkerhed og optimale dosering. Heldigvis er der allerede nogle kliniske studier på vej, og vi bør have resultater i løbet af de næste par år.(17-18)
Quercetin
Quercetin er en vigtig antioxidant, der kategoriseres som en flavonol. Det forekommer naturligt i mange grøntsager, frugter, bær, blade og korn. Quercetin findes primært i kapers, radiser, dild, koriander, kål, rødløg, broccoli og bær som tranebær og tyttebær. Quercetin er en af de mest betydningsfulde og almindelige flavonoler, der findes i naturen.

Forskning viser, at quercetin fungerer som et antiviralt, antimikrobielt og antiinflammatorisk middel.(19) Desuden har undersøgelser vist, at quercetin har antihistaminvirkninger, hvilket betyder, at det kan hjælpe med at behandle allergier.(20-21) Den mest betydningsfulde virkning af quercetin på menneskekroppen er dens evne til at reducere stille inflammation.(22)
Quercetins potentiale til at fremme lang levetid kan tilskrives dets antioxidantegenskaber. Som antioxidant fjerner quercetin frie radikaler og reducerer oxidativt stress i kroppen. Forskning har vist, at quercetin kan aktivere sirtuiner (især SIRT-1), som regulerer cellulære processer som DNA-reparation, genekspression og stofskifte. Aktivering af sirtuiner er forbundet med øget levetid i forskellige organismer.(23-24)
Quercetin har også vist sig at aktivere Nrf2-stien, og i cellekernerne aktiverer det transkriptionen af forskellige antioxidantresponselement (ARE)-drevne gener. Disse gener opregulerer udtrykket af cytobeskyttende enzymer, såsom glutathion S-transferase, NAD(P)H quinone dehydrogenase 1 og heme oxygenase-1.(25)
Normalt tages quercetintilskud i en dosis på 500 mg to gange om dagen. Den optimale dosering af quercetin er dog endnu ikke fastlagt. Den anbefalede mængde quercetin i kosten er typisk 5 til 40 mg dagligt, men det kan også indtages i betydeligt større mængder (> 500 mg).
Med hensyn til quercetin er vores anbefaling den liposomale form af det fra Purovitalis.
Apigenin
Apigenin (4′,5,7,-trihydroxyflavon) er en naturligt forekommende flavonoidforbindelse i forskellige planter, bl.a. persille, selleri og citrusfrugter. Der er særligt mange af dem i kamilleplantens blomster. Apigenin har potentiale til at hjælpe med at forebygge kroniske sygdomme som diabetes, Alzheimers, depression, søvnløshed og kræft, med fordele observeret i vivo-forskning (dyre- og menneskestudier).(26)

Et af de mest lovende aspekter ved apigenin er dets evne til at fremme cellulær modstandsdygtighed. Apigenin har vist sig at aktivere Nrf2-stien, som er afgørende for kroppens forsvar mod oxidativ stress og inflammation. Ved at opregulere udtrykket af antioxidantenzymer som superoxiddismutase, katalase og glutathionperoxidase hjælper apigenin med at beskytte cellerne mod skader forårsaget af reaktive iltarter (ROS).(27)
Ud over sine antioxidantegenskaber har apigenin vist sig at have antiinflammatoriske virkninger. Det har vist sig at hæmme produktionen af pro-inflammatoriske cytokiner som TNF-α, IL-1β og IL-6 ved at modulere NF-KB-signalvejen.28) Apigenin er også blevet undersøgt for sine potentielle anti-cancer egenskaber. Undersøgelser har vist, at apigenin kan fremkalde apoptose (programmeret celledød) i forskellige kræftcellelinjer, herunder bryst-, prostata- og tyktarmskræftceller. Apigenin fremmer også autofagi og hjælper dermed med at fjerne dysfunktionelle cellulære elementer.(29-30)
Apigenin er også blevet undersøgt for sin evne til at modulere veje, der er forbundet med aldring. En af disse veje er insulin/IGF-1-signalvejen (IIS), som er kendt for at spille en rolle i reguleringen af levetiden på tværs af forskellige arter. Apigenin har vist sig at hæmme IIS-signalvejen, hvilket potentielt efterligner virkningerne af kaloribegrænsning, en veletableret intervention til fremme af lang levetid.(31-32) Desuden hæmmer apigenin NAD+asen CD38, som er forbundet med metabolisk syndrom, hvilket øger de intracellulære NAD+-niveauer og mindsker den globale proteinacetylering.(33) Med hensyn til aldring er det især enpigenin med til at hæmme de resterende senescente celler i at lave SASP (senescence associated secretory phenotype; se tidligere) for at understøtte cellernes og vævenes sundhed.(34)
Med hensyn til dosering er der ingen universelt anbefalet dosis for apigenintilskud. Undersøgelser har dog brugt doser fra 25 til 100 mg/kg kropsvægt i dyremodeller.(35) Tilskud varierer typisk fra 50 til 500 mg pr. dag. Den mest effektive og sikre dosis er dog endnu ikke endeligt fastlagt. Apigenin anses generelt for at være sikkert, men høje doser kan interagere med visse former for medicin.
Konklusion
Som konklusion på analysen af potentialet i naturlige senolytika er det tydeligt, at forbindelser som fisetin, quercetin og apigenin udviser betydelige senolytiske evner, der kan have en dybtgående indvirkning på aldringsprocessen. Disse stoffer retter sig specifikt mod og eliminerer senescente celler og adresserer dermed en grundlæggende aldringsmekanisme og relaterede patologier. At integrere disse bioaktive forbindelser i sin kost - som stammer fra kilder som jordbær, løg og kamille - er en strategisk tilgang til at forbedre cellefunktionen og mindske ophobningen af celleskader over tid.
Men selv om de prækliniske data er lovende, kræver det yderligere empirisk forskning at omsætte disse resultater til praktiske kliniske strategier for at validere effekt og sikkerhed. Derfor er den fortsatte udforskning af disse forbindelser i strenge kliniske forsøg fortsat afgørende.
Videnskabelige referencer:
- Sikora, E., Arendt, T., Bennett, M., & Narita, M. (2011). Indvirkningen af cellulær senescenssignatur på aldringsforskningen. Anmeldelser af aldringsforskning, 10(1), 146-152.
- He, S., & Sharpless, N. E. (2017). Senescens i sundhed og sygdom. Celle, 169(6), 1000-1011.
- Di Micco, R., Krizhanovsky, V., Baker, D., & d'Adda di Fagagna, F. (2021). Cellulær senescens ved aldring: fra mekanismer til terapeutiske muligheder. Nature Reviews Molecular Cell Biology 22 (2): 75–95.
- Kuilman, T. & Michaloglou, C. & Mooi, W. & Peeper, D. (2010). Essensen af senescens. Gener og udvikling 24 (22): 2463–2479.
- Kirkland, J. L., & Tchkonia, T. (2020). Senolytiske lægemidler: fra opdagelse til oversættelse. Tidsskrift for intern medicin, 288(5), 518-536.
- Sengupta, B. & Banerjee, A. & Sengupta, P. (2005). Interaktioner mellem planteflavonoiden fisetin og makromolekylære mål: indsigt fra fluorescensspektroskopiske undersøgelser. Journal of Photochemistry and Photobiology B: Biology 80 (2): 79–86.
- Bag, S. & Ghosal, S. & Karmakar, S. & Pramanik, G. & Bhowmik, S. (2023). Afdækning af den kontrasterende bindingsadfærd hos planteflavonoiderne Fisetin og Morin, der har sekundære hydroxylgrupper (- OH) med HRAS1 og HRAS2 i-Motif DNA-strukturer: Afkodning af strukturelle ændringer og positionelle påvirkninger. ACS Omega 8 (33): 30315–30329.
- Khan, N. & Syed, D. & Ahmad, N. & Mukhtar, H. (2013). Fisetin: en kostantioxidant til sundhedsfremme. Antioxidanter og redox-signalering 19 (2): 151–162.
- Yousefzadeh, M. et al (2018). Fisetin er et senoterapeutisk middel, der forlænger helbredet og levetiden. EBioMedicine 36: 18-28.
- Wyld, L. et al. (2020). Senescens og kræft: en gennemgang af de kliniske konsekvenser af senescens og senoterapier. Kræft 12 (8): 2134.
- Wang, Y. & He, Y. & Rayman, M. & Zhang, J. (2021). Prospektiv selektiv mekanisme for nye senolytiske midler, der stammer fra flavonoider. Tidsskrift for landbrugs- og fødevarekemi 69 (42): 12418–12423.
- Wiciński, M. et al. (2023). Naturlige fytokemikalier som SIRT-aktivatorer - fokus på potentielle biokemiske mekanismer. Næringsstoffer 15 (16): 3578.
- Afroze, N. et al. (2022). Fisetin forhindrer celleproliferation, inducerer apoptose, lindrer oxidativ stress og inflammation i humane kræftceller, HeLa. International Journal of Molecular Sciences 23 (3): 1707.
- Roy, T. et al. (2023). Dobbelt målretning af mTOR/IL-17A og autofagi ved hjælp af fisetin lindrer psoriasislignende hudbetændelse. Grænser i immunologi 13: 1075804.
- Samanta, S. et al. (2022). De neurobeskyttende virkninger af fisetin, et naturligt flavonoid i neurodegenerative sygdomme: Fokus på rollen som oxidativ stress. Grænser i farmakologi 13: 1015835.
- Singh, S. & Singh, A. & Garg, G. & Rizvi, S. I. (2018). Fisetin som en mimetisk kalorirestriktion beskytter rottehjernen mod aldringsinduceret oxidativ stress, apoptose og neurodegeneration. Biovidenskab 193: 171–179.
- Verdoorn, B. et al. (2021). Fisetin til COVID-19 på plejehjem: Senolytiske forsøg i COVID-æraen. Tidsskrift for det amerikanske geriatriske selskab 69 (11): 3023–3033.
- Kirkland, J. (2024). Lindring af skrøbelighed, inflammation og relaterede mål hos ældre kvinder med Fisetin (AFFIRM). ClinicalTrials.gov ID: NCT03430037.
- Chirumbolo, S. (2010). Quercetins, flavonolers og flavoners rolle i moduleringen af inflammatoriske cellers funktion. Inflammation og allergi-medicinske mål 9 (4): 263–285.
- Chirumbolo, S. (2011). Quercetin som et potentielt antiallergisk lægemiddel: hvilke perspektiver? Iran Journal of Allergy Asthma and Immunology 10 (2): 139–140.
- Sagit, M. et al (2017). Effektiviteten af quercetin i en eksperimentel rotte-model af allergisk rhinitis. European Archives of Oto-Rhino-Laryngology 274 (8): 3087–3095.
- Li, Y. et al. (2016). Quercetin, Inflammation and Immunity. Næringsstoffer 8 (3): 167.
- Costa, L. & Garrick, J. & Roquè, P. & Pellacani, C. (2016). Mekanismer for neurobeskyttelse med quercetin: Modvirker oxidativ stress og meget mere. Oxidativ medicin og cellulær levetid 2016: 2986796.
- Cui, Z. et al. (2022). Terapeutisk anvendelse af quercetin i aldringsrelaterede sygdomme: SIRT1 som en potentiel mekanisme. Grænser i immunologi 13: 943321.
- Suraweera, T. & Rupasinghe, H. & Dellaire, G. & Xu, Z. (2020). Regulation of Nrf2/ARE Pathway by Dietary Flavonoids: En ven eller fjende for kræftbehandling? Antioxidanter 9: 973.
- Salehi, B. et al (2019). Det terapeutiske potentiale i apigenin. International Journal of Molecular Sciences 20 (6): 1305.
- Paredes-Gonzalez, X. et al. (2015). Induktion af NRF2-medieret genekspression ved hjælp af de fytokemiske flavoner apigenin og luteolin i kosten. Biofarmaci & Lægemiddeldisposition 36 (7): 440–451.
- Ginwala, R. & Bhavsar, R. & Chigbu, D. & Jain, P. & Khan, Z. (2019). Flavonoiders potentielle rolle i behandlingen af kroniske inflammatoriske sygdomme med særligt fokus på apigenins anti-inflammatoriske aktivitet. Antioxidanter 8 (2): 35.
- Shukla, S. & Gupta, S. (2010). Apigenin: et lovende molekyle til forebyggelse af kræft. Farmaceutisk forskning 27: 962–978.
- Sung, B. & Chung, H. & Kim, N. (2016). Apigenins rolle i kræftforebyggelse via induktion af apoptose og autofagi. Tidsskrift for kræftforebyggelse 21 (4): 216-226.
- Pan, H. & Finkel, T. (2017). Nøgleproteiner og veje, der regulerer levetiden. Tidsskrift for biologisk kemi 292 (16): 6452–6460.
- Shukla, S. & Gupta, S. (2009). Apigenin undertrykker insulinlignende vækstfaktor I-receptorsignalering i human prostatakræft: En in vitro- og in vivo-undersøgelse. Molekylær carcinogenese 48 (3): 243–252.
- Escande, C. et al (2013). Flavonoiden apigenin er en hæmmer af NAD+ ase CD38: implikationer for cellulær NAD+ metabolisme, proteinacetylering og behandling af metabolisk syndrom. Diabetes 62 (4): 1084–1093.
- Lim, H. & Park, H. & Kim, H. (2015). Effekter af flavonoider på senescens-associeret sekretorisk fænotypedannelse fra bleomycin-induceret senescens i BJ-fibroblaster. Biokemisk farmakologi 96 (4): 337–348.
- Salehi, B. et al (2019). Det terapeutiske potentiale i apigenin. International Journal of Molecular Sciences 20 (6): 1305.