Denne artikel dykker dybt ned i neuroplasticitet og dens dybe indvirkning på kognitiv vækst. Denne artikel tilbyder brugbare måder at forbedre neuroplasticitet og hjernens tilpasningsevne på. Udforsk kognitive øvelser, mindfulness og sensorisk engagement for at fremme hjernens fleksibilitet. Afdæk sammenhængen mellem fysisk aktivitet, ernæring, søvn og optimal neuroplasticitet.
Introduktion til bogen
Neuroplasticitetogså kendt som hjernens plasticitet eller neural plasticitet, henviser til hjernens evne til at reorganisere sig selv ved at danne nye neurale forbindelser og ændre eksisterende. Det kan også kaldes en proces, der involverer adaptive strukturelle og funktionelle ændringer i hjernen. Neuroplasticitet har ændret vores forståelse af hjernen og skabt et videnskabeligt grundlag for den menneskelige hjernes bemærkelsesværdige modstandskraft og tilpasningsevne(1).
Ideen om neuroplasticitet blev først foreslået i begyndelsen af det 20. århundrede af Santiago Ramon y Cajal, den moderne neurovidenskabs fader.(2) Det var dog først i sidste halvdel af det 20. århundrede, at begrebet blev almindeligt anerkendt takket være fremskridt inden for neurovidenskabelig forskning og billeddannelsesteknologi.
Forskning har vist, at hjernen konstant ændrer sig som reaktion på indre og ydre stimuli(3). Hver eneste oplevelse, tanke og følelse kan ændre vores hjernes struktur og funktion. Hvis man f.eks. lærer en ny færdighed som at spille et musikinstrument, jonglere eller tale et nyt sprog, kan det resultere i nye forbindelser mellem neuroner. Samtidig kan traumatiske begivenheder føre til tab af forbindelser.
De mekanismer, der ligger til grund for neuroplasticitet, involverer ændringer i styrken og antallet af forbindelser mellem neuroner og dannelsen af nye neuroner og synapser. Et komplekst samspil mellem genetiske, epigenetiske og miljømæssige faktorer, herunder motion, kost, stress og social interaktion, driver disse ændringer(4).
En af de mest spændende konsekvenser af neuroplasticitet er, at den kan udnyttes til at fremme restitution og rehabilitering efter skade eller sygdom. Hos patienter med slagtilfælde kan intensiv genoptræning f.eks. fremme væksten af nye forbindelser i hjernen og forbedre den motoriske funktion. På samme måde kan mindfulness-baseret meditation reducere mængden af de hjerneområder, der behandler smertesignaler, hos personer med kroniske smerter.
Forskellige typer af neuroplasticitet
Neuroplasticitet kan groft sagt opdeles i to hovedmekanismer: strukturel plasticitet og funktionel plasticitet. Med hensyn til et individs tidslinje kan neuroplasticitet også opdeles i to faser. udviklingsmæssig plasticitet og voksen plasticitet. Det er to aspekter af neuroplasticitet, som opstår på forskellige stadier i livet.

Strukturel plasticitet
Strukturel plasticitet refererer til de fysiske ændringer i hjernen, såsom dannelse eller fjernelse af synapser, vækst eller tilbagetrækning af dendritiske rygsøjler og dannelse eller tab af neuroner. Disse ændringer menes at ligge til grund for hjernens evne til at tilpasse sig nye miljøer og oplevelser, og de er særligt vigtige under udviklingen, hvor hjernen vokser og ændrer sig hurtigt(5).
Funktionel plasticitet
Funktionel plasticitetrefererer på den anden side til ændringer i de neurale kredsløbs funktionelle egenskaber, såsom ændringer i styrken af synaptiske forbindelser eller ændringer i aktivitetsmønsteret i neurale netværk. Disse ændringer ligger til grund for hjernens evne til at lære og huske og til at tilpasse sig skiftende kognitive krav og miljøforhold(6).
Strukturel og funktionel plasticitet er ofte indbyrdes afhængige, og ændringer i den ene mekanisme påvirker den anden. Både strukturel og funktionel plasticitet er kritiske komponenter i neuroplasticitet, som gør det muligt for hjernen at tilpasse sig og ændre sig som reaktion på erfaringer og miljømæssige stimuli.(7)
Udviklingsmæssig plasticitet
Udviklingsplasticitet og voksenplasticitet er to aspekter af neuroplasticitet, som opstår på forskellige stadier i livet. Udviklingsplasticitet refererer til processen med neural plasticitet, der opstår under hjernens udvikling, fra embryonal udvikling gennem barndom og ungdom. I løbet af denne periode er hjernen meget formbar og lydhør over for erfaringer, og neurale forbindelser og kredsløb dannes og forfines som reaktion på sanseindtryk og miljømæssige stimuli. Udviklingsplasticitet spiller en afgørende rolle i hjernens normale udvikling, herunder dannelse af funktionelle neurale kredsløb og etablering af kritiske kognitive og adfærdsmæssige funktioner(8).
Plasticitet hos voksne
I modsætning hertil, voksnes plasticitet hjernens evne til at undergå plastiske forandringer som reaktion på oplevelser eller skader i voksenalderen. Selv om graden af plasticitet generelt er lavere i voksenalderen end under udviklingen, er der stadig en betydelig kapacitet for neural plasticitet i den voksne hjerne.
Voksenplasticitet er den løbende lærings- og tilpasningsproces, der finder sted gennem hele livet. Den spiller en afgørende rolle i opretholdelsen af kognitive og adfærdsmæssige funktioner i skiftende miljøer.(9)
En vigtig forskel mellem udviklingsplasticitet og voksenplasticitet er karakteren af de plastiske ændringer. Under udviklingen involverer plasticitet ofte dannelse af nye synapser, beskæring af ubrugte forbindelser og vækst og reorganisering af dendritiske og aksonale processer. I modsætning hertil involverer voksenplasticitet styrkelse eller svækkelse af eksisterende forbindelser gennem ændringer i synaptisk styrke og vækst af nye forbindelser gennem dannelse af nye synapser eller udspring af nye dendritiske processer.
De vigtigste komponenter i neuroplasticitet
1. Synaptisk plasticitet
Synaptisk plasticitet refererer til synapsernes, forbindelserne mellem neuronerne, evne til at ændre deres styrke som reaktion på aktivitet. Det er en grundlæggende mekanisme, der ligger til grund for indlæring og hukommelse og dannelse af nye neurale forbindelser. Synaptisk plasticitet kan forekomme i både excitatoriske og inhibitoriske synapser og er drevet af ændringer i frigivelsen af neurotransmittere og udtrykket af receptorer på den postsynaptiske membran.
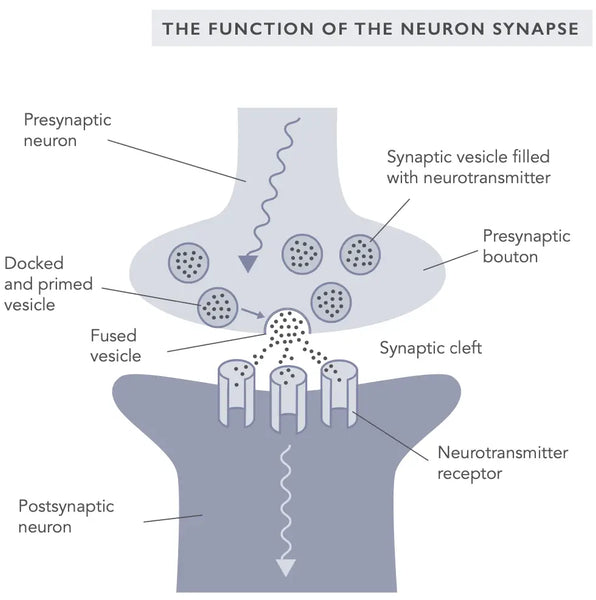
De to mest velundersøgte former for synaptisk plasticitet er langtidspotentiering (LTP) og langtidsdepression (LTD), også kendt som hebbisk plasticitet (med henvisning til neuropsykologen Donald Hebb, som først introducerede synaptisk plasticitet i 1949).(10)
LTP er en proces, hvor styrken af en synapse øges som reaktion på gentagen aktivitet. Det menes at ligge til grund for styrkelsen af neurale forbindelser under indlæring og hukommelsesdannelse. LTD er på den anden side en proces, hvor styrken af en synapse mindskes som reaktion på lavfrekvent eller langvarig aktivitet. LTD menes at spille en rolle i svækkelsen af neurale forbindelser under glemsel og udslettelse.(11) Rlæs mere om LTP, LTD og hukommelsesdannelse på Biohacker's Handbook's Mind-kapitel.
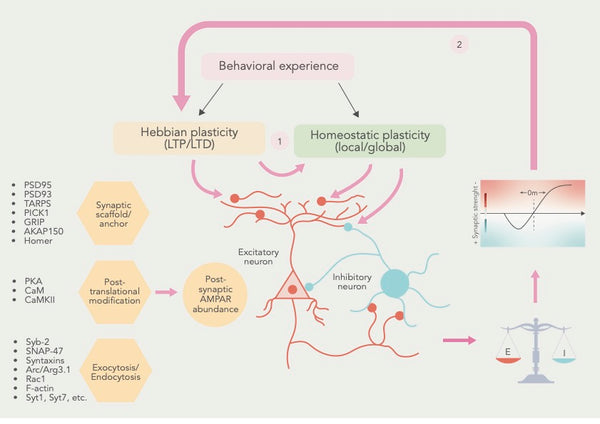
Figur: Det samarbejdende forhold mellem hebbisk og homeostatisk plasticitet.
Kilde: Li, J. & Park, E. & Zhong, L. & Chen, L. (2019). Homeostatisk synaptisk plasticitet som en metaplasticitetsmekanisme - et molekylært og cellulært perspektiv. Aktuel udtalelse i neurobiologi 54: 44–53.
E= Synaptisk excitation I = Synaptisk hæmning
Ud over LTP og LTD er der identificeret mange andre former for synaptisk plasticitet, herunder metaplasticitetsom henviser til ændringer i tærsklen for induktion af LTP og LTD og homøostatisk plasticitetsom henviser til neuroners evne til at justere deres aktivitet som reaktion på ændringer i netværksaktiviteten(12).
Ved at lægge disse former for synaptisk plasticitet sammen har forskerne konkluderet, at hebbisk og homeostatisk synaptisk plasticitet konvergerer mod fælles cellulære processer, og at homeostatisk plasticitet justerer synapsernes tilstand for at påvirke den hebbiske plasticitet (se figuren ovenfor).
Forskellige molekylære og cellulære mekanismer regulerer synaptisk plasticitet, herunder aktiviteten af proteinkinaser og -fosfataser, syntese og nedbrydning af proteiner og ændringer i genekspression. Disse mekanismer er følsomme over for forskellige miljømæssige og erfaringsmæssige faktorer, herunder sensorisk input, stress og social interaktion(13-15).
Neurogenese
Neurogenese er den proces, hvor der dannes nye neuroner i hjernen, især i hippocampusen region, der er vigtig for indlæring og hukommelse. Det er en grundlæggende mekanisme, der ligger til grund for hjernens evne til at tilpasse sig og reagere på miljømæssige og erfaringsmæssige faktorer.
Neurogenese finder sted i den subgranulære zone i hippocampus' dentate gyrus, hvor neurale stamceller giver anledning til intermediære stamceller, som igen giver anledning til umodne neuroner. Disse umodne neuroner migrerer derefter til hippocampus' granulatcellelag, hvor de modnes og integreres i det eksisterende neurale kredsløb. Selvom der også er fundet nye neuroner i andre områder, er omfanget af neurogenese i disse regioner, som f.eks. neocortex og hypothalamus, stadig kontroversielt.(16)
Reguleringen af neurogenese er en kompleks og dynamisk proces, der påvirkes af forskellige faktorer, herunder genetik, epigenetik og miljøfaktorer som motion og stress. Undersøgelser har f.eks. vist, at motion (især aerob motion) kan stimulere neurogenesen ved at frigive vækstfaktorer som hjerneafledt neurotrofisk faktor (BDNF) og insulinlignende vækstfaktor-1 (IGF-1). Omvendt har stress og kronisk inflammation vist sig at forringe neurogenesen via det pro-inflammatoriske cytokin IL-1β.(17-19)
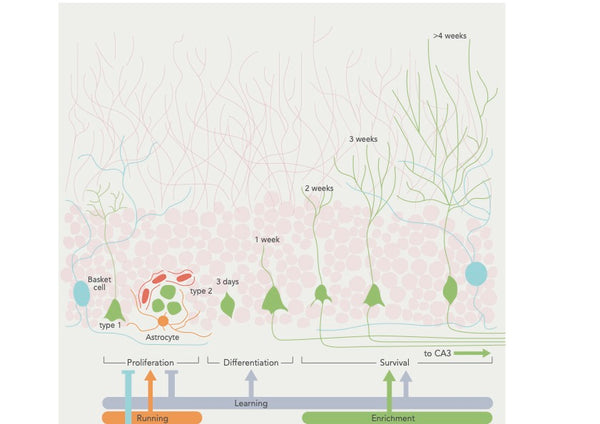
Figur: Regulering af neurogenese ved hjælp af adfærdsmæssige faktorer.
Kilde: Aimone, J. et al. (2014). Regulering og funktion af neurogenese hos voksne: fra gener til kognition. Fysiologiske anmeldelser 94 (4): 991–1026.
Neurogenesens funktionelle rolle er stadig genstand for aktiv forskning, men man mener, at den spiller en rolle i indlæring, hukommelse, humørregulering og stressrespons. Studiet af neurogenese har vigtige implikationer for udviklingen af nye terapier og interventioner for neurologiske og psykiatriske tilstande(20-22).
Dendritisk arborisering
Dendritisk arborisering (eller dendritisk forgrening) henviser til den proces, hvormed dendritterde forgrenede strukturer, der strækker sig fra en neurons cellelegeme, udvikler og uddyber deres forgreningsmønstre. Denne proces er afgørende for at etablere forbindelsen og de funktionelle egenskaber ved neurale kredsløb i hjernen.
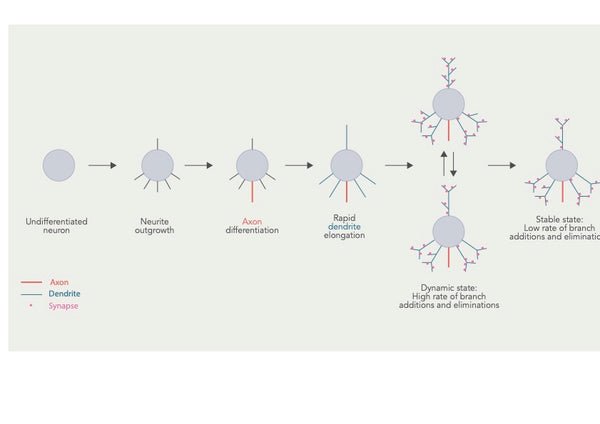 Figur: Udvikling af dendritisk arbor og flere overlappende stadier.
Figur: Udvikling af dendritisk arbor og flere overlappende stadier.
Kilde: Urbanska, M. & Blazejczyk, M. & Jaworski, J. (2008). Molekylær basis for dendritisk arborisering. Acta Neurobiologiae Experimentalis 68 (2): 264–288.
Dendritisk arborisering er en kompleks proces, der reguleres af forskellige faktorer, herunder genetiske og epigenetiske faktorer og miljøfaktorer, som f.eks. sensorisk input og neural aktivitet. Væksten og forgreningen af dendritter drives af aktiviteten af signalveje, der aktiveres af ekstracellulære signaler, som f.eks. vækstfaktorer og neurotransmittere. Disse signaler kan påvirke udtrykket af gener, der er involveret i dendritisk vækst og forgrening.(23)
Reguleringen af dendritisk arborisering er vigtig for at etablere og vedligeholde funktionelle neurale kredsløb i hjernen. For eksempel er dendritisk arborisering afgørende for dannelsen af synapser, kommunikationsstederne mellem neuroner. Dendritternes forgreningsmønstre kan påvirke typerne og antallet af dannede synapser, hvilket i høj grad kan påvirke de neurale kredsløbs funktionelle egenskaber.(24)
Dendritisk arborisering spiller en rolle i behandlingen af sensorisk information. Den er også afgørende for kognitive funktioner og hukommelsesdannelse. Specifikt kan dendritternes forgreningsmønstre påvirke typerne og antallet af dannede synapser, hvilket i høj grad kan påvirke de funktionelle egenskaber i neurale kredsløb, der er involveret i indlæring og hukommelse(25).
Undersøgelser har vist, at ændringer i dendritisk arborisering kan forekomme som reaktion på læringserfaringer, og disse ændringer menes at bidrage til dannelsen og vedligeholdelsen af nye erindringer. For eksempel har træning i en rumlig hukommelsesopgave hos gnavere øget dendritisk forgrening i hippocampus, et hjerneområde, der er afgørende for rumlig indlæring og hukommelse(26).
Desuden har undersøgelser vist, at ændringer i dendritisk arborisering er forbundet med kognitive underskud i neurodegenerative sygdomme. Ved Alzheimers sygdom går dendritiske rygsøjler, de strukturer på dendritter, der danner synapser med andre neuroner, tabt i de ramte hjerneområder, hvilket fører til nedsat synaptisk plasticitet og kognitive forstyrrelser(30).
Myelinisering
Myelinisering er en biologisk proces, hvor aksoner, de langstrakte og slanke cellulære forlængelser af neuroner, som overfører elektriske impulser til andre neuroner, bliver omsluttet af et lipidrigt stof kaldet myelin. Myelinskeden produceres af oligodendrocytter i centralnervesystemet (CNS) og Schwann-celler i det perifere nervesystem (PNS). Myelin fungerer som en isolator, der gør det muligt for elektriske signaler at bevæge sig hurtigere og mere effektivt langs aksoner.(27)
Myeliniseringsprocessen begynder under den embryonale udvikling og fortsætter ind i den tidlige voksenalder, hvor forskellige hjerne- og nervesystemregioner myeliniseres på forskellige tidspunkter. Generelt begynder myeliniseringen i hjernestammen og rygmarven og skrider frem til hjernebarken og andre højere hjerneområder.(28) Myelinskederne forbliver typisk af samme længde i lange perioder, hvilket tyder på, at der ikke sker store ændringer i strukturen af det eksisterende myelin (se billedet nedenfor).(29)
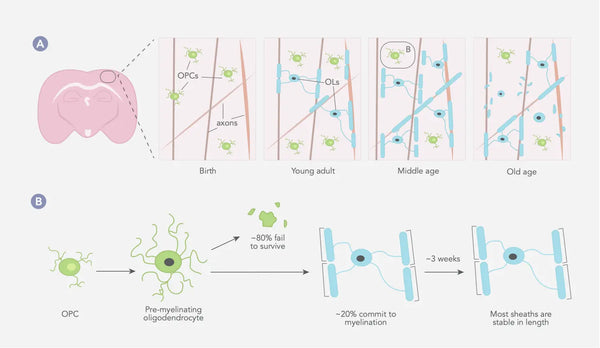
Figur: Oligodendrocyt- og myelindynamik i pattedyrs somatosensoriske cortex gennem hele livet.
Kilde: Williamson, J. & Lyons, D. (2018). Myelindynamik gennem hele livet: et landskab i konstant forandring? Grænser i cellulær neurovidenskab 12: 424.
OPC = Oligodendrocyt-forløberceller OL'er = oligodendrocytter
Reguleringen af myelinisering er en kompleks proces, der påvirkes af forskellige faktorer, herunder genetik, epigenetik og miljøfaktorer som erfaring og neural aktivitet. Undersøgelser har f.eks. vist, at sanseoplevelser kan påvirke hjernens timing og omfang af myelinisering. På samme måde kan neural aktivitet fremme myelinisering ved at frigive signalmolekyler som BDNF.
I centralnervesystemet aktiveres myeliniseringsprocessen af aksonal aktivitet og astrocytter, mens mikroglia/makrofager er ansvarlige for fjernelsen af myelin. Når aksoner er blevet myeliniseret, er deres fortsatte sundhed og funktionalitet afhængig af, at gliacellerne leverer essentielle metabolitter og neurotrofiske faktorer.(31)
Myeliniseringens funktionelle rolle er afgørende for en effektiv transmission af neurale signaler i hjernen og nervesystemet. Myelinisering er nøglen til kognitive og motoriske funktioner, herunder opmærksomhed, indlæring og koordination. Derudover er myelinisering også nødvendig for at udvikle hvid substans, hjernens netværk af aksonale forbindelser, der gør det muligt for forskellige hjerneområder at kommunikere og koordinere deres aktiviteter.(32)
Kortikal reorganisering
Kortikal reorganisering, også kendt som kortikal plasticitetrefererer til hjernens evne til at reorganisere sine neurale netværk som reaktion på ændringer i sensorisk input eller andre former for erfaring. Denne proces er afgørende for udviklingen af funktionelle neurale kredsløb og for hjernens evne til at tilpasse sig ændringer i miljøet. Kortikal reorganisering sker på flere hjerneniveauer, fra de primære sensoriske områder til associationsområder på højere niveau.(33)
De mekanismer, der ligger til grund for kortikal reorganisering, involverer ændringer i synaptisk styrke og neuronal konnektivitet. For eksempel har undersøgelser vist, at ændringer i sensorisk input kan føre til ændringer i styrken og antallet af synapser i de berørte kortikale regioner. På samme måde kan ændringer i erfaring eller adfærd føre til ændringer i mønsteret af neural aktivitet og styrken og specificiteten af synaptiske forbindelser(34).
De funktionelle konsekvenser af kortikal reorganisering kan være gavnlige eller skadelige. På den ene side kan kortikal reorganisering gøre det muligt for hjernen at tilpasse sig miljøændringer og komme sig efter skader eller sygdomme. På den anden side kan kortikal reorganisering også bidrage til udviklingen af uhensigtsmæssige neurale kredsløb og kroniske smertesyndromer.
Et andet eksempel er tinnitusen tilstand, hvor personer opfatter en ringende eller anden lyd uden en ekstern stimulus. Undersøgelser har vist, at kortikal reorganisering i den auditive cortex kan spille en rolle i udviklingen og vedligeholdelsen af tinnitus. Specifikt kan hjernen reorganiseres som reaktion på skader på det auditive system, hvilket fører til opfattelsen af fantomlyde(35).
Interventioner, der fremmer kortikal reorganisering (f.eks. hjerneplasticitetsbaseret terapi), kan være nyttige i behandlingen af kroniske smertesyndromer, slagtilfælde og andre former for neurologiske skader.(36)
Naturlige faktorer, der øger neuroplasticiteten
Flere naturlige og teknologiske metoder har vist sig at fremme neuroplasticitet og forbedre hjernens funktion.
Nedenfor er listet de bedste generelle livsstilsfaktorer til at forbedre neuroplasticiteten:
- Søvn: Tilstrækkelig søvn (og dyb søvni særdeleshed) er afgørende for hjernens funktion og har vist sig at fremme neuroplasticitet ved at forbedre synaptisk plasticitet og lette konsolideringen af minder og øge indlæringsevnen.(37-38)
- Træning: Fysisk træning har vist sig at øge neuroplasticiteten ved at fremme dannelsen af nye neuroner, øge væksten af dendritiske rygsøjler og forbedre funktionen af eksisterende neurale netværk. Især aerob træning har vist sig at øge de neurotrofiske faktorer (BDNF, NGF og GDNF), som er proteiner, der fremmer væksten og overlevelsen af neuroner og gliaceller(39-41).
- Meditation: Mindfulness-meditation har vist sig at fremme neuroplasticitet ved at øge tætheden af grå substans i de områder af hjernen, der er forbundet med opmærksomhed, følelsesregulering og selvbevidsthed. Det kan også forbedre integriteten af den hvide substans, som er afgørende for kommunikationen mellem forskellige hjerneområder.(42-44)
- Periodisk faste: Periodisk faste, som indebærer en begrænsning af det daglige fødeindtag til bestemte timer, forbedrer neuroplasticiteten ved at fremme væksten af nye neuroner og synaptisk plasticitet. Det kan også forbedre den kognitive funktion og reducere risikoen for neurodegenerative sygdomme.(45)
- Intermitterende metabolisk skift (IMS): En livsstil, der indebærer skiftende perioder med metabolisk stress og restitution, f.eks. faste og motion efterfulgt af spisning, hvile og søvn, er blevet foreslået for at forbedre hjernens funktion og modstandskraft. IMS kan fremme sundheden og funktionen af de neuronale kredsløb, der understøtter kognitive evner og følelsesmæssigt velvære gennem hele livet. Det har en bred indvirkning på flere signalveje, der øger neuroplasticiteten og forbedrer hjernens modstandsdygtighed over for skader og sygdomme.(46)
- Socialt engagement: Social interaktion og engagement har vist sig at fremme neuroplasticitet ved at øge væksten af nye neuroner og forbedre funktionen af eksisterende neurale netværk. Nogle undersøgelser har antydet, at socialt engagement endda kan beskytte mod kognitiv tilbagegang og udbrud af neurodegenerative sygdomme som Alzheimers sygdom. Derfor kan det at opretholde et stærkt socialt netværk og deltage i regelmæssige sociale aktiviteter være en effektiv måde at støtte og forbedre neuroplasticiteten på gennem hele livet(47-48).
- Berigelse af miljøet: En tilgang, hvor en organismes levevilkår optimeres for at give forskellig sensorisk, kognitiv og motorisk stimulering. Denne strategi har vist sig at fremme neuroplasticitet ved at fremkalde ændringer i neural aktivitet og morfologi. Specifikt har det vist sig, at miljøberigelse øger væksten af nye neuroner, fremmer synaptisk plasticitet og forbedrer funktionen af eksisterende neurale netværk, hvilket resulterer i forbedrede kognitive, adfærdsmæssige og følelsesmæssige resultater.(49-50)
- Kognitiv træning: Aktiviteter, der udfordrer hjernen for at forbedre hjernens neuroplasticitet. Det kan være at lære et nyt sprog, spille et musikinstrument eller løse gåder - det kan forbedre neuroplasticiteten ved at fremme væksten af nye neuroner og synaptisk plasticitet.(51-52)
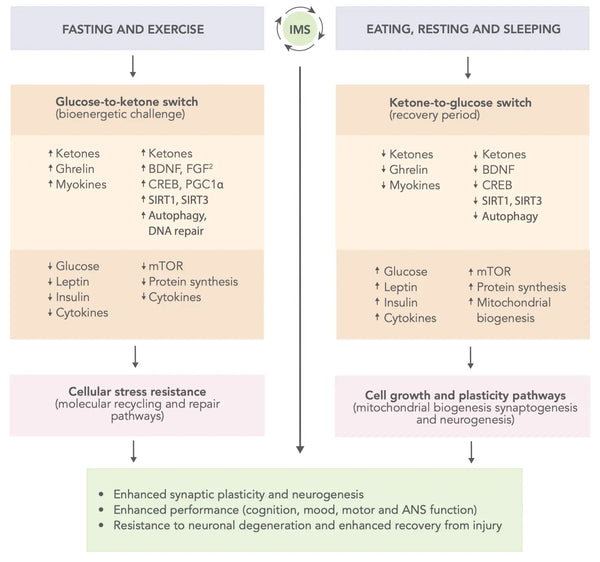
Figur: En skematisk model for, hvordan intermitterende metaboliske skift kan optimere hjernens ydeevne og øge modstandsdygtigheden over for skader og sygdomme.
Kilde: Mattson, M. & Moehl, K. & Ghena, N. & Schmaedick, M. & Cheng, A. (2018). Intermitterende metabolisk skift, neuroplasticitet og hjernesundhed. Nature Reviews Neuroscience 19 (2): 81–94.
Ernæringsmæssige faktorer, der understøtter neuroplasticitet
- Omega-3 fedtsyrer: Langkædede omega-3-fedtsyrer, især docosahexaensyre (DHA), har vist sig at fremme neuroplasticitet ved at forbedre synaptisk plasticitet og øge væksten af dendritiske rygsøjler. De kan også reducere inflammation i hjernen, som kan forringe neuroplasticiteten. Kilder til omega-3 omfatter fed fisk som laks og sardiner og kosttilskud.(53-55)
- Curcumin: Curcumin, en forbindelse, der findes i gurkemeje, har vist sig at forbedre neuroplasticiteten ved at fremme væksten af nye neuroner og styrke den synaptiske plasticitet. Det kan også have antiinflammatoriske virkninger, som kan forbedre hjernens funktion. Interessant nok kan curcumin også afhjælpe nedsat kognition og neuronal plasticitet forårsaget af kronisk stress(56-57). Prøv AGEless Defense-tilskuddet, der indeholder B-vitaminer, polyfenoler, aminosyrer og curcumin.
- B-vitaminer: B-komplekse vitaminer og cholin har vist sig at forbedre hjernens neuroplasticitet. De spiller en afgørende rolle i forskellige metaboliske veje, der understøtter hjernens funktion, herunder syntetisering af neurotransmittere og myelin. B-vitaminer, især B12-vitamin og folat, er også involveret i DNA-methylering, som kan påvirke genekspressionen i neuroplasticiteten.(58-62)
- D-vitamin: Noget tyder på, at D-vitamin kan spille en rolle i at fremme neuroplasticitet. Der er fundet D-vitaminreceptorer i forskellige hjerneområder, herunder hippocampus, som er involveret i indlæring og hukommelse. Undersøgelser af dyr og mennesker har antydet, at mangel på D-vitamin kan forringe den kognitive funktion og nedsætte produktionen af specifikke neurotrofiske faktorer, der er vigtige for at fremme neuroplasticitet(63-64). Få Ecosh K2+D3-vitamin for at maksimere neuroplasticiteten.
- Polyfenoler: Polyfenoler har vist sig at forbedre neuroplasticiteten i hjernen. En af mekanismerne er deres evne til at modulere signalveje, der er involveret i synaptisk plasticitet og neurogenese. De kan også udøve antiinflammatoriske effekter og beskytte mod oxidativ stress, forbedre neuronal funktion og fremme neuroplasticitet. Generelt kan polyfenoler forhindre udviklingen af neurodegenerative patologier.(65-66) - Prøv en af de bedste polyfenoler: Purovitalis Liposomal Quercetin
Teknologiske metoder, der understøtter neuroplasticitet
- Transkraniel magnetisk stimulering (TMS): TMS er en ikke-invasiv teknik, der bruger magnetfelter til at stimulere neural aktivitet i specifikke hjerneområder. Det har vist sig at øge neuroplasticiteten og forbedre den kognitive funktion i forskellige sammenhænge, herunder hos personer med depression, angst og slagtilfælde(67-69). Køb NeoRhythm OmniPEMF neurostimuleringsenhed her. [se billedet nedenfor].
- Hjernestimulering: Ud over TMS har andre former for hjernestimulering, såsom transkraniel jævnstrømsstimulering (tDCS) og transkraniel vekselstrømsstimulering (tACS), vist sig at øge neuroplasticiteten og forbedre den kognitive funktion.(70-71) Læs mere om tDCS fra Biohackerens håndbog.
- Neurofeedback: Neurofeedback er en teknik, der involverer overvågning af hjernens elektriske aktivitet og giver feedback til den enkelte i realtid. Det har vist sig at forbedre neuroplasticiteten ved at fremme væksten af nye neuroner og synaptisk plasticitet. Neurofeedback er blevet brugt til at behandle ADHD (attention deficit hyperactivity disorder), angst og andre neurologiske tilstande.(72-74) Læs mere om neurofeedback på Biohackerens håndbog.
- Virtuel virkelighed (VR): Virtual reality er en fordybende teknologi til træning, rehabilitering og terapeutiske formål. I de senere år har der været stigende interesse for at bruge VR til at forbedre hjernens neuroplasticitet. VR kan forbedre neuroplasticiteten ved at skabe et stimulerende og engagerende miljø, der udfordrer hjernen til at tilpasse sig og lære. VR kan f.eks. simulere scenarier fra det virkelige liv og give mulighed for at lære og øve sig i et sikkert og kontrolleret miljø. Det kan være med til at fremme væksten af nye neuroner og forbedre den synaptiske plasticitet.(75-76)
- Software til kognitiv træning: Kognitiv træningssoftware bruger computerprogrammer til at forbedre den kognitive funktion ved at udfordre hjernen med hukommelsesøvelser, problemløsningsopgaver og opmærksomhedsopgaver. Derudover kan mental træning stimulere frigivelsen af visse neurotransmittere, såsom dopamin og acetylcholin, som kan forbedre synaptisk plasticitet og kognitiv funktion og øge BDNF i hjernen.(77-79)
Konklusion
Konklusionen er, at hjernens bemærkelsesværdige evne til at omforme sig selv gennem forskellige former for neuroplasticitet - udviklingsmæssig, voksen, strukturel og funktionel - åbner op for en verden af muligheder for personlig vækst og kognitiv forbedring. Ved at anvende denne artikels strategier får du redskaberne til at begive dig ud på en transformativ rejse. Du former aktivt din hjernes fremtid ved at deltage i mentale øvelser, dyrke mindfulness og prioritere sunde vaner. Husk, at nøglen ligger i konsekvens og dedikation. Så kast dig ud i det spændende eventyr med at åbne op for din hjernes potentiale.
Hvis du vil tage dit spil til den næste oktav, kan du forudbestille vores store efterfølger til Biohacker's Handbook, the Resilient Being Book.
P.S. Denne artikel er baseret på teksten fra Mental Resilience-delen af Resilient Being Book.
Referencer:
- Puderbaugh, M. & Emmady, P. (2022). Neuroplasticitet. I StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing.
- Venkataramani, P. (2010). Santiago Ramón y Cajal: neurovidenskabens fader. Resonans 15 (11): 968–976.
- Draganski, B. & Gaser, C. & Busch, V. & Schuierer, G. & Bogdahn, U. & May, A. (2004). Ændringer i grå substans forårsaget af træning. Natur 427 (6972): 311–312.
- Kleim, J. & Jones, T. (2008). Principper for erfaringsafhængig neural plasticitet: konsekvenser for rehabilitering efter hjerneskade. Journal of Speech Language and Hearing Research 51: S225-S239.
- Bozelos, P. & Poirazi, P. (2017). Virkningen af strukturel plasticitet på hukommelseskapaciteten. I Den genskabende hjerne (s. 319-341). Cambridge (USA): Academic Press.
- Grafman, J. (2000). Konceptualisering af funktionel neuroplasticitet. Tidsskrift for kommunikationsforstyrrelser 33 (4): 345–356.
- Taubert, M. et al. (2010). Dynamiske egenskaber ved den menneskelige hjernestruktur: læringsrelaterede ændringer i kortikale områder og tilhørende fiberforbindelser. Tidsskrift for neurovidenskab 30 (35): 11670–11677.
- Kolb, B. & Gibb, R. (2011). Hjerneplasticitet og adfærd i den udviklende hjerne. Journal of the Canadian Academy of Child and Adolescent Psychiatry 20 (4): 265–276.
- Fuchs, E. & Flügge, G. (2014). Neuroplasticitet hos voksne: mere end 40 års forskning. Neural plasticitet 2014: 541870
- Hebb, D. (1949). Organiseringen af adfærd: En neuropsykologisk teori. New York: John Wiley and Sons.
- Bliss, T. & Collingridge, G. (1993). En synaptisk model for hukommelse: langtidspotentiering i hippocampus. Natur 361 (6407): 31–39.
- Li, J. & Park, E. & Zhong, L. & Chen, L. (2019). Homeostatisk synaptisk plasticitet som en metaplasticitetsmekanisme - et molekylært og cellulært perspektiv. Aktuel udtalelse i neurobiologi 54: 44–53.
- Magee, J. & Grienberger, C. (2020). Synaptiske plasticitetsformer og -funktioner. Årlig gennemgang af neurovidenskab 43: 95–117.
- Vitureira, N. & De Pasquale, R. & Leão, R. & Rossi, F. (2022). Cellulære og molekylære mekanismer for synaptisk plasticitet ved hippocampale og kortikale synapser. Grænser i cellulær neurovidenskab 16: 980623.
- Fox, K. & Stryker, M. (2017). Integration af hebbisk og homeostatisk plasticitet: introduktion. Philosophical Transactions of the Royal Society B: Biological Sciences 372 (1715): 20160413.
- Aimone, J. et al. (2014). Regulering og funktion af neurogenese hos voksne: fra gener til kognition. Fysiologiske anmeldelser 94 (4): 991–1026
- Cotman, C. & Berchtold, N. (2002). Motion: en adfærdsmæssig intervention til forbedring af hjernens sundhed og plasticitet. Tendenser i neurovidenskab 25 (6): 295–301.
- Vecchio, L. et al (2018). De neurobeskyttende virkninger af motion: opretholdelse af en sund hjerne gennem aldring. Hjernens plasticitet 4 (1): 17–52.
-
Saxe, M. et al. (2006). Ablation af hippocampal neurogenese forringer kontekstuel frygtkonditionering og synaptisk plasticitet i dentate gyrus. Proceedings of the National Academy of Sciences 103 (46): 17501–17506.
- Aimone, J. et al. (2014). Regulering og funktion af voksen neurogenese: fra gener til kognition. Fysiologiske anmeldelser 94 (4): 991–1026.
- Ming, G. & Song, H. (2011). Voksen neurogenese i pattedyrshjernen: vigtige svar og vigtige spørgsmål. Neuron 70 (4): 687–702.
- Urbanska, M. & Blazejczyk, M. & Jaworski, J. (2008). Molekylær basis for dendritisk arborisering. Acta Neurobiologiae Experimentalis 68 (2): 264–288.
- Cline, H. (2001). Dendritisk arborudvikling og synaptogenese. Aktuel udtalelse i neurobiologi 11 (1): 118–126.
- Kasai, H. & Fukuda, M. & Watanabe, S. & Hayashi-Takagi, A. & Noguchi, J. (2010). Strukturel dynamik i dendritiske rygsøjler i hukommelse og kognition. Tendenser i neurovidenskab 33 (3): 121–129.
- Holtmaat, A. & Svoboda, K. (2009). Erfaringsafhængig strukturel synaptisk plasticitet i pattedyrhjernen. Nature Reviews Neuroscience 10 (9): 647–658.
- Demerens, C. et al (1996). Induktion af myelinisering i centralnervesystemet ved hjælp af elektrisk aktivitet. Proceedings of the National Academy of Sciences 93 (18): 9887–9892.
- Harry, G. & Toews, A. (1998). Myelinisering, dysmyelinisering og demyelinisering. Håndbog i udviklingsmæssig neurotoksikologi 87–115.
- Williamson, J. & Lyons, D. (2018). Myelindynamik gennem hele livet: et landskab i konstant forandring? Grænser i cellulær neurovidenskab 12: 424.
- Scheff, S. & Price, D. & Schmitt, F. & Mufson, E. (2006). Hippocampal synaptisk tab i tidlig Alzheimers sygdom og mild kognitiv svækkelse. Aldringens neurobiologi 27 (10): 1372–1384.
- Nave, K. & Werner, H. (2014). Myelinisering af nervesystemet: mekanismer og funktioner. Årlig gennemgang af celle- og udviklingsbiologi 30: 503–533
- Fields, R. (2015). En ny mekanisme for nervesystemets plasticitet: aktivitetsafhængig myelinisering. Nature Reviews Neuroscience 16 (12): 756–767.
- Pascual-Leone, A. & Amedi, A. & Fregni, F. & Merabet, L. (2005). Den plastiske menneskelige hjernebark. Årlige anmeldelser af neurovidenskab 28: 377–401.
- Schoups, A. & Vogels, R. & Qian, N. & Orban, G. (2001). Øvelse af orienteringsidentifikation forbedrer orienteringskodning i V1-neuroner. Natur 412 (6846): 549–553.
- Mühlnickel, W. & Elbert, T. & Taub, E. & Flor, H. (1998). Reorganisering af den auditive cortex ved tinnitus. Proceedings of the National Academy of Sciences 95 (17): 10340–10343.
- Merzenich, M. & Van Vleet, T. & Nahum, M. (2014). Hjerneplasticitetsbaseret terapi. Grænser inden for human neurovidenskab 8: 385.
- Fattinger, S. et al. (2017). Dyb søvn opretholder den menneskelige hjernes indlæringseffektivitet. Nature Communications 8 (1): 15405.
- Voss, M. et al. (2010). Plasticitet af hjernenetværk i et randomiseret interventionsforsøg med motionstræning hos ældre voksne. Grænser i aldrende neurovidenskab 2: 32.
- e Sousa Fernandes, M. et al. (2020). Effekter af fysisk træning på neuroplasticitet og hjernefunktion: en systematisk gennemgang af menneske- og dyreforsøg. Neural plasticitet 2020: 8856621
- Hölzel, B. et al (2011). Mindfulness-praksis fører til stigninger i den regionale tæthed af grå substans i hjernen. Psykiatrisk forskning: Neuroimaging 191 (1): 36–43.
- Tang, Y. & Hölzel, B. K. & Posner, M. (2015). Neurovidenskaben bag mindfulness-meditation. Nature Reviews Neuroscience 16 (4): 213–225.
- Lardone, A. et al. (2018). Mindfulness-meditation er relateret til langvarige ændringer i hippocampus' funktionelle topologi i hviletilstand: en magnetoencefalografisk undersøgelse. Neural plasticitet 2018: 5340717.
- Brocchi, A. & Rebelos, E. & Dardano, A. & Mantuano, M. & Daniele, G. (2022). Virkninger af periodisk faste på hjernens stofskifte. Næringsstoffer 14 (6): 1275.
- Mattson, M. & Moehl, K. & Ghena, N. & Schmaedick, M. & Cheng, A. (2018). Periodisk metabolisk skift, neuroplasticitet og hjernens sundhed. Nature Reviews Neuroscience 19 (2): 81–94.
- Kramer, A. & Bherer, L. & Colcombe, S. & Dong, W. & Greenough, W. (2004). Miljømæssige påvirkninger af kognitiv og hjernemæssig plasticitet under aldring. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences 59 (9): M940-M957.
- Fratiglioni, L. & Paillard-Borg, S. & Winblad, B. (2004). En aktiv og socialt integreret livsstil i den sene del af livet kan beskytte mod demens. The Lancet Neurology 3 (6): 343–353.
- Kempermann, G. (2015). Aktivitetsafhængighed og aldring i reguleringen af neurogenese hos voksne. Cold Spring Harbor Perspectives in Biology 7 (11): a018929.
- Van Praag, H. & Kempermann, G. & Gage, F. (2000). Neurale konsekvenser af miljøberigelse. Nature Reviews Neuroscience 1 (3): 191–198
- Lövdén, M. & Bäckman, L. & Lindenberger, U. & Schaefer, S. & Schmiedek, F. (2010). En teoretisk ramme for studiet af voksnes kognitive plasticitet. Psykologisk Bulletin 136 (4): 659–676
- Park, D. & Bischof, G. (2013). Det aldrende sind: neuroplasticitet som reaktion på kognitiv træning. Dialoger i klinisk neurovidenskab 15 (1): 109–119.
- Crupi, R. & Marino, A. & Cuzzocrea, S. (2013). n-3-fedtsyrer: rolle i neurogenese og neuroplasticitet. Aktuel medicinsk kemi 20 (24): 2953–2963.
- Swanson, D. & Block, R. & Mousa, S. A. (2012). Omega-3-fedtsyrerne EPA og DHA: sundhedsmæssige fordele gennem hele livet. Fremskridt inden for ernæring 3 (1): 1–7.
- Dyall, S. (2015). Langkædede omega-3-fedtsyrer og hjernen: en gennemgang af de uafhængige og fælles effekter af EPA, DPA og DHA. Grænser i aldrende neurovidenskab 7: 52.
- Maharjan, R. et al. (2020). Livsstilens rolle i neuroplasticitet og neurogenese i en aldrende hjerne. Cureus 12 (9): e10639.
- Xu, Y. et al. (2009). Curcumin vender nedsat kognition og neuronal plasticitet induceret af kronisk stress. Neurofarmakologi 57 (4): 463–471.
- Echeverry, M. et al. (2021). Vitaminerne D og B 12, ændret synaptisk plasticitet og ekstracellulær matrix. I B-Complex Vitamins-Sources, Intakes and Novel Applications. IntechOpen.
- Downey, L. et al. (2019). Øget posterior cingulate funktionel konnektivitet efter 6 måneders højdosis B-vitamin multivitamintilskud: et randomiseret, dobbeltblindt, placebokontrolleret forsøg. Grænser i ernæring 6: 156.
- Mattson, M. & Shea, T. (2003). Folat- og homocysteinmetabolisme i neural plasticitet og neurodegenerative lidelser. Tendenser i neurovidenskab 26 (3): 137–146.
- Chin, E. & Goh, E. (2019). Modulering af neuronal plasticitet med cholin. Forskning i neural regeneration 14 (10): 1697.
- Jadavji, N. & Emmerson, J. & MacFarlane, A. & Willmore, W. & Smith, P. (2017). Tilskud af B-vitaminer og cholin øger neuroplasticiteten og restitutionen efter et slagtilfælde. Sygdommens neurobiologi 103: 89–100.
- Mayne, P. & Burne, T. (2019). D-vitamin i synaptisk plasticitet, kognitiv funktion og neuropsykiatrisk sygdom. Tendenser i neurovidenskab 42 (4): 293–306.
- Echeverry, M. et al. (2021). Vitamin D og B 12, ændret synaptisk plasticitet og ekstracellulær matrix. I B-Complex Vitamins-Sources, Intakes and Novel Applications. IntechOpen.
- Vauzour, D. (2012). Polyphenoler i kosten som modulatorer af hjernens funktioner: biologiske handlinger og molekylære mekanismer, der ligger til grund for deres gavnlige virkninger. Oxidativ medicin og cellulær levetid 2012: 914273.
- Figueira, I. & Menezes, R. & Macedo, D. & Costa, I. & Nunes dos Santos, C. (2017). Polyfenoler hinsides barrierer: et glimt ind i hjernen. Aktuel neurofarmakologi 15 (4): 562–594.
- Hallett, M. (2007). Transkraniel magnetisk stimulation: en grundbog. Neuron 55 (2): 187–199.
- Jannati, A. & Oberman, L. & Rotenberg, A. & Pascual-Leone, A. (2023). Vurdering af mekanismerne for hjernens plasticitet ved transkraniel magnetisk stimulering. Neuropsykofarmakologi 48 (1): 191–208.
- Auriat, A. & Neva, J. & Peters, S. & Ferris, J. & Boyd, L. (2015). En gennemgang af transkraniel magnetisk stimulering og multimodal neuroimaging til karakterisering af neuroplasticitet efter slagtilfælde. Grænser i neurologi 6: 226.
- Kricheldorff, J. et al (2022). Bevis for neuroplastiske ændringer efter transkraniel magnetisk, elektrisk og dyb hjernestimulering. Hjernevidenskab 12 (7): 929.
- Brunoni, A. et al (2012). Klinisk forskning med transkraniel jævnstrømsstimulering (tDCS): udfordringer og fremtidige retninger. Hjernestimulering 5 (3): 175–195.
- Gruzelier, J. (2014). EEG-neurofeedback til optimering af præstationer. III: en gennemgang af metodologiske og teoretiske overvejelser. Neurovidenskabelige og bioadfærdsmæssige anmeldelser 44: 159–182.
- Trambaiolli, L. & Cassani, R. & Mehler, D. & Falk, T. (2021). Neurofeedback og den aldrende hjerne: en systematisk gennemgang af træningsprotokoller for demens og mild kognitiv svækkelse. Grænser i aldrende neurovidenskab 13: 682683.
- Sitaram, R. et al (2017). Hjernetræning i lukket kredsløb: videnskaben om neurofeedback. Nature gennemgår neurovidenskab 18 (2): 86–100.
- Laver, K. & George, S. & Thomas, S. & Deutsch, J. & Crotty, M. (2015). Virtual reality til slagtilfælde-rehabilitering: en forkortet version af en Cochrane-gennemgang. European Journal of Physical and Rehabilitation Medicine 51 (4): 497–506.
- Huang, C. et al (2022). Effekter af virtual reality-baseret motorisk kontroltræning på inflammation, oxidativt stress, neuroplasticitet og motorisk funktion i overekstremiteterne hos patienter med kronisk slagtilfælde: et randomiseret kontrolleret forsøg. BMC Neurologi 22 (1): 21.
- Anguera, J. et al. (2013). Videospilstræning forbedrer kognitiv kontrol hos ældre voksne. Natur 501 (7465): 97–101.
- Lampit, A. et al. (2014). Tidsforløbet for globale kognitive gevinster ved superviseret computerassisteret kognitiv træning: et randomiseret, aktivt kontrolleret forsøg med ældre med flere risikofaktorer for demens. The Tidsskrift for forebyggelse af Alzheimers sygdom 1 (1): 33–39.
- D'Antonio, J. et al (2019). Kognitiv træning og neuroplasticitet ved mild kognitiv svækkelse (COG-IT): protokol for et blindet, randomiseret, kontrolleret behandlingsforsøg på to steder. BMJ Open 9 (8): e028536.







