Studiet af resiliens gennem genetiske briller er et voksende interessefelt, der ofte krydser disciplinerne psykologi, neurobiologi og genomik. Mens begrebet resiliens - evnen til at komme sig over eller tilpasse sig modgang eller stress - er mangefacetteret og påvirkes af et komplekst samspil mellem genetiske, miljømæssige og psykologiske faktorer, er der udviklet specifikke DNA-tests til at kaste lys over de genetiske komponenter i denne egenskab.
Introduktion
Gener er DNA-segmenter, der indeholder de instruktioner, som kroppen skal bruge til at lave hvert af de mange tusinde proteiner, der er nødvendige for livet. Hvert gen består af tusindvis af kombinationer af "bogstaver" (kaldet baser), som udgør din genetiske kode. Koden giver instruktioner til at fremstille de proteiner, der er nødvendige for korrekt udvikling og funktion.(1)
Genetiske variationer kan påvirke udtrykket af et gen og dermed påvirke metaboliske processer, som er vigtige for at opretholde cellernes sundhed, og hvordan vi reagerer på miljømæssige indgreb som kost, livsstil, kosttilskud og medicin.
Viden om disse genetiske variationer giver en uovertruffen indsigt i biologiske systemer, så sundhedspersonalet kan anbefale præcise indgreb, der kan hjælpe med at nå ens mål og opnå optimal sundhed.
Forståelse af genetiske markører for resiliens
Modstandsdygtighed-evnen til at komme sig over eller let tilpasse sig modgang eller forandring - ses i stigende grad gennem genetik. Ved at undersøge genetiske markører forsøger forskere og klinikere at afdække det biologiske grundlag, der kan forklare, hvorfor nogle personer kommer sig bedre over stress og traumer end andre.(2) Dette spirende forskningsfelt har fokuseret på resiliens-relaterede DNA-tests, der undersøger genetiske markører, som potentielt er ansvarlige for forskellene i individuelle stressresponser.
Kernen i denne forskning er det endokrine system og nervesystemet. (især det autonome nervesystem), som er centrale for kroppens reaktion på stress. Især hypothalamus-hypofyse-binyre-aksen (HPA) er et centralt fokusområde, da den spiller en afgørende rolle i reguleringen af kroppens stressresponsmekanisme. Dette komplekse netværk af interaktioner mellem hypothalamus, hypofysen og binyrerne orkestrerer produktionen og reguleringen af vigtige stresshormoner som f.eks. kortisol.
Kortisol har vidtrækkende virkninger på mange kropsfunktioner og frigives som reaktion på stress og lav blodglukosekoncentration. Under normale omstændigheder hjælper kortisol med at genoprette homeostasen efter stressende begivenheder. Men genvariationer, der påvirker HPA-aksen, kan føre til forskelle i, hvordan kortisol produceres, reguleres og fjernes fra kroppen. Disse genetiske variationer kan påvirke en persons fysiologiske modstandskraft - deres evne til at opretholde eller hurtigt vende tilbage til psykisk og fysisk sundhed efter modgang.(3)
DNA-test for modstandskraft undersøger genvarianter, der er forbundet med receptorer for stresshormoner, proteiner, der er involveret i stresshormonernes veje, og enzymer, der omdanner disse hormoner. For eksempel kan en variant af FKBP5-genet, som er involveret i reguleringen af følsomheden af glukokortikoidreceptoren, hvorigennem kortisol udøver sin virkning, ændre en persons stressrespons og potentielt deres modtagelighed for stressrelaterede lidelser. Generne, der koder for neurotransmittere - hjernens kemiske budbringere, der bidrager til regulering af humør og kognition - er også i søgelyset. Det drejer sig om gener som COMT, der er afgørende for nedbrydningen af dopamin, en neurotransmitter, der er forbundet med nydelses- og belønningssystemer.(4)
Derudover, Betændelse er en biologisk proces, der er tæt forbundet med stress og humørsvingninger. Kronisk inflammation, som kan påvirkes af genetiske variationer, kan påvirke hjernens funktion og adfærd.(5) Derfor kan genetiske tests også forsøge at identificere varianter i pro-inflammatoriske cytokingener, såsom IL-6 og TNF, som kan disponere individer for langvarige inflammatoriske reaktioner og påvirke deres mentale modstandskraft.
Forståelse af disse genetiske markører er hjørnestenen i personaliserede interventioner. Ved at identificere genetiske dispositioner kan enkeltpersoner tage proaktive skridt til at styrke deres modstandskraft gennem livsstilsændringer, psykologiske strategier og medicinske behandlinger, der er skræddersyet til deres unikke genetiske sammensætning. Denne tilgang eksemplificerer skiftet mod præcisionsmedicin, hvor modellen med en størrelse, der passer til alle, giver plads til mere individualiseret pleje.
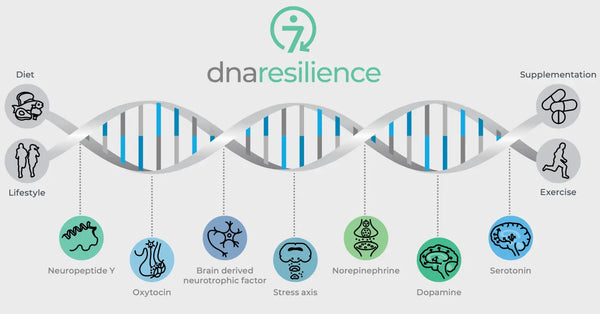
Billede: De syv molekylære veje til modstandsdygtighed.
Typer af DNA-tests for modstandskraft
1) Gener for stressrespons
Stressresponsgener er kritiske komponenter i vores krops system til at håndtere og reagere på stressfaktorer. De koder for proteiner, der regulerer forskellige fysiologiske processer, herunder frigivelsen og virkningen af kortisol, et hormon, der er centralt i stressresponsen.
CRHR1 (Corticotropin-Releasing Hormone Receptor 1)
CRHR1 koder for en receptor for kortikotropinfrigørende hormon (CRH), et centralt hormon, der igangsætter stressresponsen. Når CRH binder sig til CRHR1, stimulerer det produktionen og frigivelsen af adrenokortikotropt hormon (ACTH), som får binyrerne til at producere kortisol. Varianter i CRHR1-genet kan påvirke, hvor følsom denne receptor er over for CRH, hvilket kan ændre den samlede stressrespons. Nogle polymorfismer kan f.eks. føre til en øget stressreaktion, som kan bidrage til angst eller depression. I modsætning hertil kan andre dæmpe responsen og påvirke evnen til at håndtere akut stress.(6-7)
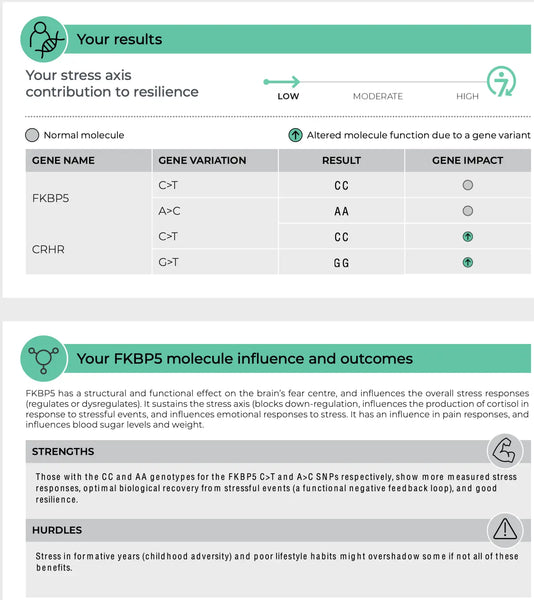
FKBP5 (FK506-bindende protein 5)
FKBP5-genet spiller en rolle i reguleringen af følsomheden af glukokortikoidreceptoren, som er den receptor, hvorigennem kortisol udøver sin virkning. Specifikke polymorfismer i FKBP5 er blevet sat i forbindelse med ændret feedback-hæmning af HPA-aksen og forskellige reaktioner på glukokortikoider. For eksempel kan nogle varianter af FKBP5 reducere glukokortikoidreceptorens affinitet for kortisol, hvilket potentielt kan føre til en forringet stressrespons og en øget risiko for stressrelaterede psykiatriske lidelser som PTSD eller svær depression.(8-9)
Billede: Et eksempel på en side i DNA-resiliens-test.
NR3C1 (Nuklear Receptor Underfamilie 3, Gruppe C, Medlem 1)
NR3C1 koder for selve glukokortikoidreceptoren. Variationer i dette gen kan påvirke, hvordan kroppen reagerer på kortisol. Specifikke polymorfismer i NR3C1 kan påvirke følsomheden eller tætheden af glukokortikoidreceptorer og dermed påvirke, hvor effektivt kortisol kan udføre sine funktioner. Det kan føre til en række forskellige reaktioner, fra et dæmpet stressrespons, der kan forhindre en person i at reagere hensigtsmæssigt på stressfaktorer, til et overdrevet respons, der kan resultere i kroniske stresssymptomer og endda depression.(10-12)
Resultaterne af en gentest for stressrespons kan give indsigt i en persons disposition for stressrelaterede sundhedsproblemer. For eksempel:
-
Øget stressrespons: Personer med specifikke varianter kan være mere reaktive over for stress og opleve højere kortisolniveauer under stressende begivenheder.
-
Nedsat stressreaktion: Omvendt kan nogle personer have en afstumpet stressrespons, som kan være beskyttende i akutte stresssituationer, men som også kan hindre aktiveringen af nødvendige fysiologiske mekanismer som reaktion på udfordringer.
2) Test af neurotransmitterfunktion forklaret
Neurotransmitterfunktionstests er designet til at undersøge de genetiske faktorer, der påvirker, hvordan neurotransmittere syntetiseres, frigives og nedbrydes i hjernen. Da neurotransmittere er kemiske budbringere, der regulerer humør, kognition og stressreaktioner, kan variationer i gener relateret til disse stoffer have betydelige konsekvenser for en persons psykologiske modstandskraft og generelle mentale sundhed.
Udforskningen af neurotransmitternes funktion i forbindelse med modstandsdygtighed og stressrespons strækker sig ud over katekolaminerne som dopamin. Det omfatter et bredere spektrum af neurotransmittersystemer, der er involveret i humørregulering, årvågenhed og kognitiv funktion. Flere gener er involveret i syntese, signalering og nedbrydning af disse neurotransmittere, herunder dopamin-beta-hydroxylase (DBH), dopaminreceptorer (DRD2, DRD4) og forskellige serotonin-relaterede gener.(13)
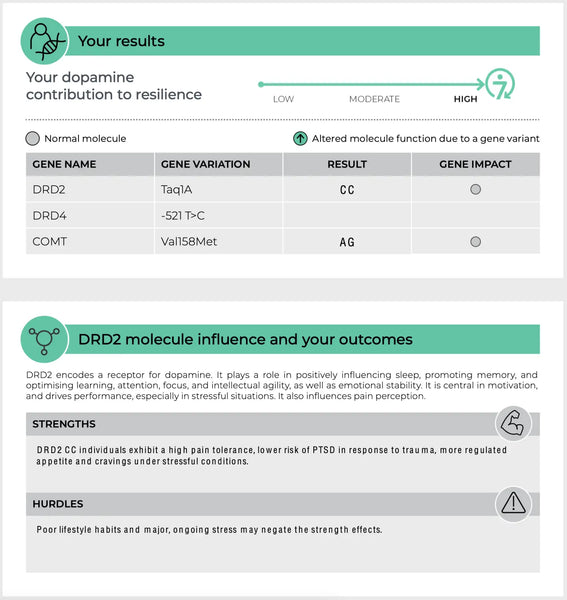
COMT (catechol-o-methyltransferase)
COMT-genet er et af de mest undersøgte, når det gælder neurotransmitternes funktion. Det koder for et enzym, der nedbryder catecholaminer - såsom dopamin, adrenalin og noradrenalin - neurotransmittere, der er afgørende for stressrespons, kognition og følelsesregulering.
Der findes velkendte polymorfismer i COMT-genet, f.eks. varianten Val158Met. Denne variant kan påvirke enzymets aktivitetsniveau på forskellige måder:(14-15)
- Højaktivitetsform (Val-variant): Denne form af enzymet nedbryder dopamin hurtigere, hvilket kan føre til lavere niveauer af dopamin i den præfrontale cortex, et hjerneområde, der er involveret i udøvende funktioner og beslutningstagning. Personer med denne variant kan præstere bedre i opgaver under stabile forhold, men kan være mere modtagelige for kognitiv tilbagegang under stress på grund af lavere dopamintilgængelighed.
- Lavaktivitetsform (Met-variant): Omvendt metaboliserer denne form af COMT-enzymet dopamin langsommere, hvilket resulterer i højere dopaminniveauer i hjernen. Dette kan forbedre den kognitive funktion under stress, men kan også øge risikoen for stressrelaterede psykopatologier, som f.eks. angstlidelser, da hjernen potentielt overstimuleres af overskydende dopamin.
Dopamin beta-hydroxylase (DBH)
DBH er et enzym, der omdanner dopamin til noradrenalin, en neurotransmitter, der er involveret i kamp- eller flugtreaktionen. Genetiske variationer i DBH-genet kan påvirke enzymaktiviteten og dermed dopamin- og noradrenalin-niveauerne i hjernen og det perifere nervesystem.(16-18)
- Lav aktivitet: Varianter, der er forbundet med lavere DBH-aktivitet, kan føre til højere niveauer af dopamin og lavere niveauer af noradrenalin, hvilket kan påvirke kognitive funktioner som opmærksomhed og beslutningstagning og have indflydelse på, hvordan en person reagerer på stress.
- Høj aktivitet: Omvendt kan varianter, der resulterer i højere DBH-aktivitet, sænke dopaminniveauet og samtidig øge noradrenalin, hvilket potentielt kan påvirke stressreaktivitet og angst.
Dopaminreceptorer (DRD2 og DRD4)
DRD2 og DRD4 er gener, der koder for henholdsvis dopaminreceptorerne D2 og D4. Disse receptorer er en del af dopaminsystemet, der regulerer adskillige funktioner, herunder humør, belønning og motorisk kontrol.19-20)
- DRD2: Varianter i DRD2-genet kan påvirke D2-receptorernes tæthed og bindingsaffinitet. Det kan påvirke sårbarheden over for stress og effektiviteten af belønningsrelaterede signaler, hvilket kan have betydning for tilstande som afhængighed og depression.
- DRD4: DRD4-genet er kendt for et variabelt antal tandemrepetitioner (VNTR) i den kodende region. Specifikke gentagelser er forbundet med træk som nyhedssøgning og risikoen for opmærksomhedsforstyrrelser. Denne polymorfisme kan påvirke effektiviteten af synaptisk dopaminsignalering og er blevet undersøgt i forbindelse med adfærdsmæssig og psykologisk modstandsdygtighed.
Billede: Et eksempel på en side i DNA-resiliens-test.
Variationer i serotonin-genet
Serotonin er en anden afgørende neurotransmitter i reguleringen af humør, appetit og søvn, som alle kan påvirkes af stress. Flere gener, der er involveret i serotoninsignalering, er af interesse:
- 5-HTT (SLC6A4): Dette gen koder for serotonintransportøren, der er ansvarlig for genoptagelse af serotonin fra den synaptiske kløft. 5-HTTLPR-polymorfismen i promotorregionen af dette gen er blevet undersøgt for sin sammenhæng med stressfølsomhed og humørsvingninger.(21)
- MAOA: Monoaminoxidase A-genet er ansvarligt for at nedbryde serotonin. Variationer i dette gen kan påvirke serotoninniveauet og er blevet sat i forbindelse med adfærdstræk og følsomhed over for stress.(22)
- TPH2: Tryptophan hydroxylase-2 er et enzym, der er afgørende for at syntetisere serotonin i hjernen. Genetiske variationer i TPH2 kan påvirke serotoninproduktionen og potentielt påvirke følelsesmæssig regulering og reaktion på stress.(23)
Fortolkningen af resultaterne fra disse tests kan være kompleks. For eksempel betyder en variant, der er forbundet med en højere risiko for stressrelaterede tilstande, ikke nødvendigvis, at en person vil udvikle sådanne tilstande, men det kan tyde på en øget sårbarhed. På samme måde garanterer det at have en "resiliens"-variant ikke en uangribelig modstandsdygtighed over for stress, da miljøfaktorer og livsstilsvalg spiller en væsentlig rolle.
3) Inflammation og dens indvirkning på hjernen
Kronisk inflammation kan være skadelig for hjernens sundhed. Det menes at bidrage til udvikling og progression af neurodegenerative sygdomme og kan påvirke hjernens stressrespons, som er tæt forbundet med modstandsdygtighed. Proinflammatoriske cytokiner som interleukin-6 (IL-6) og tumornekrosefaktor (TNF) kan krydse blod-hjerne-barrieren og interagere med de veje, der regulerer humør, motivation og årvågenhed.(24)
Genvarianter forbundet med inflammation
IL-6 (interleukin-6)
IL-6 er et cytokin, der spiller en rolle i det inflammatoriske respons og er involveret i forskellige biologiske funktioner, herunder immunrespons, hæmatopoiesis og knoglemetabolisme. I forbindelse med stress og resiliens er IL-6 relateret til følgende:(25-26)
- Forhøjede IL-6-niveauer er blevet forbundet med en større risiko for at udvikle depression og andre humørforstyrrelser.
- Specifikke genetiske varianter af IL-6-genet kan føre til øget udtryk af IL-6, hvilket potentielt forværrer den inflammatoriske reaktion og ændrer hjernens evne til at håndtere stress.
TNF (tumornekrosefaktor)
TNF er et andet cytokin, der er involveret i systemisk inflammation. Det har forskellige roller, herunder regulering af immunceller og induktion af feber, apoptose og inflammation.(27)
- Overekspression af TNF er blevet sat i forbindelse med forskellige kroniske sygdomme, herunder reumatoid arthritis, inflammatorisk tarmsygdom og psoriasis, samt psykologisk stress og depression.
- Varianter i TNF-genet kan påvirke niveauet af TNF-produktion, hvilket kan have direkte konsekvenser for inflammatoriske processer i hele kroppen og i hjernen.
4) Neurobiologiske regulatorer og resiliensfaktorer
Genetiske variationer i vigtige neurobiologiske regulatorer styrer også modstandsdygtigheden over for stress. Disse omfatter oxytocin, hjerneafledt neurotrofisk faktor (BDNF) og neuropeptid Y (NPY). Oxytocin spiller en rolle i reguleringen af social adfærd og stressreaktioner. BDNF er afgørende for at opretholde neuroplasticitet og kognitiv funktion under stress, og NPY modulerer angst og den fysiologiske stressrespons. Disse molekyler påvirker tilsammen vores neurale kredsløb og psykologiske modstandskraft, hvilket giver indsigt i individuelle forskelle i stressmodstandskraft og potentielle veje til personlige biohacking-strategier.
Oxytocin
Oxytocin kaldes ofte "kærlighedshormonet" på grund af dets rolle i sociale bånd, moderlig adfærd og intimitet. Det har også en angstdæmpende effekt og påvirker social kognition og adfærd.
- Genetisk indflydelse: Variationer i oxytocinreceptorgenet (OXTR) er blevet sat i forbindelse med følelsesmæssig regulering, social adfærd og stressresponsivitet. Specifikke polymorfismer i OXTR kan påvirke oxytocinreceptorernes bindingseffektivitet og ekspressionsniveauer, hvilket kan påvirke en persons evne til at håndtere stress og danne sociale relationer.(28)
- Konsekvenser: I forbindelse med resiliens-testning kan vurdering af OXTR-varianter give indsigt i et individs disposition for social angst, empatiniveauer og potentiel resiliens i forhold til stress, især det, der involverer social dynamik.(29)
Hjerneafledt neurotrofisk faktor (BDNF)
BDNF er et afgørende protein, der er involveret i neuroplasticitet, hjernens evne til at reorganisere og danne nye neurale forbindelser gennem hele livet. Det er afgørende for indlæring, hukommelse og regenerering af neuroner.(30)
- Genetiske variationer: BDNF-genvarianten Val66Met er en af de mest undersøgte polymorfismer. Met-allelen er blevet forbundet med reduceret aktivitetsafhængig udskillelse af BDNF, hvilket kan påvirke den kognitive funktion og modstandsdygtigheden over for neurologiske og psykiatriske lidelser.(31)
- Implikationer: Test for BDNF-genvarianter kan hjælpe med at forudsige en persons evne til neuroplasticitet som reaktion på stress og kan have betydning for genopretning efter neurologiske skader eller traumer.(32)
Billede: Et eksempel på en side i DNA Resilience test-analyse.
Neuropeptid Y (NPY)
NPY er et af de mest udbredte peptider i hjernen og er involveret i regulering af stressreaktioner, angst og fødeindtagelse. Det betragtes som et endogent anxiolytisk middel.
- Genetiske associationer: Polymorfismer i NPY-genet kan føre til forskelle i NPY-ekspression og -udskillelse, hvilket potentielt kan påvirke en persons stressmodstandsdygtighed. Højere niveauer af NPY er generelt beskyttende mod virkningerne af stress.
- Konsekvenser Genetisk testning for NPY-varianter kan potentielt indikere en persons basale stressresiliens og kan forudsige deres psykologiske reaktion på kronisk stress og traumer.(33)
Epigenetikkens rolle i moduleringen af stressmodstandsdygtighed
Forskningen inden for epigenetik dykker ned i et lag af kompleksitet ud over den statiske DNA-sekvens. Epigenetiske modifikationer består af kemiske ændringer i DNA-strukturen, såsom methylering og histonmodifikationer, som kan påvirke, hvordan gener udtrykkes, uden at ændre den underliggende genetiske kode. Disse ændringer er dynamiske og reagerer på miljømæssige stimuli, herunder kronisk stress. Udsættelse for langvarig stress kan føre til epigenetiske ændringer, der påvirker funktionen af gener, der er involveret i stressresponsen, hvilket potentielt gør det sværere for enkeltpersoner at håndtere nye stressfaktorer effektivt.(34-35)
Virksomheder, der er på forkant med personlig medicin, kaster sig nu over epigenetik og forsøger at afdække, hvordan disse ændringer kan bidrage til en persons evne til at modstå og komme sig over stress. Ved at analysere epigenetiske markører kan forskere få indsigt i den aktuelle tilstand af genekspressionsprofiler, som er resultatet af både genetisk disposition og miljøpåvirkninger. Sådanne tests kan identificere epigenetiske ændringer som reaktion på kronisk stress og give et øjebliksbillede af de molekylære mekanismer, der bidrager til en persons stressrespons eller mangel på samme.
Desuden åbner forståelsen af disse epigenetiske ændringer døren til personaliserede interventioner. Specifikke livsstilsændringer, kostjusteringer og terapeutiske strategier kan anbefales for at vende negative epigenetiske ændringer. Denne personlige tilgang forbedrer ikke kun den enkeltes modstandskraft, men bidrager også til en bredere forståelse af, hvordan stress påvirker vores biologiske systemer på et epigenetisk niveau, hvilket kan føre til nye behandlinger og forebyggende strategier for stressrelaterede lidelser. Ved at kortlægge det epigenetiske landskab af stressrespons kan vi begynde at tegne et mere omfattende billede af de faktorer, der bidrager til vores unikke evne til at klare livets udfordringer.
Fordele og begrænsninger ved resiliens-DNA-tests
Disse tests kan give enkeltpersoner en bedre forståelse af deres medfødte modstandskraft og stressrespons. En sådan viden kan danne grundlag for personlige strategier til at håndtere stress og forbedre den mentale sundhed. Det er dog vigtigt at nærme sig disse tests med forsigtighed:
- Komplekse træk: Resiliens bestemmes ikke af et enkelt gen, men er en kompleks egenskab, der påvirkes af mange gener og miljøfaktorer.
- Indflydelse fra miljøet: Genetik fungerer ikke isoleret. Livserfaringer, støttesystemer og livsstilsvalg har stor betydning for modstandsdygtigheden.
- Forudsigende kraft: Selv om disse tests kan give indsigt, er de ikke endegyldige forudsigere af en persons evne til at klare livets udfordringer.
Konklusion
DNA-tests relateret til resiliens repræsenterer en spændende grænse i forståelsen af, hvordan vores genetiske sammensætning kan påvirke evnen til at håndtere stress og komme sig over modgang. Selv om de kan give værdifuld indsigt, skal de ses som en brik i det store puslespil, der udgør en persons modstandskraft. For alle, der er interesserede i disse tests, anbefales det at konsultere en sundhedsudbyder eller en genetisk rådgiver for at fortolke resultaterne i en bredere sammenhæng med deres helbred og livsstil.
- Få din integrale DNA-test her!
- Book en konsultation for at fortolke dine laboratorie- og gentest med Dr. Sovijärvi her.
Videnskabelige referencer:
- Bobrow, M., & Grimbaldeston, A. H. (2000). Medicinsk genetik, det humane genomprojekt og folkesundhed: Præsenteret på University of Liverpool den 9. december 1996 og accepteret til offentliggørelse den 17. februar 2000. Journal of Epidemiology & Community Health, 54(9), 645-649.
- Cicchetti, D. (2010). Modstandsdygtighed under ekstrem stress: et perspektiv på flere niveauer. World psychiatry, 9(3), 145.
- Luecken, L. J., & Gallo, L. C. (Eds.). (2008). Håndbog i fysiologiske forskningsmetoder inden for sundhedspsykologi. Sage.
- Southwick, S. M., Vythilingam, M., & Charney, D. S. (2005). Depressionens psykobiologi og modstandsdygtighed over for stress: konsekvenser for forebyggelse og behandling. Annu. Rev. Clin. Psychol. 1, 255-291.
- Michaud, M., Balardy, L., Moulis, G., Gaudin, C., Peyrot, C., Vellas, B., ... & Nourhashemi, F. (2013). Proinflammatoriske cytokiner, aldring og aldersrelaterede sygdomme. Journal of the American Medical Directors Association, 14(12), 877-882.
- Aguilera, G., Nikodemova, M., Wynn, P. C., & Catt, K. J. (2004). Corticotropin releasing hormone receptors: two decades later. Peptides, 25(3), 319-329.
- Subbannayya, T., Balakrishnan, L., Sudarshan, G., Advani, J., Kumar, S., Mahmood, R., ... & Prasad, T. K. (2013). Et integreret kort over signalvejen for kortikotropinfrigørende hormon. Journal of cell communication and signaling, 7, 295-300.
- Binder, E. B. (2009). FKBP5's rolle, en co-chaperon af glukokortikoidreceptoren i patogenesen og behandlingen af affektive lidelser og angstlidelser. Psykoneuroendokrinologi, 34, S186-S195.
- Ising, M., Depping, A. M., Siebertz, A., Lucae, S., Unschuld, P. G., Kloiber, S., ... & Holsboer, F. (2008). Polymorfismer i FKBP5-genregionen modulerer genopretning fra psykosocial stress hos raske kontroller. European Journal of Neuroscience, 28(2), 389-398.
- Vitellius, G., Trabado, S., Bouligand, J., Delemer, B. & Lombès, M. (2018, juni). Patofysiologi af glukokortikoid-signalering. I Annales d'endocrinologie (vol. 79, nr. 3, s. 98-106). Elsevier Masson.
- Van West, D., Van Den Eede, F., Del-Favero, J., Souery, D., Norrback, K. F., Van Duijn, C., ... & Claes, S. (2006). Glukokortikoidreceptor-genbaseret SNP-analyse hos patienter med tilbagevendende større depression. Neuropsychopharmacology, 31(3), 620-627.
- Schneider, K. K., Frings, C., Meyer, J., & Schote, A. B. (2016). Glukokortikoidreceptorgenets (NR3C1) rolle i behandlingen af aversive stimuli. Neuroscience Research, 107, 8-13.
- Azadmarzabadi, E., Haghighatfard, A., & Mohammadi, A. (2018). Lav modstandsdygtighed over for stress er forbundet med ændringer i kandidatgenekspression i den dopaminerge signalvej. Psychogeriatrics, 18(3), 190-201.
- Heinz, A., & Smolka, M. N. (2006). Virkningerne af catechol O-methyltransferase-genotype på hjerneaktivering fremkaldt af affektive stimuli og kognitive opgaver. Reviews in the Neurosciences, 17(3), 359-368.
- Mier, D., Kirsch, P., & Meyer-Lindenberg, A. (2010). Neurale substrater af pleiotropisk virkning af genetisk variation i COMT: en metaanalyse. Molecular psychiatry, 15(9), 918-927.
- Mustapic, M., Maihofer, A. X., Mahata, M., Chen, Y., Baker, D. G., O'Connor, D. T., & Nievergelt, C. M. (2014). Det katekolaminbiosyntetiske enzym dopamin β-hydroxylase (DBH): første genomdækkende søgepositioner egenskabsbestemmende varianter, der virker additivt i den proksimale promotor. Human molecular genetics, 23(23), 6375-6384.
- Vincent, S., & Robertson, D. (2002). Det bredere syn: catecholamin abnormaliteter. Clinical Autonomic Research, 12, I44-I49.
- Hoenicka, J., Aragüés, M., Ponce, G., Rodríguez-Jiménez, R., Jiménez-Arriero, M. A., & Palomo, T. (2007). Fra dopaminerge gener til psykiatriske lidelser. Forskning i neurotoksicitet, 11, 61-71.
- Hill, S. Y., Hoffman, E. K., Zezza, N., Thalamuthu, A., Weeks, D. E., Matthews, A. G., & Mukhopadhyay, I. (2008). Dopaminerge mutationer: Inden for familieforening og sammenkædning i multiplex alkoholafhængighedsfamilier. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 147(4), 517-526.
- He, Y., Martin, N., Zhu, G., & Liu, Y. (2018). Kandidatgener for nyhedssøgning: en metaanalyse af associationsstudier af: DRD4: exon III og: COMT: Val158Met. Psykiatrisk genetik, 28(6), 97-109.
- Avula, R., Rand, A., Black, J. L., & O'kane, D. J. (2011). Simultan genotypning af flere polymorfismer i det humane serotonintransportørgen og påvisning af nye allelvarianter. Translational psychiatry, 1(8), e32-e32.
- Tivol, E. A., Shalish, C., Schuback, D. E., Hsu, Y. P., & Breakefield, X. O. (1996). Mutationsanalyse af det humane MAOA-gen. American journal of medical genetics, 67(1), 92-97.
- Waider, J., Araragi, N., Gutknecht, L., & Lesch, K. P. (2011). Tryptophan hydroxylase-2 (TPH2) i forstyrrelser af kognitiv kontrol og følelsesregulering: et perspektiv. Psychoneuroendocrinology, 36(3), 393-405.
- Bauer, M. E., & Teixeira, A. L. (2021). Neuroinflammation ved humørsygdomme: rolle for regulatoriske immunceller. Neuroimmunomodulation, 28(3), 99-107.
- Anderson, G., Kubera, M., Duda, W., Lasoń, W., Berk, M. & Maes, M. (2013). Øget IL-6 trans-signalering i depression: fokus på tryptofankatabolitvejen, melatonin og neuroprogression. Farmakologiske rapporter, 65(6), 1647-1654.
- Perry, B. I., Upthegrove, R., Kappelmann, N., Jones, P. B., Burgess, S., & Khandaker, G. M. (2021). Sammenhænge mellem immunologiske proteiner/egenskaber og skizofreni, svær depression og bipolar lidelse: et tovejs mendelsk randomiseringsstudie med to stikprøver. Hjerne, adfærd og immunitet, 97, 176-185.
- Bradley, J. (2008). TNF-medieret inflammatorisk sygdom. Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 214(2), 149-160.
- Loth, E., Poline, J. B., Thyreau, B., Jia, T., Tao, C., Lourdusamy, A., ... & IMAGEN Consortium. (2014). Oxytocinreceptorgenotype modulerer ventral striatal aktivitet til sociale signaler og respons på stressende livsbegivenheder. Biologisk psykiatri, 76(5), 367-376.
- Myers, A. J., Williams, L., Gatt, J. M., McAuley-Clark, E. Z., Dobson-Stone, C., Schofield, P. R., & Nemeroff, C. B. (2014). Variation i oxytocinreceptorgenet er forbundet med øget risiko for angst, stress og depression hos personer, der har været udsat for stress tidligt i livet. Tidsskrift for psykiatrisk forskning, 59, 93-100.
- Cowansage, K. K., LeDoux, J. E., & Monfils, M. H. (2010). Hjerneafledt neurotrofisk faktor: en dynamisk gatekeeper af neural plasticitet. Current molecular pharmacology, 3(1), 12-29.
- Chen, Z. Y., Jing, D., Bath, K. G., Ieraci, A., Khan, T., Siao, C. J., ... & Lee, F. S. (2006). Genetisk variant BDNF (Val66Met) polymorfisme ændrer angstrelateret adfærd. science, 314(5796), 140-143.
- Phillips, C. (2017). Hjerneafledt neurotrofisk faktor, depression og fysisk aktivitet: at skabe den neuroplastiske forbindelse. Neural plasticitet, 2017.
- Schmeltzer, S. N., Herman, J. P., & Sah, R. (2016). Neuropeptid Y (NPY) og posttraumatisk stresslidelse (PTSD): en translationel opdatering. Eksperimentel neurologi, 284, 196-210.
- Lux, V. (2016, marts). Epigenetisk programmering i psykobiologisk udvikling: Bevis for teorien om dobbeltaktivering og en formidlende rolle for stress i det tidlige liv. I Qatar Foundation Annual Research Conference Proceedings Volume 2016 Issue 1 (Vol. 2016, No. 1, s. HBOP3415). Hamad bin Khalifa University Press (HBKU Press).
- Chukwuma Sr, C. (2022). Epigenetik og dens betydning for forståelsen af menneskelig vækst, udvikling og sygdom. J Med Res, 8(5), 165-172.