NAD+ er et coenzym, der findes i alle levende celler, og som er nødvendigt for kroppens grundlæggende funktioner. NAD+-niveauerne falder, når vi bliver ældre, hvilket menes at være en medvirkende årsag til aldringsprocessen.
Nicotinamid-adenin-dinukleotid (NAD+/NADH)
NAD blev først opdaget under gærfermentering. Siden opdagelsen har man fundet ud af, at NAD (nikotinamid-adenin-dinukleotid) er en vigtig kofaktor, der indgår i stort set alle cellulære reaktioner. Disse omfatter DNA-reparation, immunsystemets funktion, ATP-produktion og døgnrytmefunktion. NAD+ fremmer energiproduktionen og gør det muligt for cellerne at fungere korrekt. Dysregulering af NAD+-niveauerne er blevet sat i forbindelse med stofskiftesygdomme og aldringsrelaterede sygdomme, herunder neurodegeneration, defekte immunresponser og kræft..
NAD har to former - NAD+ og NADH, som begge styrer elektronoverførselsreaktioner.:
- NAD+ er et oxidationsmiddel, der opsamler elektroner fra andre molekyler og dermed bliver reduceret
- NADH er et reduktionsmiddel, der dannes ud fra reduceret NAD+ og derefter bruges til at donere elektroner til andre molekyler, så det bliver til NAD+ igen
- NADH's elektroner kan lagre energi, som omdannes til ATP i mitokondrierne under en proces, der kaldes oxidativ fosforylering i mitokondrierne (se Biohacker-håndbogens kapitel om motion for mere information)
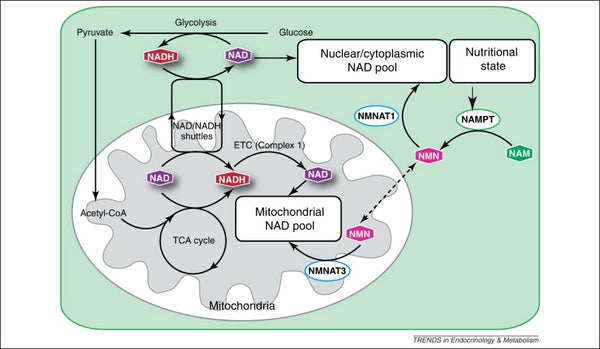
Billede: Vedligeholdelse af den mitokondrielle NAD-pulje.
Kilde: Stein, L. & Imai, S. (2012). Den dynamiske regulering af NAD-metabolismen i mitokondrier. Trends i endokrinologi og metabolisme 23 (9): 420–428.
Introduktion til NAD+
Ideelt set er NAD+ i en homeostatisk status med biosyntese, forbrug, genbrug og nedbrydning på både cellulært og systemisk niveau. Menneskelige celler kan syntetisere NAD+ de novo fra tryptofan via kynurenin-vejen eller fra nikotinsyre (NA) via Preiss-Handler-vejen. Men det er ikke tilfældet, Det meste NAD+ genbruges dog fra nikotinamid (NAM), NA, nikotinamidribosid (NR) og nikotinamidmononukleotid (NMN) i genoprettelsesvejen for at opretholde de cellulære NAD+-niveauer. NAD+ kan reduceres til NADH i forskellige metaboliske processer, herunder glykolyse, fedtsyreoxidation og Krebs' cyklus.
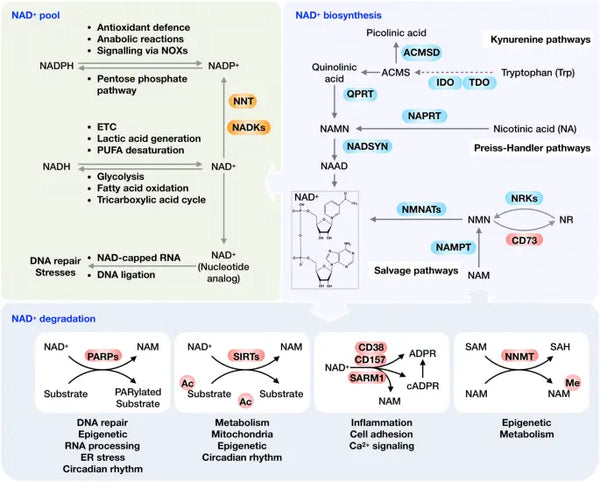
Billede: Oversigt over NAD+-metabolismen og dens fysiologiske funktion.
Kilde: Xie, N. et al. (2020). NAD+-metabolisme: patofysiologiske mekanismer og terapeutisk potentiale. Signaltransduktion og målrettet terapi 5 (1): 1–37.
Som et co-substrat, der er vigtigt for forskellige fundamentale makromolekyler, kan NAD+ spaltes af NAD+-forbrugende enzymer. Disse omfatter PARP'er, sirtuiner, CD38 og SARM1 for at generere NAM og ADP-ribose (se billedet). Under normale homøostatiske forhold udtrykkes CD38 i lave niveauer, mens stigende udtryk af CD38 med aldring spiller en afgørende rolle i aldersassocieret NAD+-reduktion. Denne opfattelse bekræftes af observationen af, at PARP1- og CD38-hæmning effektivt øger den samlede NAD+-tilgængelighed, hvilket fører til SIRT1-aktivering.
Et fald i NAD+-niveauer, baseret på nyere forskning, er forbundet med aldring. Det er almindeligt, at NAD+-niveauerne falder til mindre end halvdelen efter 60-årsalderen sammenlignet med niveauerne i 20'erne.. Det store spørgsmål er, hvorfor NAD+-niveauerne overhovedet falder. Der har været et par teorier om dette, men den seneste og mest understøttede teori er, at NAD+-niveauet falder med alderen, fordi det ødelægges af overaktiviteten af et NAD-forbrugende enzym, CD38.. Lav NAD+-status er også kendt for at hæmmer kroppens immunsystem og naturlige forsvarsmekanismer.
CD38, også kendt som cyklisk ADP-ribosehydrolase, er et glykoprotein, der findes på overfladen af mange immunceller (især hvide blodlegemer), herunder B-lymfocytter, naturlige dræberceller, CD4⁺ og CD8. Normalt resulterer mere inflammation i højere CD38-ekspression, som så nedbryder NAD+. Det er derfor, er kontrol af lavgradig inflammation og inflammation generelt den bedste måde at minimere tabet af NAD+ på grund af aldring..
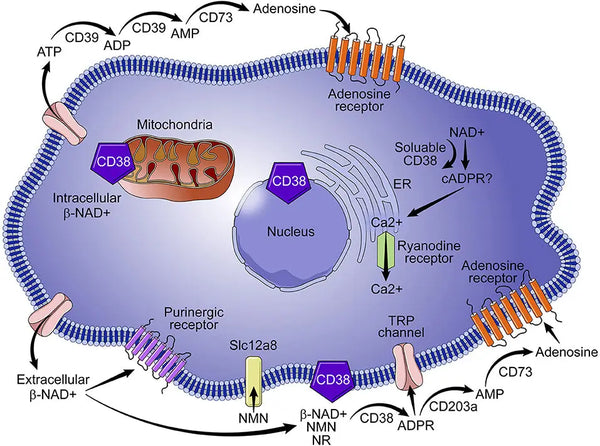
Billede: CD38's rolle i NAD+-metabolismen.
Kilde: Hogan, K. & Chini, C. & Chini, E. (2019). Det multifacetterede ecto-enzym CD38: roller i immunmodulation, kræft, aldring og metaboliske sygdomme. Grænser i immunologi 10: 1187.
NAD+ lindrer oxidativ skade forårsaget af virus- og bakterieinfektioner
Virusinfektioner og infektioner generelt forårsager oxidativ stress i værtscellerne (f.eks. menneskelige celler). Derfor betragtes oxidativ stress som en patogen faktor ved virusinfektioner. De øgede cellulære reaktive oxygenarter ved virusinfektioner forårsager f.eks. DNA-skader, genmutation, celledød, viral DNA-integration og tumorigenese. For at reparere den oxidative stress-inducerede DNA-skade er der brug for en stor mængde NAD+, som forbruges af forhøjede PARP'er som reaktion på virusinfektion.
Sirtuiner er en anden klasse af NAD+-forbrugende enzymer, som har bredspektrede antivirale egenskaber på forskellige vira (herunder HIV-1, HCMB, H1N1 og HCV). CD38 er det tredje NAD+-forbrugende enzym, som overudtrykkes som reaktion på flere virusinfektioner. CD38-mangel resulterer i en øget prædisposition for flere patogener.
Bakterielle infektioner inducerer også hurtig produktion af intracellulære reaktive oxygenarter (ROS). enten af NADPH-oxidaser (NOX'er) eller mitokondrier, som er afgørende for, at makrofager kan fjerne bakterier. NAD+/NADH udøver den bakteriedræbende aktivitet ved at fremme ROS-produktionen, den pro-inflammatoriske respons og den anti-infektiøse autofagi. Denne gavnlige og naturlige metaboliske proces har brug for en velfungerende NAD+-metabolisme og optimale niveauer af NAD+ for at fungere korrekt. Eliminering af ROS resulterer i defekt bakteriedræbende aktivitet, hvilket gør det muligt for bakterier at overleve og gentagne gange kolonisere forskellige vævssteder..
Dette er grunden til, at det ikke er gavnligt for immunsystemet at bruge for mange antioxidanter hele tiden. Nøglen til optimal homeostase er at have en balance mellem oxidativ stress og antioxidantkapacitet.
Nye beviser understøtter hypotesen om, at CD38 og produkter, der kontrolleres af CD38/NAD+-aksen, kan spille en væsentlig rolle i patogenesen af SARS-CoV-2-infektion.. Overekspression af CD38 i COVID-19 forårsager celledød hovedsageligt ved udtømning af NAD+.. Oral administration af NAD+-forløbere (NR, NAM og NMN) synes at være den mest effektive tilgang til at genopbygge NAD+-niveauer (se senere). Af disse NAD+-forstadier har NR (suppleret med 1 gram pr. dag) antiinflammatoriske virkninger under forskellige sygdomstilstande. Nuværende videnskabelige beviser synes at bekræfte, at vigtige begivenheder i biosyntesen og forbruget af NAD+ spiller en væsentlig rolle i det antivirale immunrespons. Forøgelse af NAD+-niveauer ved at modulere de biosyntetiske veje eller ved at reducere forbruget af NAD+ kan hjælpe kontrollere den hyperimmune reaktion på SARS-CoV-2-infektion.
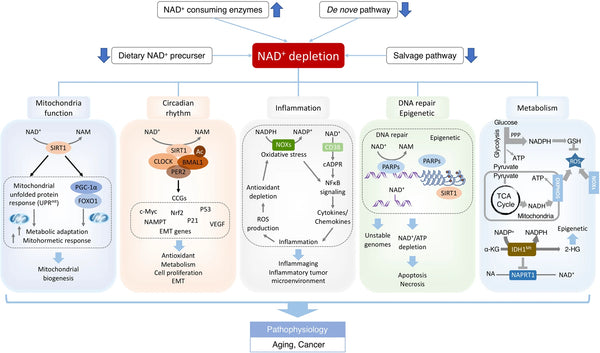
Billede: NAD+-underskud ved aldringsassocieret dysfunktion og kræft.
Kilde: Xie, N. et al. (2020). NAD+-metabolisme: patofysiologiske mekanismer og terapeutisk potentiale. Signaltransduktion og målrettet terapi 5 (1): 1–37.
Livsstilsfaktorer, der sænker NAD+-niveauet:
- Uoverensstemmelser i døgnrytmen
- Kronisk inflammation og oxidativ stress
- Konstant kalorieoverskud (spiser for meget hele tiden) - højere NADH, lavere NAD+.
- Forhøjede blodsukker- og insulinniveauer
- Kronisk brug af alkohol
Mulige konsekvenser af NAD+-mangel:
- Nedsat funktion af immunsystemet
- Accelereret aldring
- Mitokondriel dysfunktion
- Forstyrret døgnrytme (med aldring)
- Øget karcinogenese og risiko for kræft
- Øget risiko for insulinresistens og udvikling af diabetes
- Øget risiko for fedme
- Øget risiko for ikke-alkoholisk fedtleversygdom
- Øget risiko for neurodegenerative lidelser
- Øget risiko for hjerte- og nyresvigt
De bedste måder at øge NAD+-niveauet i kroppen på:
Generelt opretholdes intracellulære NAD+-niveauer mellem 0,2 og 0,5 mM, afhængigt af celletype eller væv. Koncentrationen og fordelingen af NAD+ kan dog svinge som reaktion på forskellige fysiologiske stimuli og cellulær stress.
- Praktiser regelmæssig (intermitterende) faste og kaloriebegrænsning (læs mere her)
- Aktiver ketogenesen i kroppen og hav regelmæssige perioder med glukosebegrænsning
- Træn regelmæssigt
- Øv dig i varmeændring (læs mere her)
- De bedste fødevarekilder til NAD+-forstadier omfatter:
- Rå og fermenterede mejeriprodukter (højt indhold af NR)
- Fede fisk som laks, sardiner, ørred og makrel (højt indhold af niacin)
- Rensdyr-, okse- og kyllingelever (højt indhold af niacin)
- Svinekød og kalkun (højt indhold af tryptofan og niacin)
- Oksekød (højt indhold af niacin)
- Suppler med NAD+-forløbere
- Nicotinamid ribosid (NR): optimal dosis 300 mg pr. dag
- Nicotinamidmononukleotid (NMN): optimal dosis 250-500 mg pr. dag
- Liposomal dosis er ca. 10 gange mindre
- Brug sammen med trimethylglycin (TMG) for optimal methyleringsproces
- Niacinamid (NAM): optimal dosis 250-500 mg pr. dag
- Nikotinsyre (NA): optimal dosis 250-500 mg pr. dag
Der findes ingen langtidsdata om sikkerheden ved kontinuerligt tilskud med NAD+-forstadier, især NR og NMN. For høje NAD+-niveauer kan også forårsage forstyrrelser i NAD+/NADH-homøostasen. Disse omfatter uoverensstemmelser i døgnrytmen, og baseret på musestudierforstyrrelser i søvncyklus samt forstyrrede sult- og appetitmønstre. Baseret på dette kan det være ideelt at tage NAD+-forstadier om morgenen.
Anbefalede kosttilskud:
Fysiologiske fordele ved at have et højt NAD+ i kroppen:
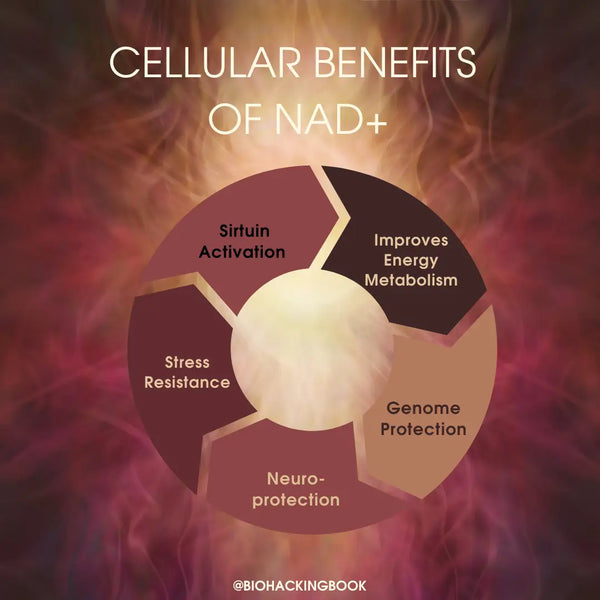
- Optimal mitokondriefunktion
- Afgørende biokemisk element i energiproduktion og muskelfunktion
- Optimal hjernefunktion og forebyggelse af neurodegeneration
- Optimal søvn-vågen-cyklus og opretholdelse af naturlige døgnrytmer
- Beskyttelse mod oxidativ stress og inflammation
- Cellulær overlevelse og iltproduktion
- Langsommere aldring og længere levetid og sundhedsspændvidde via mitofagi og DNA-reparation (baseret på musestudier)
- Nedsat risiko for hjertesygdomme via reversering af aldersrelateret arteriel dysfunktion og forbedret generel hjertesundhed (baseret på musestudier)
- Reduceret ældning af huden
///





