Tout ce que vous devez savoir sur le vieillissement et les processus anti-âge. Comment inverser le processus de vieillissement ? Quelles sont les 9 caractéristiques du vieillissement ? Lisez la suite pour le savoir !
En 2013, Carlos López-Otín et ses collègues ont publié un article novateur dans lequel ils tentaient d'identifier et de classer les caractéristiques cellulaires et moléculaires du vieillissement.. Ils ont proposé neuf caractéristiques candidates qui sont généralement considérées comme contribuant au processus de vieillissement et qui, ensemble, déterminent le phénotype du vieillissement. López-Otín et al. ont défini qu'une caractéristique devrait idéalement remplir les trois critères suivants : elle devrait se manifester au cours du vieillissement normal, son aggravation expérimentale devrait accélérer le vieillissement et son amélioration expérimentale devrait retarder le processus de vieillissement normal et donc augmenter la durée de vie en bonne santé.
Les neuf premières caractéristiques du vieillissement
La clé du ralentissement, voire de l'inversion du vieillissement, ne repose pas sur l'idée d'une simple augmentation de l'espérance de vie, mais sur celle d'une amélioration de la qualité de vie. l'espérance de vie en bonne santé (la période de vie passée en bonne santé, sans les maladies chroniques et les handicaps liés au vieillissement). La compression de la morbidité n'a pas été aussi importante jusqu'à présent, car nous avons davantage réduit la mortalité que prévenu la morbidité. L'espérance de vie en bonne santé (le nombre d'années de vie en bonne santé) augmentera lorsque la morbidité (le fait de souffrir d'une maladie ou d'un état pathologique) sera réduite, le plus efficacement possible en augmentant l'âge d'apparition de la maladie.
Vieillir avec succès et en bonne santé peut être défini comme suit :
- Faible probabilité de maladie ou d'incapacité
- Capacité cognitive et physique élevée
- Engagement actif dans la vie
Les neuf caractéristiques du vieillissement proposées sont regroupées en trois catégories :
- 1. Signes distinctifs primaires (causes des dommages)
- Les éléments déclencheurs dont les conséquences dommageables s'accumulent progressivement avec le temps. Toutes négatives sans équivoque.
- 2. Caractéristiques antagonistes (réponses aux dommages)
- Effets opposés aux caractéristiques principales. À de faibles niveaux, ils ont des effets bénéfiques, mais à des niveaux élevés, ils deviennent délétères (par exemple, la sénescence).
- 3. Signes distinctifs intégratifs (responsables du phénotype)
- Le résultat final des deux groupes de caractéristiques précédents est l'accumulation de dommages qui ne peuvent être compensés par les mécanismes homéostatiques des tissus. Ces dommages sont en fin de compte responsables du déclin fonctionnel associé au vieillissement.
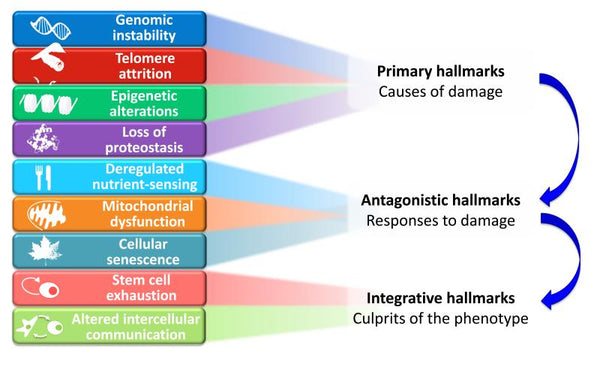
Image: Interconnexions fonctionnelles entre les caractéristiques du vieillissement.
Source d'information: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Les caractéristiques du vieillissement. Cellule 153 (6): 1194–1217.
1. Instabilité génomique
L'intégrité et la stabilité de l'ADN sont continuellement remises en question par des agents physiques, chimiques et biologiques externes, ainsi que par des menaces internes, notamment des erreurs de réplication de l'ADN, des réactions hydrolytiques spontanées et la production d'espèces réactives de l'oxygène. Ces menaces finissent par conduire à des erreurs de réplication de l'ADN. à la l'accumulation de dommages génétiques tout au long de la vie.
Moyens d'améliorer la stabilité génomique (caractéristique n° 1) :
- Micronutriments antioxydants (sélénium, zinc, vitamine C, vitamine E) -> limitent les lésions de l'ADN
- Corrige les carences, même légères, en folate, vitamine B12, niacine et zinc -> impact significatif sur le taux de dommages chromosomiques spontanés
- Ganoderma lucidum (reishi) glucanes
- Polyphénols -> éliminent les radicaux libres
- Exercice modéré et "autorégulé
- Éviter les éléments suivants
- Exposition aux radiations et aux produits chimiques
- Exposition aux métaux lourds
- Nickel, cadmium et arsenic, en particulier
- le tabagisme
- Rester assis trop longtemps
- Consommation excessive d'alcool, de boissons énergisantes et de lait
2. Attrition des télomères
Télomères sont particulièrement sensibles à la détérioration liée à l'âge. Le raccourcissement des télomères est observé au cours du vieillissement normal tant chez l'homme que chez la souris. Les télomères sont liés par un complexe multiprotéique appelé shelterinequi empêche les protéines de réparation de l'ADN d'accéder aux télomères (sans ce complexe, les télomères seraient "réparés" sous forme de cassures de l'ADN, ce qui entraînerait des fusions chromosomiques). Les lésions de l'ADN au niveau des télomères sont remarquablement constantes et très efficaces pour induire la sénescence.
Moyens de réduire le raccourcissement des télomères (Caractéristique n°2) :
- Augmenter l'apport alimentaire en antioxydants
- Consommation élevée d'acides gras oméga-3, en particulier
- Optimiser vitamine Dla vitamine B12, et folate dans le sang
- Régime méditerranéen
- Évitez les éléments suivants
- Fumer
- l'obésité
- Exposition aux toxines et pollution
- Équilibrer les niveaux de stress
- Équilibrer la routine d'exercice et les périodes d'exercice intense
- Méditation de l'amour bienveillant & méditation de pleine conscience pratique (et méditation en général)
- Oxygénothérapie hyperbare (OHB)
- Gynostème, gotu kola et astragale (possiblement efficace)
- Ce qui ne fonctionne pas: la restriction calorique à long terme
3. Altérations épigénétiques
De nombreux types d'altérations épigénétiques affectent toutes les cellules et tous les tissus tout au long de la vie. (causées par des facteurs tels que l'alimentation, les produits chimiques, les médicaments, la lumière du soleil, la chaleur/le froid, l'exercice, etc.) Les changements épigénétiques présupposent des altérations dans les éléments suivants les schémas de méthylation de l'ADN, la modification post-traductionnelle des histones et le remodelage de la chromatine.Membres de la famille des sirtuines, des protéines désacétylases et ADP ribosyltransférases dépendantes du NAD. ont fait l'objet d'études approfondies en tant que facteurs potentiels de lutte contre le vieillissement. Chez l'homme, au moins trois membres de la famille des sirtuines, SIRT1, SIRT3 et SIRT6, contribuent à un vieillissement en bonne santé.
Voies de gérer l'altération épigénétique (Hallmark #3) :
- Optimiser les voies de méthylation (folate, B12, B6, TMG)
- Activateurs des voies de la sirtuine (SIRT1, SIRT3, SIRT6) :
- Spermidine (inhibe les histones désacétylases)
- Restriction calorique intermittente et jeûne intermittent
- Exercice physique régulier (intense)
- Optimisation du sommeil (la perte de sommeil provoque des altérations épigénétiques néfastes)
- Metformine (les effets secondaires constituent une mise en garde) ; de préférence (dihydro)berbérine
- Alpha-cétoglutarate (CaAKG)
- Obtenir régulièrement des doses hormonales de chaleur, froid, soleil, etc. ("le poison est dans la dose")
- Médicaments épigénétiques en développement qui ciblent l'ADN méthyltransférase, l'histone désacétylase, l'histone méthyltransférase et la chromatine
Suppléments recommandés :
Quercétine liposomale Purovitalis
Resvératrol liposomal Purovitalis
4. Perte de protéostase
La protéostasie comprend des mécanismes de stabilisation des protéines correctement repliées (en particulier la famille des protéines de choc thermique) et des mécanismes de stabilisation des protéines de l'organisme. dégradation des protéines par le protéasome ou le lysosome.. De nombreuses études ont démontré que la protéostase est altérée avec le vieillissement conduisant à l'expression chronique de protéines dépliées, mal repliées ou agrégées. Celles-ci contribuent au développement de certaines maladies dégénératives liées à l'âgeliées à l'âge, telles que la maladie d'Alzheimer.
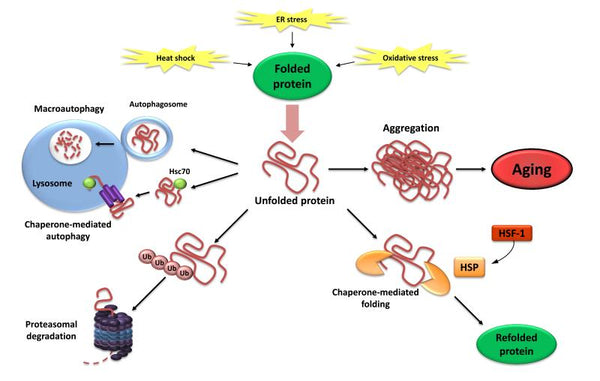
Image: Perte de la protéostase. L'incapacité à replier ou à dégrader les protéines non pliées peut conduire à leur accumulation et à leur agrégation, ce qui entraîne des effets protéotoxiques.
Source d'information: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Les caractéristiques du vieillissement. Cellule 153 (6): 1194–1217.
Moyens d'améliorer la stabilité de la protéostase (caractéristique n° 4) :
En général, la meilleure façon de protéger l'organisme contre la perte de la protéostase consiste à activer l'autophagie.
- Jeûne, restriction calorique intermittente (le long terme n'est pas utile !), cétose, l'exercice (à jeun de préférence), l'entraînement en résistance, le froid & exposition à la chaleursommeil profond (et mélatonine)
- Sulforaphane, café, curcumine, polyphénols, EVOO, resvératrol, thé vert, spermidine
- Nutriments et suppléments sénolytiques:
- Quercétine, fisétine, lutéoline, curcumine, piperlongumine, hydrogène moléculaire (H2) etc.
- Activateurs de l'AMPK:
- Berbérine (DHB encore mieux), resvératrol (et ptérostilbène), hespéridine, ginsénosides, quercétine, curcumine, naringénine, gynostème, crocine (dans le safran), acide salvianolique B, acide alpha-lipoïque, etc.
- Metformine & rapamycine (Nb. poseffets secondaires possibles)
- Inducteurs de la Hsp70 (protéine de choc thermique 70):
- Sauna et exposition à la chaleur
- Shikonine (provenant des racines de la plante shikonine)
- Médicaments sénolytiques spécifiques (tels que le Dasatinib et le Navitoclax)
5. Dérèglement de la détection des nutriments
La signalisation de l'IGF-1 et de l'insuline est connue comme le voie IISqui est la voie de contrôle du vieillissement la plus conservée dans l'évolution. Outre la voie IIS qui participe à la détection du glucose, il existe d'autres voies de signalisation de l'IGF-1 et de l'insuline. trois autres systèmes de détection des nutriments liés et interconnectésmTOR (détection des concentrations élevées d'acides aminés), AMPK (détection des états de faible énergie par la détection des niveaux élevés d'AMP) et sirtuines (détection des états de faible énergie par la détection des niveaux élevés de NAD+). En résumé, il existe des preuves solides que signalisation anabolique (mTOR, taux d'insuline élevé) accélère le vieillissement et que la diminution de la signalisation des nutriments (AMPK, taux d'insuline faible) prolonge la longévité.
Moyens de gérer la détection dérégulée des nutriments (caractéristique n° 5) :
En pratique, tous les moyens précédents de gérer les caractéristiques 1 à 4 sont couverts par la sensibilisation et la re-régulation de la détection des nutriments. Il s'agit notamment de
- les restrictions alimentaires
- l'activation de l'AMPK
- activation des sirtuines
- hormèse
- réduction du stress oxydatif et de l'inflammation
- augmentation de l'autophagie
6. Dysfonctionnement mitochondrial
Il a été constaté que le dysfonctionnement des mitochondries accentue le processus de vieillissement. Lorsqu'un organisme vieillit, l'efficacité de la chaîne respiratoire des cellules diminue, ce qui a pour effet d'augmenter le taux de mortalité. ce qui entraîne une fuite d'électrons et une réduction de la production d'ATP.. L'efficacité de la chaîne respiratoire des cellules diminue au fur et à mesure que l'organisme vieillit. efficacité réduite de la bioénergétique mitochondriale avec le vieillissement peut résulter de multiples mécanismes croisésParmi ces mécanismes, citons la réduction de la biogenèse des mitochondries, l'accumulation de mutations et de délétions dans l'ADNmt, le stress oxydatif des protéines mitochondriales, la déstabilisation de la chaîne respiratoire, les changements dans la composition lipidique des membranes mitochondriales et les altérations de la dynamique mitochondriale.
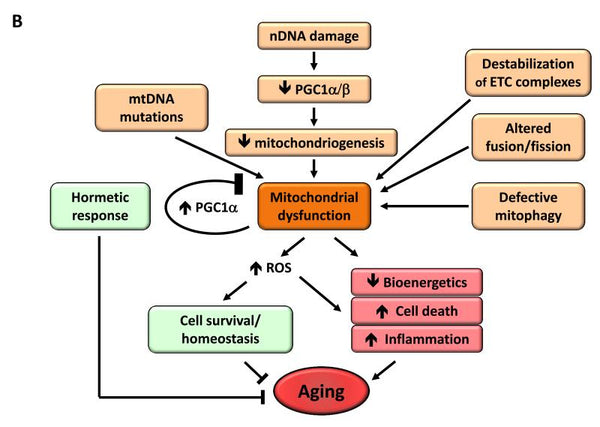
Image: Dysfonctionnement mitochondrial et ses effets sur le vieillissement.
Source d'information: López-Otín, C. & Blasco, M. & Partridge, L. & Serrano, M. & Kroemer, G. (2013). Les caractéristiques du vieillissement. Cellule 153 (6): 1194–1217.
Les moyens de gérer le dysfonctionnement mitochondrial (Caractéristique n°6) :
- Activer la mitohormèse avec:
- Restriction calorique intermittente
- le jeûne intermittent
- Exercice physique
- Exposition au froid
- Phytonutriments (tels que les flavonoïdes)
- Ciblent la voie Nrf2 (homéostasie et intégrité structurelle) avec :
- Exposition à la chaleur et au froid
- Exercice physique
- Jeûne intermittent et cétose
- Sulforaphane, polyphénols, quercétine, curcumine, etc.
- Hydrogène moléculaire (H2) -> recommandation de produit
- Améliorer la biogenèse et la réparation des mitochondries (activation de PGC-1α) :
- Exercice physique
- Cétose et corps cétoniques
- Acétyl-L-carnitine
- Polyphénolsquercétine
- Rhodiola rosea (salidrosides)
- Coenzyme Q10, pyrroloquinoline quinone (PQQ), nicotinamide mononucléotide (NMN), acide alpha-lipoïque (ALA)
7. Sénescence cellulaire
Le nombre de cellules sénescentes augmentant avec le vieillissement, on a supposé que la sénescence contribue au vieillissement. La sénescence est cependant nécessaire pour empêcher la distribution et la prolifération de cellules endommagées qui déclenchent une réponse du système immunitaire. Ce point de contrôle cellulaire nécessite un système de substitution cellulaire efficace qui implique à la fois l'élimination des cellules sénescentes et la mobilisation des cellules progénitrices pour restaurer le nombre optimal de cellules. Les cellules sénescentes présentent des altérations substantielles de leur sécrétome, qui est particulièrement enrichi en cytokines pro-inflammatoires et en métalloprotéinases matricielles. C'est ce que l'on appelle le "phénotype sécrétoire associé à la sénescence".
Moyens de lutter contre la sénescence cellulaire (caractéristique n° 7) :
Les cellules sénescentes finissent par cesser de se multiplier, mais ne meurent pas au moment opportun, comme le font les cellules normales. Au lieu de cela, elles restent et continuent à libérer des substances chimiques qui peuvent déclencher une inflammation et une réponse immunitaire.
Composés sénolytiques qui ciblent sélectivement les cellules sénescentes incluent :
- la fisétine (également appelée "l'ultime sénolytique")
- Quercétine
- Théaflavines
- Apigénine
- Tocotriénols (forme de vitamine E)
- Piperlongumine
- Hydrogène moléculaire (H2)
8. Épuisement des cellules souches
Les cellules souches adultes sont capables de s'auto-renouveler et de se différencier en de multiples types de cellules au sein d'un tissu. Bien que les phénotypes et les mécanismes varient considérablement, toutes les populations de cellules souches perdent leur fonction avec l'âge. L'épuisement des cellules souches est la conséquence unifiée de divers dommages associés au vieillissement et constitue probablement l'un des responsables ultimes du vieillissement cellulaire. Des études sur des souris âgées ont révélé une diminution globale de l'activité du cycle cellulaire des cellules souches. cellules souches hématopoïétiques (CSH)qui est en corrélation avec l'accumulation des lésions de l'ADN et de l'ADN. la surexpression de protéines inhibitrices du cycle cellulaire (p. ex. p16INK4a). Le raccourcissement des télomères s'est également révélé être une cause importante du déclin des cellules souches au cours du vieillissement.
Moyens de lutte l'épuisement des cellules souches (point fort n°8) :
- Thérapie par cellules souches (autologue vs allogène & différents types de cellules)
- Les thérapies à base de cellules souches sont encore un "Far West". les effets secondaires et les risques potentiels existentLes maladies infectieuses, telles que la croissance des tumeurs et le cancer.
- Photobiomodulation ("thérapie par la lumière rouge")
- La PBM stimule différents types de cellules souches afin d'améliorer leur migration, leur prolifération et leur différenciation in vitro et in vivo.
- Restaurer les cellules souches âgées en ciblant les métabolites toxiques :
- Activer les sirtuines - SIRT1 et SIRT 3 (voir #3 & #4)
- N-acétyl-cystéine (NAC)
- Améliore la stabilité de la protéostase (voir n°4)
- Améliorer la fonction mitochondriale (voir #6)
- Utiliser des sénolytiques (voir #7)
- Restaurer la mémoire épigénétique (voir n° 3)
- Optimiser les niveaux de vitamine D
- Spiruline (étude in vitro)
9. Modification de la communication intercellulaire
Le vieillissement cellulaire se produit également au niveau de la communication intercellulaire. Le vieillissement cellulaire se produit également au niveau de la communication intercellulaire, notamment au niveau de la signalisation neurohormonale (augmentation des réactions inflammatoires), de l'immunosurveillance (agents pathogènes et cellules précancéreuses) et des modifications de l'environnement extracellulaire. Le vieillissement dû à l'inflammation est appelé "inflammation".. Il peut résulter de causes multiples, telles que l'accumulation de lésions tissulaires pro-inflammatoires, l'incapacité d'un système immunitaire dysfonctionnel à éliminer efficacement les agents pathogènes et les cellules hôtes dysfonctionnelles, et l'apparition d'une réponse autophagique déficiente. Les changements liés au vieillissement dans un tissu peuvent entraîner une détérioration spécifique du tissu voisin : les cellules sénescentes induisent la sénescence dans leurs cellules adjacentes par le biais de contacts cellule-cellule médiés par des jonctions lacunaires et de processus impliquant des espèces réactives de l'oxygène. Ce phénomène est également appelé effet de proximité des cellules sénescentes.
Moyens d'améliorer intercellulaire (point fort n° 9) :
- Diminution de l'inflammation générale dans l'organisme
- Une approche globale du mode de vie anti-inflammatoire
- Utiliser de l'hydrogène moléculaire (H2)
- Effets antivieillissement multiples dans l'organisme (y compris la réduction de l'inflammation)
- Diminution du stress oxydatif dans l'organisme et réduction des espèces réactives de l'oxygène (ROS)
- Augmenter l'autophagie dans l'organisme (voir ci-dessus)
- Traiter la dysbiose intestinale et améliorer la diversité et la santé générale du microbiote intestinal.
- Traiter un éventuel syndrome de l'intestin perméable
10. Rigidité de la matrice extracellulaire (MEC)
Outre ces neuf caractéristiques du vieillissement définies en 2013, une dixième caractéristique est en cours d'élaboration. Deux chercheurs, Alexander Fedintsev et Alexey Moskalev, ont publié en 2021 un article qui examine de plus près la rigidité de la matrice extracellulaire (MEC) : l'accumulation de liaisons transversales entre des molécules à longue durée de vie telles que le collagène et l'élastine. Ils suggèrent que la rigidification de la matrice extracellulaire est causée par les réactions chimiques non enzymatiques de la glycation, de la carbamylation et de la carbonylation et qu'elle pourrait même être la cause en amont de plusieurs caractéristiques reconnues du vieillissement, telles que la sénescence cellulaire.. Ces changements entraînent la formation d'adduits et de liaisons croisées qui, à leur tour, provoquent des inflammations, des fibroses, une altération de l'horloge circadienne des tissus, le vieillissement des cellules souches, etc. Il a déjà été établi que les produits finaux de glycation avancée (AGE) ont une importance pathogène pour divers tissus et voies de l'organisme. Les organismes dont la durée de vie est extraordinairement longue (comme la baleine boréale) présentent des taux d'accumulation d'AGE exceptionnellement bas.
Thérapeutique potentielle pour la rigidité de la matrice extracellulaire (Hallmark #10) :
Dans les muscles squelettiques humains, la déficience fonctionnelle liée à l'âge est due à une rigidité accrue de la matrice extracellulaire, principalement causée par l'accumulation de collagène.
- Thérapie manuelle et pression mécanique
- Thérapie ostéopathiqueacupuncture, libération myofasciale
- Une combinaison de produits synthétiques et inhibiteurs naturels d'AGE agissant en synergie à différents stades de la formation
- Les produits naturels comprennent la carnosine, l'acide alpha-lipoïque, la taurine, la vitamine C, la benfotiamine et la pyridoxamine ->. recommandation de produit
- Polyphénols, terpénoïdes et polysaccharides
- Réduire également la consommation de produits finaux de glycation avancée dans l'alimentation
- Stimuler l'élastogenèse (nouveaux médicaments ?)
- Antagonistes du RAGE (récepteur des produits finaux de la glycation avancée) [différents peptides].
///







