Mitochondrien sind wichtige Organellen im Zytoplasma eukaryotischer Zellen. Mit gut funktionierenden Mitochondrien funktioniert jeder Prozess im Körper, von Bewegung und Bewegung über Verdauung und Genesung, besser. Sie spielen eine wesentliche Rolle bei der Energieerzeugung und vielen anderen zellulären Prozessen. Mitochondrien bieten den Ort für die oxidative Phosphorylierung, die ATP, die primäre Energiequelle der Zelle, erzeugt. Strukturell kann Mitochondrien durch eine äußere Membran und eine hoch gefaltete innere Membran bewertet werden, die für ihren Stoffwechsel erforderlich ist. Neben der Energieerzeugung führen Mitochondrien zusätzlich zur Apoptose (programmierter Tod) andere Aktivitäten wie Calciumsignalisierung und Regulierung des Zellstoffwechsels durch, was sie für die Aufrechterhaltung der Zellhomöostase von entscheidender Bedeutung macht.
Die Grundlagen der Mitochondrienfunktion
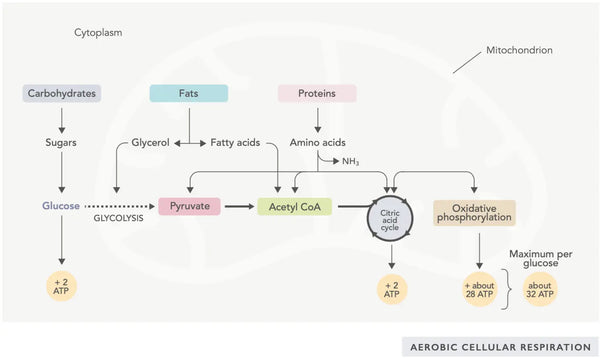
ATP -Erzeugung (das von Zellen verwendete primäre Energiemolekül) ist das grundlegende Merkmal der mitochondrialen Aktivität. Dieser Prozess erfolgt über zwei biochemische Hauptwegen: den Zitronensäurzyklus (TCA -Zyklus oder Krebszyklus) und die Elektronentransportkette (usw.).
Zitronensäurezyklus
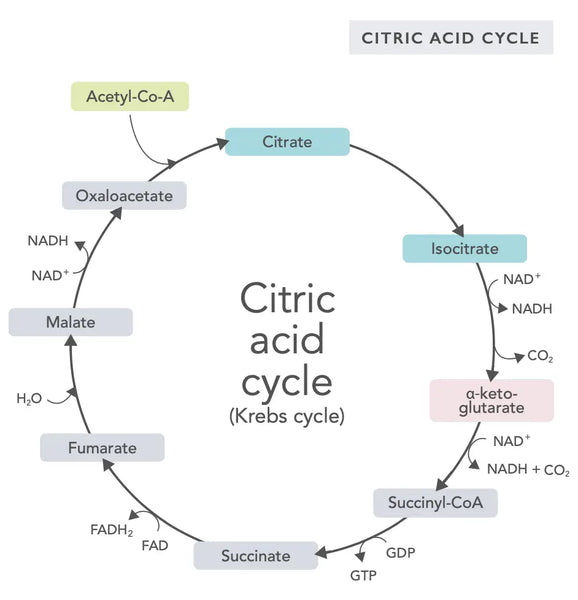
Der Zitronensäurezyklus oder der Krebszyklus (benannt nach dem Nobelpreisträger Hans Adolf Krebs, der ihn entdeckt hat) tritt in Zell -Mitochondrien auf.(1)Die primäre metabolische Verbindung des Zitronensäurezyklus ist Essigsäure (Acetyl -Coenzym A), die aus Fettsäuren, Kohlenhydraten und Proteinen hergestellt wird.(2)
Die verschiedenen Reaktionen des Zitronensäurezyklus (siehe Bild) bilden Wasserstoffionen und Elektronen, die dann zur oxidativen Phosphorylierung (Bindungsenergie an ATP -Moleküle durch Oxidation) und die Elektronentransportkette auf die innere mitochondriale Membran übertragen werden. Die Reaktion gibt NADH und kleine Mengen von frei ATP und Kohlendioxid.
Der Zitronensäurezyklus umfasst zehn Schritte, die jeweils von B -Vitaminen, bestimmten Mineralien wie Magnesium und Eisen und dem Haupt -Antioxidans der Leber, Glutathion, betroffen sind. Die Reaktionen werden durch Schwermetalle wie Quecksilber, Arsen und Aluminium gehemmt.
Die energiereichen NADH-Moleküle erfassen die meisten während des Zitronensäure erzeugten Energie. Für jedes Acetyl -Coenzym Ein Molekül werden drei NADH -Moleküle erzeugt und dann in der folgenden Reaktion zur Energieversorgung verwendet (oxidative Phosphorylierung).
Die Regulierung des Zitronensäurzyklus wird durch die Verfügbarkeit verschiedener Aminosäuren und Rückkopplungshemmung bestimmt (beispielsweise werden beispielsweise zu viel NADH erzeugt, wobei mehrere Enzyme des Zitronensäurezyklus inhibiert werden und die Reaktionen verlangsamt).
Oxaloacetat ist eine Verbindung, die ein plötzliches Bedürfnis erfüllt, Energie zu produzieren (zum Beispiel im Gehirn oder im Muskeln). Die Einnahme eines Oxalacetat -Supplements kann nützlich sein und kann sogar die Regeneration von Mitochondrien im Gehirn steigern, die stille Entzündung im Körper verringern und die Anzahl der Nervenzellen erhöhen.(3)
Einfach ausgedrückt, der Körper enthält geniale Systeme, die verbrauchte Lebensmittel in Elektronen umwandeln, die als Energie für verschiedene Bedürfnisse verwendet werden.
Oxidative Phosphorylierung
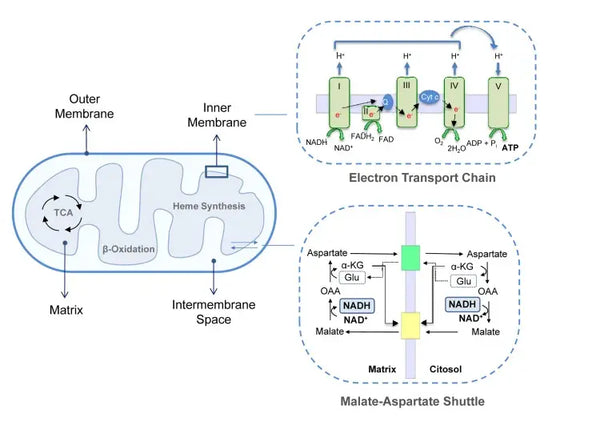
Die oxidative Phosphorylierung besteht aus der Elektronentransportkette und der ATP -Synthase. Die oxidative Phosphorylierung erzeugt die meiste Energie, die unter aeroben Bedingungen (ATP) erzeugt wird. Es ist eine Fortsetzung des Zitronensäurezyklus.
In der Elektronentransportkette werden Wasserstoffionen (H+) in den mitochondrialen Intermembranraum freigesetzt. Die Wasserstoffionen, die aus dem Intermembranraum freigesetzt werden, bewegen sich durch ATP -Synthase zurück in das Mitochondrion. Mit der im Prozess freigesetzten Energie konvertiert die ATP -Synthase die für Energie verwendete ADP erneut in ATP.
UbiKinon (Coenzym Q10) trägt zur Elektronentransportkette bei. Es wird seit Jahrzehnten als Nahrungsergänzungsmittel verwendet. Niedrige zelluläre Ubiquinonspiegel können ein prädisponierender Faktor für verschiedene Krankheiten aufgrund der unzureichenden aeroben Energieproduktion in den Zellen sein. Darüber hinaus ist die Verwendung von Cholesterinmedikamenten (Statinen) ein Beitrag zum Ubiquinonmangel.(4)
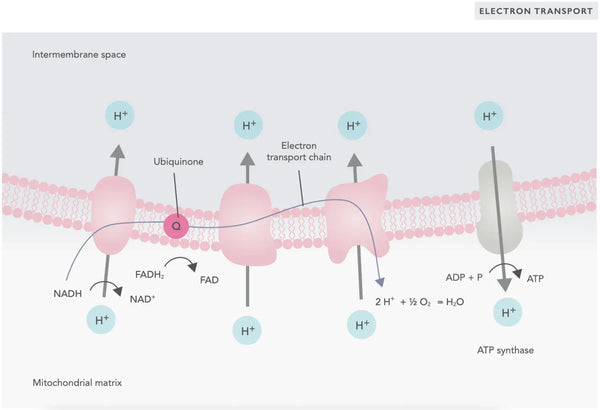
Dieser koordinierte Satz von Reaktionen erzeugt ATP und schafft einen Protonengradienten über die innere mitochondriale Membran, ein Prozess, der als bekannt ist Chemiosmose. Die in diesem Gradienten gespeicherte Energie treibt die Synthese von ATP an und verbindet den Elektronenfluss durch die usw. mit der Erzeugung von zellulärer Energie.(5)
Faktoren, die die Mitochondrieneffizienz beeinflussen
Die mitochondriale Effizienz, die offensichtlich für eine optimale zelluläre Funktion von entscheidender Bedeutung ist, wird durch verschiedene Faktoren beeinflusst. Nachfolgend sind die wichtigsten beschrieben.
Genetisches Make -up
Mitochondrien besitzen eine separate und individuelle DNA (mitochondriale DNA, mtDNA), die sich von der nuklearen DNA unterscheidet. MtDNA codiert für wesentliche Komponenten der Elektronentransportkette und mitochondriale Proteine. Mutationen in mtDNA können zu dysfunktionalen Proteinen führen, die die Elektronentransportkette und die ATP -Synthese stören. Diese können zu einer verringerten Energieproduktion und einer erhöhten Erzeugung der reaktiven Sauerstoffspezies (ROS) führen, was zur mitochondrialen und zellulären Dysfunktion beiträgt.(6)
Oxidativer Stress
Mitochondrien sind eine bedeutende Quelle für ROS, die Nebenprodukte des Sauerstoffstoffwechsels sind. Während niedrige ROS -Werte in der zellulären Signalübertragung funktionieren, kann übermäßige ROS oxidative Schäden an Mitochondrienproteinen, Lipiden und DNA verursachen. Dieser oxidative Stress beeinträchtigt die Integrität und Funktion der Mitochondrien, hemmt die ATP -Produktion und führt zu einer weiteren ROS -Produktion in einem schädlichen Zyklus. Antioxidative Abwehrkräfte, einschließlich Superoxiddismutase und Glutathionperoxidase, spielen eine entscheidende Rolle bei der Minderung dieses Schadens.(7-8)
Nährstoffverfügbarkeit
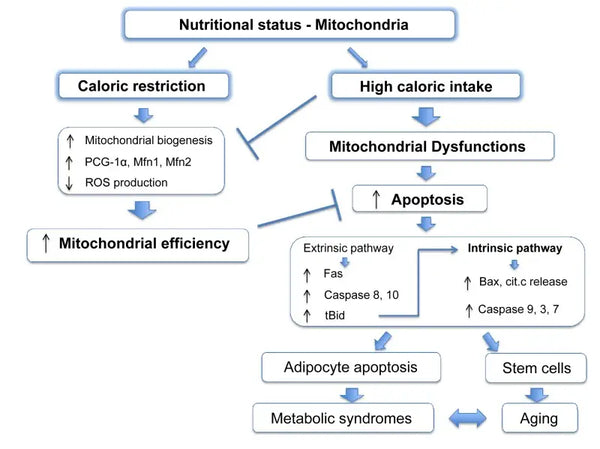
Mitochondrien erfordern spezifische Substrate für die Energieerzeugung. Glukose- und Fettsäuren sind primäre Quellen für die ATP-Erzeugung durch Glykolyse bzw. β-Oxidation. Die Verfügbarkeit dieser Substrate wirkt sich direkt auf die Mitochondrienfunktion aus. Beispielsweise können Mitochondrien unter Bedingungen des Nährstoffüberschusses wie hoher Glukoseverfügbarkeit zu übermäßigen Mengen an ATP und ROS erzeugen, was möglicherweise zu Stoffwechselstörungen führt.(9-10)
Umgekehrt kann die Nährstoffknappheit mitochondriale Energieerzeugung einschränken und die Zellfunktion und das Überleben beeinflussen. Im Gegensatz zu einigen Berichten aus Tierstudien über die Vorteile der Kalorienbeschränkung der mitochondrialen Biogenese scheint es, dass sie die mitochondriale Biogenese nicht erhöht. Es bewahrt jedoch die Mitochondrienfunktion, indem es die Integrität und Funktion vorhandener zellulärer Komponenten schützt.(11-12)
Lebensstilfaktoren
Übung
Körperliche Aktivität beeinflusst die mitochondriale Menge und Qualität. Das Training stimuliert die mitochondriale Biogenese, was zu einer Zunahme der mitochondrialen Dichte und Effizienz der Energieproduktion führt.(13) Insbesondere das Ausdauertraining verbessert die oxidative Kapazität von Mitochondrien und verbessert ihre Fähigkeit, Sauerstoff für die ATP -Produktion zu verwenden (lesen Sie später im Artikel im Detail im Detail).
Diät
Nahrungskomponenten beeinflussen die Mitochondrienfunktion signifikant. Makronährstoffverhältnisse, Kalorienaufnahme und spezifische Nährstoffe (wie Antioxidantien, Vitamine und Mineralien) beeinflussen den mitochondrialen Metabolismus. Diäten, die reich an Nährstoffen sind, die die mitochondriale Funktion unterstützen, können die Energieerzeugung verbessern und oxidativen Stress verringern (siehe später). Aktivierung Ketose kann auch die mitochondriale Biogenese erhöhen und die mitochondriale Effizienz verbessern.(14-15)
Umweltfaktoren
Die Exposition gegenüber Umweltstressoren wie Toxinen, Schadstoffen, Schwermetallen (z. B. Blei, Quecksilber, Arsen und Cadmium) und Strahlung können die Mitochondrienfunktion nachteilig beeinflussen. Diese Stressoren können oxidative Schäden induzieren, die Aktivität der Elektronentransportkette stören und die mitochondriale Dynamik der Mitochond, einschließlich Fusions- und Spaltprozesse, beeinträchtigen.(16)
Technologische Interventionen
Photobiomodulation (oder Rotlichttherapie)
Photobiomodulation ist die Nutzung nichtionisierender photonischer Energie, um photochemische Veränderungen in zellulären Strukturen auszulösen, die für Photonen, insbesondere in Mitochondrien, empfänglich sind. Es wird angenommen, dass Rotlicht und NIR -Lichttherapie hauptsächlich durch Fotoakzeptoren funktionieren. Rotlichtwellen dringen in die Haut ein und erreichen die Mitochondrien der Zelle, wodurch die Energieerzeugung der Zellen erhöht wird. Verschiedene Ereignisse führen zum Beispiel zur Beschleunigung der mitochondrialen Atmung über Cytochrom -C -Oxidase (17) Lesen Sie hier über die gesundheitlichen Vorteile der Photobiomodulation.
Infrarot -Sauna
Infrarot -Saunen verwenden Infrarotstrahlung, die Körpergewebe direkt anstelle von Luft erwärmt. Die Häufigkeit der durch Infrarotsaunen emittierten Strahlung beträgt 3–12 μm, was unter weit infrarot (FIR) fällt. Es wurde festgestellt, dass weitinfrarotes Licht auf Gewebeebene auswirkt, insbesondere auf die Mitochondrien-Atemkette im Zellsenergieproduktionsprozess und die Blutversorgung von Geweben durch Erweiterung von Blutgefäßen und Verbesserung der Kreislauf.(18)
Pulsed Electromagnetic Field (PEMF) -Therapie
Die PEMF -Therapie verwendet elektromagnetische Felder, um verschiedene physiologische Prozesse zu fördern. Untersuchungen legen nahe, dass PEMF die Mitochondrienfunktion verbessern kann, indem er den Zell -Sauerstoffverbrauch erhöht und die Produktion von ATP verbessert. Die PEMF -Therapie wirkt sich direkt auf die Mitochondrien aus und kehrt Zellen in einen gesünderen Energie- und elektrischen Ladungszustand zurück.(19-20) Lesen Sie hier den umfassenden Leitfaden zur PEMF -Therapie.
Hyperbarische Sauerstofftherapie (HBOT)
HBOT beinhaltet das Atmen von reinem Sauerstoff in einer unter Druck stehenden Umgebung. Es wurde klinisch nachgewiesen, dass eine hyperbare Sauerstofftherapie die Mitochondrien revitalisiert und die ATP -Bildung erhöht, indem supraphysiologische Mengen an Sauerstoff bereitgestellt werden, die für die Zellatmung erforderlich sind. In einer kürzlich durchgeführten Studie wurde berichtet, dass HBO die Biogenese und Autophagie der Mitochondrien erhöhte, indem sie die Produktion von reaktiven Sauerstoffspezies teilweise erhöhte. Dieser Prozess führte zu neuen gesunden Mitochondrien, und alte dysfunktionale Mitochondrien wurden zerstört. Diese Studie fand auch eine erhöhte Aktivierung der Transkription und Replikation von Mitochondrien -DNA.(21-22) Erfahren Sie hier mehr über HBOT.
Ernährung und ergänzende Unterstützung für die Mitochondrienfunktion
Die Rolle der Ernährung bei der Aufrechterhaltung der mitochondrialen Gesundheit ist entscheidend, wobei bestimmte Nährstoffe für eine optimale mitochondriale Funktion besonders wichtig sind. Dazu gehören die folgenden folgenden.
- Coenzym Q10 (CoQ10): Ubikinon ist fettlöslich und ähnelt einem Vitamin. UbiKinon fungiert als Elektronenträger in der Elektronentransferkette in Mitochondrien (siehe Abbildung rechts) und fördert die Sekretion von ATP. Die Ubikinonspiegel nehmen in verschiedenen Geweben mit dem Altern ab.(23)
- Magnesium: Beteiligt an der ATP -Synthese und entscheidend für die Aufrechterhaltung der mitochondrialen Integrität und Funktion.(24)
- B Vitamine: Einschließlich B1 (Thiamin), B2 (Riboflavin), B3 (Niacin), B5 (Pantothensäure), B6, B7 (Biotin) und B12. Diese B -Vitamine sind für verschiedene Aspekte des mitochondrialen Energiestoffwechsels von entscheidender Bedeutung.(25)
- Alpha-Liponsäure: ALA ist ein starkes Antioxidans, das auch hilft, andere Antioxidantien zu regenerieren. Es spielt eine Rolle im Energiestoffwechsel und kann die Mitochondrienfunktion verbessern.(26)
- Carnitin (insbesondere Acetyl-l-Carnitin): Transportiert Fettsäuren in Mitochondrien zur Beta-Oxidation, was für die Energieproduktion von entscheidender Bedeutung ist, insbesondere in Muskelzellen.(27)
- Kreatin: Kreatin ist eine natürlich vorkommende Verbindung im Körper, die den Zellen, insbesondere den Muskelzellen, Energie liefert, indem die Bildung von Adenosintriphosphat (ATP) erhöht wird. Die Kreatin-Supplementierung kann die Mitochondrieneffizienz verbessern, insbesondere bei hoher Intensitätsübungen.(28)
- Pyrrolochinolin Chinon (PQQ): PQQ ist ein Antioxidans, das die mitochondriale Biogenese über den PGC-1-Proteingehalt erhöht und die mitochondriale Funktion unterstützt.(29)
- Omega-3-Fettsäuren (EPA und DHA): Omega-3S sind für die Aufrechterhaltung der Fluidität und Funktion der mitochondrialen Membranmembran vonsentiell. Diese sind hauptsächlich in Fischöl und fettem Fisch zu finden.(30)
- Nikotinamid -Ribosid (NR) und Nikotinamidmononukleotid (NMN): Diese NAD+ -Preprearten sind für die Mitochondrienfunktion und die Energieerzeugung von wesentlicher Bedeutung. Die Ergänzung mit NR oder NMN kann dazu beitragen, die NAD+ -Pegel zu erhöhen und somit die Mitochondrieneffizienz zu verbessern.(31) Lesen Sie hier mehr über die Optimierung von NAD+.
- Curcumin: Curcumin ist die aktive Verbindung in Kurkuma. Es wurde gezeigt, dass es Mitochondrien vor oxidativen Schäden schützt und ihre Funktion verbessert.(32)
- Selen: Ein wesentliches Spurenelement, das eine Rolle beim Schutz von Mitochondrien vor oxidativem Stress spielt. Selen reguliert auch die mitochondriale Biogenese.(33)
Bewegung und mitochondriale Biogenese
Regelmäßige körperliche Aktivität ist ein kritischer Faktor für die Förderung der mitochondrialen Biogenese, die zur Schaffung neuer Mitochondrien führt und damit ihre Menge und funktionelle Kapazität in Zellen verbessert. Verschiedene Formen von Übungen haben unterschiedliche Auswirkungen auf die mitochondriale Dynamik. Die beiden wichtigsten Formen oder Übungen sind aerobisches Training und Krafttraining.
Aerobische Übung
Die mitochondriale Dichte in Skelettmuskelzellen erhöht sich während der aeroben Bewegung merklich (z. B. Laufen, Radfahren und Schwimmen).
Die mitochondriale Biogenese wird durch PGC-1α (Peroxisom-Proliferator-aktivierter Rezeptor-Gamma-Coaktivator 1-Alpha) reguliert, ein wesentliches regulatorisches Protein, das aerobe Aerobe Training stimuliert. PGC-1 & agr; coctiviert nukleare Atemfaktoren (NRFs) und mitochondriale Transkriptionsfaktor A (TFAM), die zur Transkribe von mtDNA und der Replikation von Mitochondrien erforderlich sind. Dies führt zu einer erhöhten oxidativen Phosphorylierungseffizienz, einer besseren Ausdauer und einer größeren ATP -Erzeugung in Muskelzellen.(34)
Das Hoch intensive Intervalltraining (HIIT) ist besonders effektiv zur Erhöhung der Anzahl der Mitochondrien und der maximalen Sauerstoffaufnahme (Vo2max).(35-36)
Widerstandstraining
Mitochondrienfunktion und Effizienz sind die Hauptziele des Widerstandstrainings (z. B. Gewichtsheben und Körpergewichtsübungen). Es löst Veränderungen der mitochondrialen Proteinsynthese aus und verbessert die Qualität und Wirksamkeit der gegenwärtigen Mitochondrien. Krafttraining erhöht auch die Produktion von Enzymen in Elektronentransportketten und den Krebszyklus und verbessert die Zellkapazität für die ATP -Synthese weiter. Es kann auch die Anzahl und Größe von Mitochondrien in Muskelzellen erhöhen, obwohl nicht in gleichem Maße wie aerobe Bewegung.(37-38)
Die kombinierte Wirkung dieser Übungsmodalitäten auf die mitochondriale Biogenese und Funktion unterstreicht die Bedeutung der körperlichen Aktivität für die Aufrechterhaltung und Verbesserung der Mitochondriengesundheit. Das regelmäßige Engagement von Aerobic und Resistance Training verbessert umfassend die mitochondriale Dichte, Effizienz und Energiestoffwechsel der Zellen. Diese Anpassungen sind für die sportliche Leistung von entscheidender Bedeutung und sind für die Erhaltung der Gesundheitsbehörde, die Prävention von Krankheiten und die Behandlung von Erkrankungen im Zusammenhang mit mitochondrialen Dysfunktionen von Bedeutung.
Man sollte jedoch beachten, dass das Training für Stärke und Ausdauer gleichzeitig zu einer geringeren Anpassung führt, da Proteinkinasen PKB und AMPK die nachgeschaltete Signalübertragung blockieren und den gleichzeitigen Trainingseffekt behindern.(39)
Mitophagie und Zellgesundheit
Die Mitophagie bezieht sich auf eine selektive Art von Autophagie, die unter zellulären Bedingungen eine wesentliche Rolle spielt, indem nur die beschädigten oder nicht funktionierenden Mitochondrien abgebaut werden. Dieser Mechanismus ist entscheidend für die Gesundheit von Mitochondrien und einer Zelle, wodurch mRNAs, die eine fehlerhafte Untereinheit montieren, daran hindert, dass die Aufnahme von mangelhaften Untereinheiten kodiert und damit weitere Krisen in zellulären Funktionen und zahlreichen Pathologien spart.(40)
Die Beseitigung der beschädigten Mitochondrien durch Mitophagie hilft, oxidativen Stress, Apoptose und Entzündung (mit verschiedenen Pathologien verbunden) zu verringern. Eine beeinträchtigte Mitophagie erleichtert die Akkumulation von dysfunktionalen Mitochondrien bei der Pathogenese von Neurodegenerationsstörungen wie Parkinson- und Alzheimer -Krankheit. In ähnlicher Weise führt der Mitophagieverlust bei Stoffwechselstörungen zu Veränderungen des mitochondrialen Stoffwechsels, was zu Insulinresistenz und Typ -2 -Diabetes führt.(41-42)
Es wurde gezeigt, dass die Kalorienbeschränkung die Mitophagie fördert. Dies ist teilweise auf die Aktivierung von Sirtuinen (SIRT1), AMP-aktivierter Proteinkinase (AMPK) und Transkriptionsfaktor EB zurückzuführen, die sowohl die Reaktion der Zellsenergiekrisen als auch die Initiierung der Mitophagie unterstützen. Insbesondere regulieren Sirtuine die Funktion von Faktoren bei Mitophagie -Maschinerie und schweigen von beschädigten Mitochondrien.(43)
Die molekularen Wirkungen der Kalorienrestriktion werden durch Verbindungen wie Resveratrol (ein Polyphenol in Rotwein und einige Beeren) und viele andere Polyphenole nachgeahmt. Resveratrol fördert die Aktivierung der SIRT1- und AMPK -Aktivierung und erhöht die Mitophagie, die für die Verbesserung der Mitochondrienfunktion und die Wiederherstellung der Zellgesundheit verantwortlich ist.(44-45)
Mitophagie kann durch intermittierendes Fasten verbessert werden. Diese Verbesserung wird wahrscheinlich durch den Stoffwechselschalter von Glukosebasis zu Keton-basierter Energie während des Fastens gemindert, und diese Verschiebung löst die Mitophagie aus ((((46-47)
Mitochondriale Dysfunktion als Kennzeichen des Alterns
Das Verständnis, wie Mitochondrien zum Alterungsprozess beitragen, steht im Zentrum der Forschung für Gerontologie und Zellbiologie. Mit zunehmendem Alter von Organismen wird die mitochondriale Dysfunktion häufiger, was eine Rolle bei der physiologischen Seite des Alterns spielt.
Die alternden Mitochondrien zeigen eine verminderte Produktion von ATP, was die für das zellulären Wohlbefinden erforderlichen energiegesteuerten Prozesse beeinflusst. Darüber hinaus stören sich die strukturellen Veränderungen in Mitochondrien, die mit dem Alter verbunden sind, noch mehr mit dieser Abnahme der energetischen Leistung, wie z.(48)
Die Position von mitochondriale DNA (mtDNA) In der Nähe der Elektronentransportkette, in der reaktive Sauerstoffspezies auftritt, wirkt sich die Anfälligkeit für Mutation aus. Die Mutationen bauen sich jedoch mit der Zeit auf, was zu einer mitochondrialen Dysfunktion führt. Im Gegensatz zu nuklearer DNA, die zum Schutz an Histone gebunden ist und eine Vielzahl von Reparaturmechanismen zur Verfügung stellt, hat mtDNA keine Schutzbeschichtung durch Histone und hat keine breite Palette von Reparaturmethoden, sodass sie leicht beschädigt werden kann.(49)
In Zellen produzieren Mitochondrien reaktive Sauerstoffspezies (ROS). Obwohl ROS als kritisches Mittel für die Zelle dient, um sich mit ihrer Umgebung zu kommunizieren und sich selbst anzupassen, ist die Erzeugung der hohen Spiegel dieser Moleküle durch strenge Kontrolle begrenzt. Übermäßige Produktion unter verschiedenen altersbedingten Bedingungen führt dazu, dass Zellen unter oxidativem Stress leiden. Es zerstört verschiedene zelluläre Komponenten, ob Proteine, Lipide oder DNA. Die Mitochondrien sind sogar der Hauptempfänger oxidativer Schäden und erzeugen einen Teufelskreis, da beschädigte Mitochondrien nur mehr ROS erzeugen und so die Zellin erhöhen Seneszenz.(50-52)
Die mitochondriale Dynamik ist für die mitochondriale Funktion von entscheidender Bedeutung, die dazu beiträgt, den Fusions- und Spaltprozess aufrechtzuerhalten. Diese Dynamik wird jedoch durch das Altern gestört und die Mitochondrien werden anstelle von Fusion fragmentiert. Diese Veränderungen beeinflussen die Funktion von Mitochondrien und ihre Position in Zellen.(53)
Der Verlust der Mitochondrienfunktion ist kein passives alternungsbedingtes Phänomen, sondern ein aktiver Teilnehmer an der Pathogenese altersabhängiger Krankheiten. Mitochondriale Dysfunktion wurde mit Erkrankungen wie neurodegenerativen Erkrankungen, Herz -Kreislauf -Erkrankungen und Stoffwechselstörungen in Verbindung gebracht. Bei diesen Erkrankungen sind eine verminderte oder defekte Energieerzeugung, verstärkter oxidativer Stress und die Unfähigkeit, beschädigte Mitochondrien zu klären, für die Krankheitspathogenese und den Verlauf von wesentlicher Bedeutung.(54)
Abschluss
Die Optimierung der Mitochondriengesundheit und dessen Rückgang mit dem Altern ist eine herausfordernde Aufgabe, aber zum Glück können wir viel dagegen tun. Hauptinterventionen beinhalten die Ernährungsunterstützung kritischer Substrate für die Regeneration, einschließlich Coenzym Q10, Magnesium und B -Vitamine; regelmäßige Teilnahme an verschiedenen Übungsdisziplinen zur Verbesserung der mitochondrialen Biogenese; und Lebensstilveränderungen wie Kalorienbeschränkungen oder intermittierendes Fasten, um die Mitophagie -Mechanismen zu beeinflussen.
Durch die Erkennung von mitochondriale Dysfunktion als einer der Faktoren, die mit dem Altern verbunden sind, ist diese Strategien für die Unterstützung der Zellgesundheit und die Bekämpfung des altersbedingten Abbaus unerlässlich. Integrative Ansätze, die die Kraft des wissenschaftlichen Wissens in Kombination mit den anwendbaren Änderungen des Lebensstils nutzen, können günstige Bedingungen für die Prävention und die Verlangsamung des Mitochondrienverschleißes schaffen, der insgesamt dem Wohlbefinden und Langlebigkeit eines Individuums dient.
Wissenschaftliche Referenzen
- Leigh, F. (2009). Sir Hans Adolf Krebs (1900–81), Pionier der modernen Medizin, Architekt des Vermittlungsstoffwechsels. Zeitschrift für medizinische Biographie 17 (3): 149–154.
- J. Berg & J. Tymoczko & L. Stryer (2002). Biochemie. 5. Ausgabe. Kapitel 17, der Zitronensäurzyklus. New York: W. H. Freeman.
- H. Wilkins et al. (2014). Oxalacetat aktiviert die mitochondriale Biogenese des Gehirns, verstärkt den Insulinweg, reduziert die Entzündung und stimuliert die Neurogenese. Menschliche molekulare Genetik 23 (24): 6528–6541.
- Potgieter, M. & Pretorius, E. & Pepper, M. (2013). Primärer und sekundärer Coenzym Q10 -Mangel: Die Rolle der therapeutischen Supplementierung. Ernährungsbewertungen 71 (3): 180–188. Rezension.
- Saraste, M. (1999). Oxidative Phosphorylierung am Fin de Siecle. Wissenschaft 283 (5407): 1488-1493.
- Suzuki, T. & Nagao, A. & Suzuki, T. (2011). Humane mitochondriale TRNAs: Biogenese, Funktion, strukturelle Aspekte und Krankheiten. Jährliche Überprüfung der Genetik 45: 299–329.
- Zhang, Y. & Wong, H. (2021). Sind Mitochondrien der Hauptbeitrag von reaktiven Sauerstoffspezies in Zellen? Journal of Experimental Biology 224 (5): Jeb221606.
- Thannickal, V. & Fanburg, B. (2000). Reaktive Sauerstoffspezies bei der Zellsignalisierung. American Journal of Physiology-Lung Cellular and Molekular Physiology 279 (6): L1005-L1028.
- Marín-García, J. & Marín-García, J. (2013). Mechanismen der Bioenergieproduktion in Mitochondrien. Mitochondrien und ihre Rolle bei Herz -Kreislauf -Erkrankungen 99–121.
- Bottje, W. (2019). Oxidativer Stoffwechsel und Effizienz: Der empfindliche Ausgleichsakt der Mitochondrien. Geflügelwissenschaft 98 (10): 4223–4230.
- Pintus, F. & Floris, G. & Rufini, A. (2012). Die Nährstoffverfügbarkeit verbindet Mitochondrien, Apoptose und Fettleibigkeit. Alterung (Albany NY) 4 (11): 734–741.
- Lanza, I. et al. (2012). Die chronische Kalorienbeschränkung bewahrt die mitochondriale Funktion der Seneszenz ohne Erhöhung der mitochondrialen Biogenese. Zellstoffwechsel 16 (6): 777-788.
- Drake, J. & Wilson, R. & Yan, Z. (2016). Molekulare Mechanismen zur mitochondrialen Anpassung an das Training im Skelettmuskel. Das Faseb Journal 30 (1): 13–22.
- Jornayvaz, F. & Shulman, G. I. (2010). Regulation der mitochondrialen Biogenese. Essays in Biochemie 47: 69–84.
- Elamin, M. & Ruskin, D. & Masino, S. & Sacchetti, P. (2017). Ketonbasierte Stoffwechseltherapie: Ist ein erhöhter NAD+ ein primärer Mechanismus? Grenzen der molekularen Neurowissenschaften 10: 377.
- Fowler, B. (1978). Allgemeine subzelluläre Wirkungen von Blei, Quecksilber, Cadmium und Arsen. Umweltgesundheit Perspektiven 22:37-41.
- Hamblin, M. (2018). Mechanismen und mitochondriale Redoxsignale in der Photobiomodulation. Photochemie und Photobiologie 94 (2): 199–212.
- Vatansever, F. & Hamblin, M. (2012). Ferninfrarotstrahlung (FIR): seine biologischen Wirkungen und medizinische Anwendungen. Photonik und Laser in der Medizin 4: 255–266.
- Hollenberg, A. & Huber, A. & Smith, C. & Eliseev, R. (2021). Die elektromagnetische Stimulation erhöht die Mitochondrienfunktion in osteogenen Zellen und fördert die Reparatur der Knochenfraktur. Wissenschaftliche Berichte 11 (1): 19114.
- Tai, Y. et al. (2020). Magnetfelder modulieren den Metabolismus und das Darmmikrobiom in der Korrelation mit der Expression von Alpha: Nachuntersuchung einer in vitro magnetischen Mitohormetischen Studie. Das Faseb Journal 34 (8): 11143–11167.
- Tezgin, D. & Giardina, C. & Perdrizet, G. & Hightower, L. (2020). Die Wirkung von hyperbarem Sauerstoff auf den mitochondrialen und glykolytischen Energiestoffwechsel: das Kaloristasiskonzept. Zellstress und Begleiter 25 (4): 667-677.
- Chen, W. et al. (2020). Hyperbarer Sauerstoff schützt vor der Hemmung von Mitochondrienfunktionsstörungen und Autophagie vor Hemmung von Mitochondrien -Dysfunktion und Autophagie vor einer Myokardischämie. Berichte von Molekularmedizin 22 (5): 4254-4264.
- Wang, Y. & Hekimi, S. (2019). Die Komplexität der Herstellung von Ubiquinon. Trends in Endokrinologie und Stoffwechsel 30 (12): 929-943.
- Volpe, S. (2013). Magnesium bei der Prävention von Krankheiten und allgemeiner Gesundheit. Fortschritte in der Ernährung 4 (3): 378S-383s.
- Depeint, F. & Bruce, W. & Shangari, N. & Mehta, R. & O’Brien, P. (2006). Mitochondrienfunktion und Toxizität: Rolle der B -Vitaminfamilie für den mitochondrialen Energiestoffwechsel. Chemico-biologische Wechselwirkungen 163 (1-2): 94-112.
- Solmonson, A. & Deberardinis, R. (2018). Liponsäurestoffwechsel und mitochondriale Redoxregulation. Zeitschrift für Biologische Chemie 293 (20): 7522-7530.
- A. Gnoni & S. Longo & G. Gnoni & A. Giudetti (2020). Carnitin im menschlichen Muskel -Bioenergetik: Kann die Carnitin -Supplementierung die körperliche Bewegung verbessern? Moleküle 25 (1): 182.
- Wax, B. et al. (2021). Kreatin für Bewegung und Sportleistung mit Erholungsüberlegungen für gesunde Populationen. Nährstoffe 13 (6): 1915.
- Hwang, P. et al. (2020). Auswirkungen der Pyrrolochinolin -Quinon (PQQ) -Supplementierung auf die aerobe Trainingsleistung und Indizes der mitochondrialen Biogenese bei ungeübten Männern. Zeitschrift des American College of Nutrition 39 (6): 547-556.
- Jeromson, S. & Hunter, D. (2014). Beeinflussung der Zusammensetzung der Mitochondrienmembran und der Bioenergetik durch Omega-3-Supplementierung. Das Journal of Physiology 592 (Pt 9): 1913-1914.
- Elhassan, Y. E al. (2019). Nikotinamid-Ribosid erweitert das gealterte menschliche Skelettmuskel NAD+ Metabolom und induziert transkriptomische und entzündungshemmende Signaturen. Zellberichte 28 (7): 1717-1728.
- De Oliveira, M. et al. (2016). Curcumin, mitochondriale Biogenese und Mitophagie: Erforschen der jüngsten Daten und der Angabe zukünftiger Bedürfnisse. Biotechnologie Fortschritte 34 (5): 813-826.
- Handy, D. & Joseph, J. & Loscalzo, J. (2021). Selen, ein Mikronährstoff, der die kardiovaskuläre Gesundheit durch Redoxenzymologie moduliert. Nährstoffe 13 (9): 3238.
- Fernandez-Marcos, P. & Auwerx, J. (2011). Regulation von PGC-1α, einem Knotenregulator der mitochondrialen Biogenese. Das American Journal of Clinical Nutrition 93 (4): 884S-890s.
- Helgerud, J. et al. (2007). Aerobische Intervalle mit hoher Intensität verbessern das VO2MAX mehr als ein moderates Training. Medizin und Wissenschaft in Sport und Bewegung 39 (4): 665–671.
- Burgomaster, K. et al. (2008). Ähnliche metabolische Anpassungen während des Trainings nach Sprintintervall mit geringem Volumen und traditionelles Ausdauertraining beim Menschen. Journal of Physiology 586 (1): 151–160.
- Wilkinson, S. et al. (2008). Differentielle Wirkungen von Resistenz und Ausdauertraining im Fed -Zustand auf die Signalmolekülphosphorylierung und die Proteinsynthese im menschlichen Muskel. Das Journal of Physiology 586 (15): 3701-3717.
- Porter, C. & Reidy, P. & Bhattarai, N. & Sidossis, L. & Rasmussen, B. (2015). Das Widerstandstraining verändert die Mitochondrienfunktion im menschlichen Skelettmuskel. Medizin und Wissenschaft in Sport und Bewegung 47 (9): 1922-1931.
- Baar, K. (2006). Training für Ausdauer und Stärke: Lehren aus der Zellsignalisierung. Medizin und Wissenschaft im Sport & Training 38 (11): 1939-1944.
- Ashrafi, G. & Schwarz, T. (2013). Die Wege der Mitophagie für die Qualitätskontrolle und die Freigabe von Mitochondrien. Zelltod und Differenzierung 20 (1): 31-42.
- Green, D. & Galluzzi, L. & Kroemer, G. (2011). Mitochondrien und die Autophagie -INflammations -Zell -Todesachse in der organischen Altern. Wissenschaft 333 (6046): 1109-1112.
- Mishra, E. & Thakur, M. (2023). Mitophagie: Ein vielversprechendes therapeutisches Ziel für die Neuroprotektion während des Alterns und altersbedingten Krankheiten. British Journal of Pharmacology 180 (12): 1542-1561.
- Cantó, C. & Auwerx, J. (2011). Kalorienbeschränkung: Ist AMPK ein Schlüsselsensor und Effektor? Physiologie 26 (4): 214-224.
- UM, J. et al. (2010). Amp-aktivierte Proteinkinase-defiziente Mäuse sind resistent gegen die metabolischen Wirkungen von Resveratrol. Diabetes 59 (3): 554-563.
- Das, S. & Mitrovsky, G. & Vasanthi, H. & Das, D. (2014). Anti -ing-Eigenschaften eines von Trauben abgeleiteten Antioxidans werden durch mitochondriales Gleichgewicht von Fusion und Spaltung reguliert, was zu einer Mitophagie führt, die durch ein Signalnetzwerk von SIRT1-SIRT3-FOXO3-Pink1-Parkin ausgelöst wird. Oxidationsmedizin und zelluläre Langlebigkeit 2014: 345105.
- Longo, V. & Panda, S. (2016). Fasten, zirkadiane Rhythmen und zeitlich beschränkte Fütterung in einer gesunden Lebensdauer. Zellstoffwechsel 23 (6): 1048-1059.
- Mehrabani, S. & Bagherniya, M. & Askari, G. & Read, M. I & Sahebkar, A. (2020). Die Auswirkung von Fasten oder Kalorienbeschränkungen auf die Mitophagie -Induktion: eine Literaturübersicht. Journal of Cachexia, Sarkopenie und Muskeln 11 (6): 1447-1458.
- Wei, Y. & Lee, H. (2002). Oxidativer Stress, mitochondriale DNA -Mutation und Beeinträchtigung von antioxidativen Enzymen bei der Alterung. Versuchsbiologie und MedikamenteE 227 (9): 671-682.
- Zapico, S. & Ubelaker, D. (2013). mtDNA -Mutationen und ihre Rolle im Altern, Krankheiten und forensischen Wissenschaften. Alterung und Krankheit 4 (6): 364-830.
- Hernansanz-Agustín, P. & Enríquez, J. (2021). Erzeugung reaktiver Sauerstoffspezies durch Mitochondrien. Antioxidantien 10 (3): 415.
- Dunn, J. & Alvarez, L. & Zhang, X. & Soldati, T. (2015). Reaktive Sauerstoffspezies und Mitochondrien: Ein Zusammenhang der zellulären Homöostase. Redoxbiologie 6: 472-485.
- Correia -Melo, C. et al. (2016). Mitochondrien sind für Pro -Aging -Merkmale des seneszenten Phänotyps erforderlich. Das EMBO -Journal 35 (7): 724-742.
- Ong, S. & Kalkhoran, S. & Cabrera-Fuentes, H. & Hausenloy, D. (2015). Mitochondriale Fusions- und Spaltproteine als neuartige therapeutische Ziele zur Behandlung von Herz -Kreislauf -Erkrankungen. Europäisches Journal für Pharmakologie 763: 104-114.
- Chen, G. & Kroemer, G. & Kepp, O. (2020). Mitophagie: Eine aufkommende Rolle bei alternden und altersbedingten Krankheiten. Grenzen in der Zell- und Entwicklungsbiologie 8: 200.